RUOLI BIOLOGICI DELLE PROTEINE
Biochimica
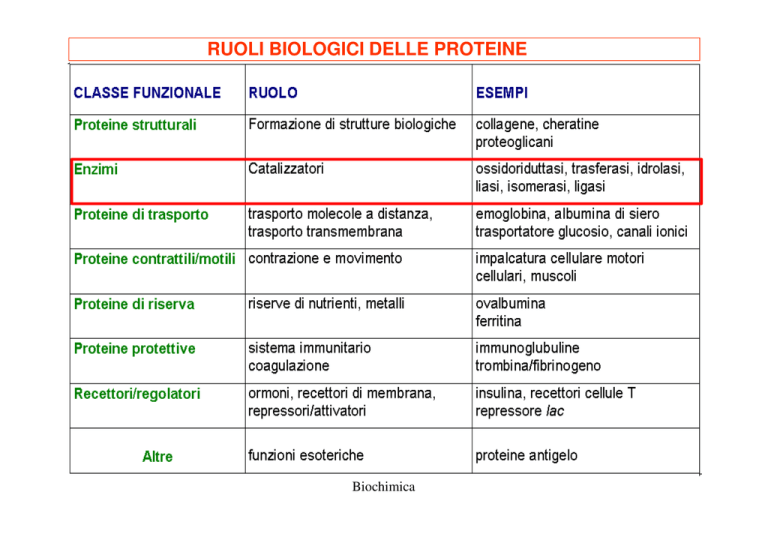
GLI ENZIMI
I) Gli enzimi sono potenti biocatalizzatori
§
Determinano tutte le trasformazioni chimiche cellulari e mediano
l’interconversione tra diverse forme di energia.
§
Aumentano la velocità delle reazioni che catalizzano per un fattore
di almeno 106
§ NON sono modificati dalle reazione che catalizzano.
§ NON alterano l’equilibrio delle reazioni.
§ Però possono accoppiare reazioni energeticamente sfavorevoli (∆G
positivo) con l’idrolisi di ATP (∆G globale negativo, equilibrio prodotto)
§ Normalmente agiscono in un arco ristretto di condizioni (pH,
temperatura).
II) Gli enzimi sono altamente specifici (… se serve).
§
Catalizzano solo un tipo di reazione (es. idrolisi, redox, ecc.)
§ Riconoscono un reagente specifico (il SUBSTRATO)
[es. proteine/peptidi, acidi nucleici, polisaccaridi (o specifiche parti di essi),
acidi grassi/lipidi, metaboliti vari ]
§ Possono riconoscere il substrato con una specificità elevatissima,
oppure in maniera relativamente non specifica, secondo le
necessità biologiche.
III) Gli enzimi possono avere uno o più siti attivi
Possono essere composti da
- una sola subunità con un solo sito attivo (enzima monomerico e
monofunzionale) (A)
- più subunità identiche ciascuna con lo stesso tipo di sito attivo
(enzima multimerico ma monofunzionale) (B)
- più subunità diverse con diversi tipi di siti attivi
(enzima multimerico e multifunzionale) (C)
- un’unica catena con diversi domini strutturali ciascuno con un diverso tipo
di sito attivo (enzima monomerico ma multifunzionale) (D).
(A)
(B)
(C)
(D)
IV) Architettura generale degli enzimi
SITO ATTIVO
- sito di legame
- sito catalitico (amminoacidi/cofattori)
substrato
- sito per stabilizzare l’intermedio di reazione
impalcatura
proteica
SITI REGOLATORI
- Modificazione covalente
irreversibile
PO4
- Modificazione covalente
reversibile (fosforilazione)
- Controllo allosterico
(“eterotropico”)
controllo
allosterico
“omotropico”
protomero
protomero (di un enzima multimerico)
Interfaccia per l’oligomerizzazione
V) Caratteristiche del sito attivo
il sito attivo è una zona relativamente ristretta e ben definita della proteina
• ha una precisa struttura tridimensionale che coinvolge relativamente pochi
residui nella struttura primaria
• questi residui sono vicini nella struttura terziaria ma non necessariamente vicini
nella struttura primaria.
• il sito attivo è composto da:
- il SITO DI LEGAME, generalmente un solco o una cavità nella superficie
dell’enzima, con una elevata complementarità di forma con il substrato (o
intermedio di reazione), che permette di instaurare interazioni multiple [legamiH (direzionali), interazioni elettrostatiche (utili per docking), forze di vdW
(complementarità); interazioni idrofobiche (favoriscono l’associazione)].
- il SITO CATALITICO, che può essere composto solo da residui amminoacidici,
oppure può coinvolgere anche GRUPPI PROSTETICI (cofattori o coenzimi).
- SITI per la STABILIZZAZIONE DI INTERMEDI della reazione catalizzata
VI) L’attività di molti enzimi è regolata da fattori esterni
§ CONTROLLO ALLOSTERICO
-omotropico: il legame del substrato stesso stimola il legame di un’altra
molecola di substrato in un altro sito attivo (+
+)
-eterotropico: il legame di una molecola diversa dal substrato, ad un sito
diverso dal sito di legame, modula l’attività catalitica (±
±)
§ MODIFICAZIONI COVALENTI REVERSIBILI
- attivazione/disattivazione mediante fosforilazione/defosforilazione (±
±)
§ MODIFICAZIONI COVALENTI IRREVERSIBILI
- attivazione mediante taglio proteolitico della catena enzimatica (+
+)
§ INIBIZIONE COMPETITIVA (−
−) una sostanza simile al substrato blocca il sito
di legame
§ CONTROLLO GENICO (+
+) l’enzima è prodotto solo quando serve, e nelle
quantità che servono
§ CONTROLLO per COMPARTIMENTLIZZAZIONE
VI) modelli d’azione - la complementarietà di forma
due modelli descrivono l’interazione enzima/substrato:
Modello a chiave e serratura
(Emil Fisher, 1890)
Modello ad adattamento indotto
(Daniel Koshland Jr., 1958)
A
Es.: le chinasi
In questo modello, il sito attivo ha una forma
complementare a quella del substrato
La selettività è data da questa
Complementarietà di forma
In questo modello, il sito attivo cambia forma
In seguito al legame del substrato, la forma
diventa più complementare a quella del substrato,
(si adatta) e l’enzima si attiva
VII)
Catene e cascate enzimatiche
CATENA
S1 + E1
S2 + E2
S3 + E3
S4 + E4
TRASFORMAZIONE
CASCATA
iE=
aE
1+
iE
aE
2
2+
aE
inattivo
iE
iE
aE
3
1
aE=
aE
2
iE
3+
iE
4
aE
attivo
aE
iE
3
aE
4
S
S
P
AMPLIFICAZIONE
2
3
4+
4
P
VIII) Principi fondamentali dell’azione enzimatica
Stabilizzazione dello stato di transizione nella reazione
— Effetti sterici e di prossimità - posizionamento / deformazione
— Catalisi generale acido-basica - addizione/rimozione di protoni
— Catalisi covalente - legame transiente con catene laterali nucleofile
— Effetti elettrostatici - distribuzione favorevole alla reazione della carica (densità
elettronica) nel sito attivo
IX)
Componenti del sito catalitico
Il sito catalitico può utilizzare solo la reattività chimica delle catene laterali
di alcuni amminoacidi (negli enzimi semplici):
Asp & Glu (-COOH ); Ser & Tyr (-OH )
Cys (-SH ); Lys (-NH2 );
His (-NH)
In molti casi però, gli enzimi utilizzano la reattività chimica aggiuntiva di altre specie
chimiche (enzimi coniugati):
1) COFATTORI - ioni metallici che formano legami di coordinazione multipli e che
agiscono da catalizzatori elettrofilici, che facilitano spostamenti di densità elettronica
2) COENZIMI - molecole organiche derivate da vitamine idrofile o lipofile che catalizzano
reazioni tipo redox o di trasferimento o riarrangiamento di gruppi chimici
Proteine
semplici
Proteine
coniugate
solo AA
gruppi
prostetici
ENZ IMI
Metalli e ioni metallici
FeII, FeIII, CuII
ZnII, MgII, MnII, Mo, Se
L’enzima coniugato con il suo gruppo
prostetico e noto come oloenzima ed è
attivo
In assenza del gruppo prostetico è
noto come apoenzima ed è inattivo
COENZIMI
NAD, FAD, FMN, CoA
derivati di vitamine
X) Gli enzimi trasformano energia (accoppiando reazioni)
S
P
∆G = ∆E - T ∆S (1)
Keq = [P]/[S]
∆G = ∆G°’ + RT ln [P]/[S]
ad equilibrio, ∆G = 0,
(2)
∆G°’ = - RT ln[P]/[S] (3)
∆G°’ = - RTlnK eq = -2,303RT log10eqK
K eq = 10[-∆G°’/(2,303RT)]
= 10-∆∆G°’/5,6 (4)
[R = 8,315x10-3, T = 298K (25°C)]
Più negativo diventa ∆G°’ più aumenta Keq
Questo avviene se l’enzima accoppia la reazione con l’idrolisi di ATP
Ogni variazione di 5,6 kJ/mol (-1.36 kcal/mol) in ∆G comporta un aumento di
10 volte in Keq
XI) Gli enzimi diminuiscono l’energia dello stato di transizione
S
P
V=
d[S]
dt
(M s-1)
reaz. 1° ordine V = k [S]
k = costante di velocità (s-1)
1) posizionano e/o distorgono il substrato/i
2) stabilizzano gli intermedi di reazione (S‡)
3) spesso il sito di legame ha una forma più complementare allo stato di
transizione (TS) che al substrato stesso
k= c·
‡
-(∆
∆
G
/RT)
exp
Quindi, se ∆G ‡
S1 + S2
k
V
P
reaz. 2°ordine V = k [S1][S2]
k = costante di velocità (M-1 s-1)
IX) Classificazione degli enzimi (numero EC)(Enzyme Commission N°)
1) Ossidoriduttasi
- reazioni redox (trasferimento O, H o e-)
2) Transferasi
- trasferimento intermolecolare gruppi funzionali
(−CH3, RCO−, NH3+−, PO42-− )
3) Idrolasi
- reazioni di idrolisi (scissione legame)
4) Liasi/sintasi
- addizione o rimozione non idrolitica di gruppi
(rottura non idrolitica di legami)
5) Isomerasi
- riarrangiamenti intramolecolari
6) Ligasi (sintetasi)
- formazione di legami (ATP dipendente)
n.b. l’EC non specifica l’enzima ma la reazione che catalizza
es. Idrolasi
- 3.1
- 3.2
- 3.4
- idrolisi di legami estere e fosfoestere
- idrolisi di legami glicosidici
- idrolisi di legami peptidici
hydrolase
serine endopeptidases
tripsina EC 3.4.21.4
trypsins
acting on peptide bond (peptidase)












