Lattato deidrogenasi
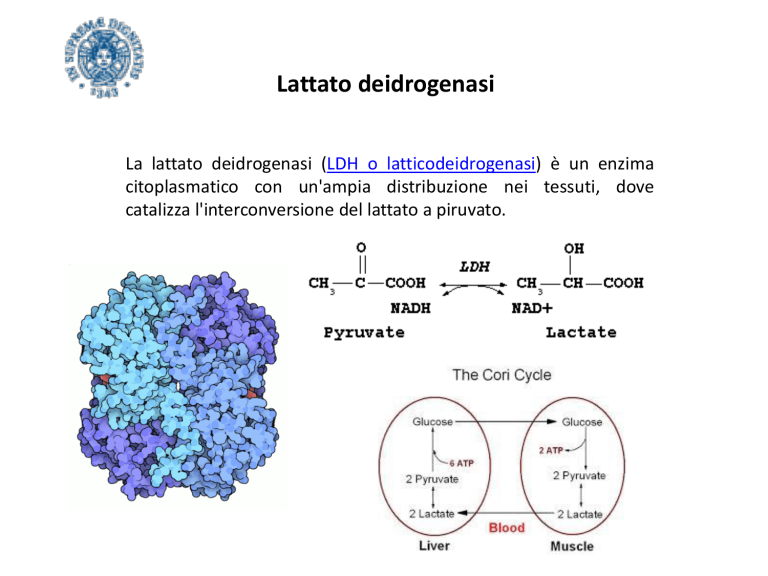
La lattato deidrogenasi (LDH o latticodeidrogenasi) è un enzima
citoplasmatico con un'ampia distribuzione nei tessuti, dove
catalizza l'interconversione del lattato a piruvato.
La lattato deidrogenasi è un tetramero con subunità polipeptidiche a sequenza
distinta, H ed M, che combinandosi fra loro danno origine a cinque diversi
isoenzimi:
LDH 1 e LDH 2 sono elevati nel cuore e negli eritrociti,
LDH 4 e LDH 5 sono elevati nel fegato e nel muscolo.
Isoenzima
LDH1
LDH2
LDH3
LDH4
LDH5
composizione
HHHH
HHHM
HHMM
HMMM
MMMM
localizzazione
prevalente
miocardio
globuli bianchi, eritrociti
polmoni
reni, pancreas e placenta
muscolo scheletrico, fegato
LDH presente nel siero entro limiti fisiologici. La sua
distribuzione tissutale può rendere utile il dosaggio della lattato
deidrogenasi nel siero per valutare la sede di danno cellulare in
appoggio ad altri marcatori più specifici (ex. infarto miocardio).
Chimica clinica - Presenza della LDH nel siero – profilo % delle isoforme
Elettroforesi in condizioni native (thin-layer agarose gel) LDH1 e LDH 5 hanno migrazione diversa.
Infarto del miocardio e lattico deidrogenasi
LDH
SAGGIO ENZIMATICO
Condizioni:
• cinetica di ordine zero rispetto a S (velocità della reazione indipendente da S)
• variazioni di S o P lineari nel tempo (cinetica temporale)
• se S>>>Et la Legge di Michaelis e Menten:
V0=K [Et] [S] / Km + [S]
ci assicura che V0 è direttamente proporzionale a [Et] ; migliore condizione di saggio
alla Vmax : V0 dipende solo da [Et]
SAGGI CONTINUI
Sono più accurati e meno laboriosi di quelli discontinui
Per lo più usano metodi spettrofotometrici
• SAGGI DIRETTI
E + S E + P (prodotto colorato - cromoforo
o fluorescente – fluoroforo)
Esempio:
O
C
O-
C
O
+
NADH
CH3
Piruvato
O
C
H C
Lattato
Deidrogenasi
(LDH)
OOH
CH3
Lattato
+
NAD+
Per rivelare e quantificare l’attività di un enzima in un campione biologico
Ci si avvale delle proprietà degli enzimi:
• della specificità di azione
• della proporzionalità tra Vel. di reazione catalizzata e concentrazione dell’E nel miscuglio di
reazione (in condizioni di S saturante, vel ordine zero).
Si segue la reazione nel tempo e si registra l’Assorbanza nella zona di variazione costante
(tratto lineare) prendendo un intervallo di tempo Δt e si rileva ΔA.
ΔA/ Δt= è una misura della velocità della reazione enzimatica espressa come variazione di
assorbanza al minuto da cui si ricava l’attività enzimatica espressa come U/ml
Si devono calcolare le µmol di S trasformate in P al minuto = Unità di attività enzimatica
Applico la legge di Lambert & Beer :
ΔA= ε ΔC l
ε = coefficiente di estinzione molare
l=1
ΔC = ΔA/ ε
Micromoli di S trasformate al minuto (per litro di miscuglio di incubazione) = Unità di attività
enzimatica