Chimica Biologica
A.A. 2010-2011
Ciclo dell’Acido Citrico
Marco Nardini
Dipartimento di Scienze Biomolecolari e Biotecnologie
Università di Milano
Macromolecole Biologiche
Ciclo dell’Acido Citrico
- la glicolisi non è l’unica via catabolica in grado di produrre energia
Anzi, le cellule che dipendono solo dalla glicolisi per soddisfare le proprie
necessità metaboliche sprecano la maggior parte dell’energia chimica
potenziale dei carboidrati perché il glucosio viene convertito in prodotti
come il lattato e l’etanolo che lasciano la cellula in forma ancora
relativamente ridotta
Ciclo acido citrico, o “ciclo di Krebs”, o “ciclo acidi tricarbossilici”(TCA)
- via catabolica fondamentale del metabolismo aerobico
- rappresenta la via comune della degradazione ossidativa di tutti i nutrienti
energetici (carboidrati, lipidi, e anche proteine) nelle cellule aerobiche
Macromolecole Biologiche
Ciclo dell’Acido Citrico
- dal punto di vista biochimico, la respirazione è
l’ossidazione da parte dell’O2 di substrati organici
- negli eucarioti la respirazione cellulare ha sede
nel mitocondrio
- la respirazione avviene in 3 stadi:
(1) generazione di acetil-CoA
forma attivata di gruppo acetile,
composto a 2 atomi di carbonio
(2) ossidazione del gruppo acetile
dell’acetil-CoA (ciclo dell’acido citrico)
⇒ produzione di CO2 e trasportatori ridotti
di elettroni (NADH, FADH2)
(3) ossidazione da parte dell’O2 dei trasportatori
ridotti di elettroni nel trasporto degli elettroni accoppiato alla sintesi di
ATP (fosforilazione ossidativa)
Macromolecole Biologiche
Vie Metaboliche
Compartimentalizzazione cellulare
Macromolecole Biologiche
Ciclo dell’Acido Citrico
Localizzazione del Catabolismo Ossidativo
Il mitocondrio: “centrale energetica” della cellula
- sito dove avviene il metabolismo ossidativo degli eucarioti
Contiene:
vedi
diapositiva
precedente
- piruvato deidrogenasi (1)
- alcuni enzimi del ciclo dell’acido citrico (2)
- enzimi che catalizzano l’ossidazione degli acidi grassi
- enzimi e proteine redox coinvolte nel trasporto degli
elettroni e nella fosforilazione ossidativa (3)
~ 2000 mitocondri in una cellula
eucariotica che occupano ~1/5
del volume totale della cellula
- forma ellittica e dimensioni
~0.5 x 1.0 μm
~ dimensioni di un batterio
Macromolecole Biologiche
Sintesi dell’Acetil-CoA
Sintesi dell’acetil-CoA
- i gruppi acetilici entrano nel ciclo TCA come parte del composto ad alta
energia acetil-CoA (i tioesteri sono composti con elevata energia libera
di idrolisi)
- una proteina di trasporto trasferisce il piruvato insieme a H+ all’interno
dei mitocondri per l’ulteriore ossidazione (simporto piruvato-H+)
- decarbossilazione ossidativa del piruvato ⇒ Acetil-CoA
- complesso multienzimatico della Piruvato deidrogenasi
contenente 3 enzimi in copie multiple e 5 coenzimi
Macromolecole Biologiche
Sintesi dell’Acetil-CoA
Complesso della Piruvato deidrogenasi
- complesso multienzimatico contenente 3 enzimi in copie multiple
E1 ⇒ piruvato deidrogenasi
E2 ⇒ diidrolipoil transacetilasi
E3 ⇒ diidrolipoil deidrogenasi
E.coli: 60 subunità totali (~4600 kD, diametro ~300 Å)
24 proteine E2 (associate in trimeri agli angoli di un cubo) palline verdi
24 proteine E1 (associate in dimeri lungo i 12 lati del cubo) palline arancioni
12 proteine E3 (associate in dimeri sulle 6 facce del cubo) palline viola
- il complesso di mitocondrio di mammifero ha dimensioni doppie di
quelle del complesso di E. coli e contiene anche subunità regolatorie
Macromolecole Biologiche
Sintesi dell’Acetil-CoA
Complesso della Piruvato deidrogenasi
vantaggi complessi multienzimatici
- gruppi di enzimi associati in modo non covalente che catalizzano 2 o più
tappe in successione di una via metabolica
- evoluzione verso una maggior efficienza catalitica:
(a) minimizzazione delle distanze percorse dai substrati per
raggiungere i vari siti attivi ⇒ aumento della velocità di reazione
(b) riduzione di reazioni fra intermedi metabolici di reazioni
successive con altre molecole (minimizzazione reazioni
collaterali)
(c) le reazioni possono essere controllate in modo coordinato
Macromolecole Biologiche
Sintesi dell’Acetil-CoA
Complesso della Piruvato deidrogenasi
- il complesso catalizza 5 reazioni enzimatiche in successione
stechiometria totale
Piruvato + CoA + NAD+ → acetil-CoA + CO2 + NADH
- 5 diversi coenzimi:
(a) tiamina pirofosfato (TPP)
(b) lipoamide
(c) coenzima A
(d) FAD
(e) NAD+
Macromolecole Biologiche
Sintesi dell’Acetil-CoA
1) Piruvato deidrogenasi (E1)
- enzima TPP-dipendente
Reazione: decarbossilazione del piruvato con formazione dell’intermedio
idrossietil-TPP
(reazione identica a quella catalizzata dalla piruvato decarbossilasi di
lievito durante la fermentazione alcolica)
Macromolecole Biologiche
Sintesi dell’Acetil-CoA
1) Piruvato deidrogenasi
ylid: carbanione dipolare (forma
attiva di TPP)
(1) attacco nucleofilico di ylid
al C carbonilico del piruvato
(2) rilascio di CO2 per dare
un carbanione stabilizzato
per risonanza
anello tiazolico come trappola di elettroni
Macromolecole Biologiche
Sintesi dell’Acetil-CoA
2) Diidrolipoil transacetilasi (E2)
- enzima contenente gruppo lipoamidico
- lipoamide: acido lipoico legato con legame amidico al gruppo ε
amminico di una Lys
- centro reattivo: disolfuro ciclico che
può essere ridotto reversibilmente
con formazione di diidrolipoamide
Macromolecole Biologiche
Sintesi dell’Acetil-CoA
2) Diidrolipoil transacetilasi (E2)
- l’intermedio idrossietil-TPP attacca il disolfuro della lipoamide e viene
eliminata TPP
- il carbanione idrossietile (forma attivata del gruppo aldeidico) viene
ossidato a gruppo acetile e passato al lipoamide (formando un gruppo
tioestere: forma attivata del gruppo acetile).
- il disolfuro della lipoamide viene ridotto
Macromolecole Biologiche
Sintesi dell’Acetil-CoA
3) Diidrolipoil transacetilasi (E2)
Reazione: transesterificazione in cui il gruppo acetile è trasferito sul CoA
con formazione di acetil-CoA e diidrolipoamide-E2
CoA—SH
+
H
Sintesi dell’Acetil-CoA
Macromolecole Biologiche
Acetil-CoA
- il coenzima A è un trasportatore di gruppi acile attivati
- la porzione attiva del CoA è il gruppo tiolico
- l’acetil-CoA contiene un gruppo tioestere
- l’acil-CoA ha un elevato potenziale di trasferimento del gruppo acile
Sintesi dell’Acetil-CoA
Macromolecole Biologiche
Reazioni 1, 2, 3
riossidazione del
gruppo lipoamide
Macromolecole Biologiche
Sintesi dell’Acetil-CoA
4) Diidrolipoil deidrogenasi (E3)
Reazione: rigenerazione (riossidazione) del gruppo lipoamide di E2
da parte di E3
- E3 nella forma ossidata contiene un gruppo disolfuro ed un FAD
- l’ossidazione della diidrolipoamide è una reazione di interscambio di
disolfuri
Sintesi dell’Acetil-CoA
Macromolecole Biologiche
Reazioni 1, 2, 3, 4
riossidazione
di E3 ridotta
Macromolecole Biologiche
Sintesi dell’Acetil-CoA
5) Diidrolipoil deidrogenasi (E3)
Reazione: riossidazione di E3 ridotta
- i gruppi sulfidrilici vengono riossidati dal FAD
- il FADH2 risultante viene ossidato dal NAD+ producendo NADH
Macromolecole Biologiche
Sintesi dell’Acetil-CoA
5) Diidrolipoil deidrogenasi (E3)
- il FAD legato a proteine ha un potenziale
di riduzione ~0 V
- FADH2 è inadatto per donare elettroni
a NAD+ (E0’ = -0.315 V)
- nella diidrolipoil deidrogenasi FAD
non diventa mai completamente ridotto
a FADH2
- grazie al preciso posizionamento dell’anello flavinico e nicotinamidico,
il FAD agisce come “conduttore di elettroni” dal disolfuro della proteina
a NAD+ attraverso la formazione transiente di un anione flavinico FADH-
Macromolecole Biologiche
Sintesi dell’Acetil-CoA
Complesso della Piruvato deidrogenasi
- il gruppo idrossietile legato alla TPP viene trasferito alla lipoamide ossidata
riducendola a diidrolipoamide
- l’idrossietile (aldeide) viene contemporaneamente ossidato ad acetile
- quando l’acetile è trasferito al CoA, due elettroni restano sulla diidrolipoamide
Macromolecole Biologiche
Sintesi dell’Acetil-CoA
Complesso della Piruvato deidrogenasi
Braccio di lipoillisina
- incanalamento degli intermedi di reazione
fra E2 (core complesso) ed E1 e E3
- il braccio di lipoillisina si comporta come una
lunga articolazione che fa oscillare il gruppo
disolfuro da E1 al sito attivo di E2 e poi su E3
⇒ da E1 raccoglie un gruppo idrossietilico
⇒ nel sito attivo di E2 il gruppo idrossietilico
è trasferito per formare acetil-CoA
⇒ su E3 viene riossidato il gruppo disolfuro ridotto
- una proteina E1 è in grado di acetilare numerose
proteine E2 e una proteina E3 può riossidare
diversi gruppi diidrolipoamidici
Macromolecole Biologiche
Sintesi dell’Acetil-CoA
Inattivazione del Complesso della Piruvato deidrogenasi
Avvelenamento da Arsenico
- inattivazione da parte dell’arsenito (AsO33-) e degli arsenicali organici
degli enzimi contenenti lipoamide (Es: complesso della piruvato
deidrogenasi e α-chetoglutarato deidrogenasi) ⇒ blocco respirazione
- legano composti sulfidrilici che possono formare addotti bidentati
- AS-organici più tossici per i microorganismi che per l’uomo
⇒ uso antibiotico (effetti collaterali piuttosto gravi)
Napoleone
Darwin
coloranti tappezzerie
“soluzione di Fowler’s”
Macromolecole Biologiche
Ciclo dell’Acido Citrico
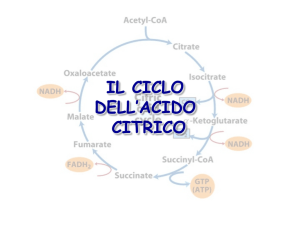
Ciclo Acido Citrico
- Ciclo di Krebs o Ciclo degli acidi tricarbossilici (TCA):
- serie di 8 reazioni che ossidano il gruppo acetile dell’acetil-CoA a 2
molecole di CO2, conservando l’energia libera prodotta nei composti
ridotti NADH (3 molecole) e FADH2 (1 molecola) ed un composto ad
alta energia (1 molecola di ATP o GTP)
reazione netta:
3NAD+ + FAD + GDP + Pi + acetil-CoA → 3NADH + FADH2 + GTP + CoA + 2 CO2
- l’ossidazione di un gruppo acetile a 2 CO2 richiede il trasferimento di 4
paia di e- ⇒ riduzione di 3 NAD+ e di un FAD
Ciclo dell’Acido Citrico
Macromolecole Biologiche
Ciclo Acido Citrico
- il ciclo TCA si comporta come un catalizzatore a tappe multiple in
grado di ossidare un numero illimitato di gruppi acetili (l’ossalacetato
consumato nella prima tappa è rigenerato nell’ultima reazione del ciclo)
⇒ l’ossalacetato
è sia un reagente della prima reazione,
sia un prodotto dell’ultima
Macromolecole Biologiche
Ciclo dell’Acido Citrico
Ciclo Acido Citrico
- negli eucarioti tutti gli enzimi del ciclo TCA sono localizzati nei mitocondri
⇒ tutti i substrati (compresi NAD+ e GDP) devono essere generati nei
mitocondri o trasportati al loro interno dal citosol
⇒ tutti i prodotti devono essere consumati nei mitocondri o trasportati al
loro esterno dal citosol
- il risultato netto di un ciclo è l’ossidazione di un gruppo acetile a 2 CO2,
ma gli atomi di carbonio delle 2 molecole di CO2 non sono quelli del
gruppo acetile
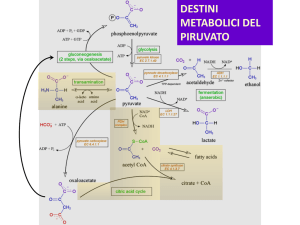
- gli intermedi del ciclo TCA sono anche precursori della biosintesi di altri
composti (es: ossalacetato per la gluconeogenesi)
Ciclo dell’Acido Citrico
Macromolecole Biologiche
1) Citrato sintasi
Reazione: condensazione di acetil-CoA ed ossalacetato
- meccanismo cinetico sequenziale ordinato:
⇒ l’ossalacetato si lega all’enzima
prima dell’acetil-CoA
- reazione fortemente esoergonica dato
che l’acetil-CoA ha un forte potenziale
di trasferimento del gruppo acetile
- “sintasi”: gruppo di enzimi che catalizzano
reazioni di sintesi senza impiego di ATP
(come invece avviene nel caso delle “sintetasi”)
(liasi)
Ciclo dell’Acido Citrico
Macromolecole Biologiche
1) Citrato sintasi
- proteina dimerica
enzima libero (forma aperta)
enzima + ossalacetato (forma chiusa)
sito legame
ossalacetato
- il cambiamento conformazionale genera il sito di legame per l’acetil-CoA
ed isola il sito di legame dell’ossalacetato dal solvente
Ciclo dell’Acido Citrico
Macromolecole Biologiche
2) Aconitasi
Reazione: Isomerizzazione reversibile del citrato in D-isocitrato
⇒ trasferimento del gruppo -OH del gruppo alcoolico terziario al carbonio
adiacente, a dare un gruppo alcoolico secondario più adatto ad essere
ossidato a gruppo carbonilico
- l’aconitato (che da il nome all’enzima) è un intermedio che
esiste solo come complesso con l’enzima
Ciclo dell’Acido Citrico
Macromolecole Biologiche
2) Aconitasi
a) deidratazione: vengono rimossi un protone ed un gruppo OH
b) reidratazione: … del doppio legame del cis-aconitato
⇒ si potrebbero formare 4 potenziali stereoisomeri per l’isocitrato. Invece la
aconitasi catalizza l’addizione stereospecifica di OH- e H+ con la
produzione di un solo stereoisomero
Citrato = molecola prochirale ⇒ diventa chirale per sostituzione di un gruppo
carbossimetilico –CH2COO-)
- interazione asimmetrica (su 3 punti) fra citrato ed enzima
Ciclo dell’Acido Citrico
Macromolecole Biologiche
3) Isocitrato deidrogenasi NAD+-dipendente
Reazione: decarbossilazione ossidativa dell’isocitrato ad α-chetoglutarato
- viene prodotta la prima molecola di CO2 e di NADH del ciclo dell’acido
citrico (NB: CO2 proviene dall’ossalacetato e non dall’acetil-CoA)
- l’enzima usa Mn2+ o Mg2+ come cofattori
a) ossidazione di un alcol secondario (isocitrato) a chetone (ossalosuccinato)
b) decarbossilazione del gruppo carbossilico β a chetone
Mn2+ aiuta la polarizzazione del gruppo
carbonilico che si forma
l’intermedio ossalosuccinato esiste transientemente e
non si dissocia dall’enzima
Macromolecole Biologiche
Ciclo dell’Acido Citrico
4) α-chetoglutarato deidrogenasi
Reazione: decarbossilazione ossidativa di un α-chetoacido (α-chetoglutarato)
- viene prodotta la seconda molecola di CO2 e di NADH del ciclo
dell’acido citrico (NB: CO2 proviene dall’ossalacetato e non dall’acetil-CoA)
⇒ durante ogni ciclo vengono ossidati 2 atomi di
C a CO2, ma gli atomi dei gruppi acetili che
entrano nel ciclo vengono ossidati a CO2 nei
giri successivi (come ossalacetati)
Macromolecole Biologiche
Ciclo dell’Acido Citrico
4) α-chetoglutarato deidrogenasi
- multicomplesso enzimatico simile (e reazione identica) alla piruvato
deidrogenasi:
- α-chetoglutarato deidrogenasi (E1)
- diidrolipoil transsuccinalasi (E2)
- diidrolipoil deidrogenasi (E3) (identica a E3 della piruvato deidrogenasi)
Prodotto: formazione di un tioestere ad alta energia (succinil-CoA)
⇒ parte dell’energia della decarbossilazione ossidativa è convertita nel gruppo
tioestere del succinil-CoA
(passaggio è fortemente esoergonico)
Ciclo dell’Acido Citrico
Macromolecole Biologiche
5) succinil-CoA sintetasi
Reazione:
accoppiamento della scissione esoergonica
(ΔG0’ = -32.6 kJ/mole) del legame al “alta
energia” del succinil-CoA alla sintesi endoergonica
(ΔG0’ = 30.5 kJ/mole) di un nucleotide trifosfato
ad “alta energia” (fosforilazione a livello del substrato)
nome riferito alla
reazione inversa
mammiferi: sintesi di GTP da GDP + Pi
piante e batteri: sintesi di ATP da ADP + Pi
reazioni energeticamente equivalenti poiché ATP e GTP sono interconvertibili
rapidamente mediante la reazione della nucleoside difosfato chinasi
Ciclo dell’Acido Citrico
Macromolecole Biologiche
6, 7, 8
- dopo la quinta reazione l’equivalente di un gruppo acetile è stato
completamente ossidato a 2 CO2 e sono stati generati 2 NADH e 1 GTP
- le ultime 3 reazioni del ciclo servono a convertire il succinato in ossalacetato in
modo da completare il ciclo
Macromolecole Biologiche
Ciclo dell’Acido Citrico
6) succinato deidrogenasi
Reazione: deidrogenazione flavina-dipendente del
succinato con formazione di fumarato
- l’ossidante è FAD, ossidante più forte del NAD+
- la reazione è stereospecifica ⇒ forma fumarato
(configurazione trans, e non il suo stereoisomero
cis, il maleato)
- inibizione competitiva da malonato (analogo
strutturale del succinato)
Ciclo dell’Acido Citrico
Macromolecole Biologiche
7) fumarasi
Reazione: idratazione del doppio legame del
fumarato a formare malato
- formazione di un carbanione nello stato di transizione
(l’addizione di OH- prima dell’addizione di H+)
Ciclo dell’Acido Citrico
Macromolecole Biologiche
8) malato deidrogenasi
Reazione: rigenerazione dell’ossalacetato
- ossidazione NAD-dipendente del gruppo ossidrilico del malato
- stesso meccanismo della lattato deidrogenasi e dell’alcol deidrogenasi
(strutture molto simili)
Ciclo dell’Acido Citrico
Macromolecole Biologiche
8) malato deidrogenasi
- ΔG0’ = +29.7 kJ/mole
⇒ all’equilibrio (e in condizioni cellulari) la
conc. di ossalacetato è molto bassa rispetto
a quella del malato
- Citrato sintasi: ΔG0’ = -31.1 kJ/mole
reazione fortemente esoergonica
⇒ la formazione di citrato diventa un processo
esoergonico anche alle basse [ossalacetato]
presenti nelle cellule e quindi aiuta lo svolgersi
del ciclo dell’acido citrico
(si capisce ora il bisogno di un processo così esoergonico che
apparentemente sembrava uno spreco di energia)
Macromolecole Biologiche
Ciclo dell’Acido Citrico
Reazione bilanciata di un giro attraverso il ciclo
dell’acido citrico
Acetil-CoA + 3H2O +3NAD+ + FAD + GDP + Pi → 2CO2 + 3NADH + FADH2 + CoA-SH + GTP
- il GTP è energeticamente equivalente all’ATP: la nucleoside difosfato
chinasi interconverte gli NTP
- la reazione bilanciata complessiva del catabolismo del glucosio
attraverso glicolisi + ciclo dell’acido citrico è:
Glucosio + 2H2O + 10NAD+ + 2FAD + 4ADP + 4Pi → 6 CO2 + 10 NADH + 6H+ + 2FADH2 + 4ATP
Macromolecole Biologiche
Ciclo dell’Acido Citrico
Capacità del ciclo di produrre energia
- ossidazione del gruppo acetile a 2 molecole di CO2 (non sono gli atomi
di C del gruppo acetile entrante che vengono ossidati) che coinvolge 4
coppie di elettroni, infatti
- per ogni acetil-CoA che entra nel ciclo:
3 NAD+ sono ridotti a NADH ⇒ acquisto di 3 coppie di elettroni
1 FAD è ridotto a FADH2 ⇒ acquisto di 1 coppia di elettroni
viene prodotto 1 GTP (o ATP)
- gli elettroni trasportati da NADH entrano nella catena di trasporto
degli elettroni con riduzione finale di O2 ad H2O
- l’energia ricavata dal trasporto degli elettroni viene conservata per la
sintesi di ATP che avviene mediante la fosforilazione ossidativa
riduzione NADH ⇒ produzione di ~2.5 ATP a partire da ADP + Pi
riduzione FADH2 ⇒ produzione di ~1.5 ATP
Macromolecole Biologiche
Ciclo dell’Acido Citrico
Capacità del ciclo di produrre energia
- glicolisi: 1 glucosio viene convertito in
2 molecole di piruvato
⇒ 2 ATP + 2 NADH (~7 ATP)
5 ATP
2 ATP
- complesso piruvato deidrogenasi:
2 molecole di piruvato
convertite in 2 acetil-CoA
⇒ 2 NADH (~5 ATP)
5 ATP
- per ogni ciclo si generano ~ 10 ATP
⇒ 2 giri del ciclo dell’acido citrico
(uno per gruppo acetile) (~20 ATP)
15 ATP
3 ATP
2 ATP
In condizioni aerobiche 1 glucosio può potenzialmente promuovere la
sintesi di ~32 ATP. Solo 2 ATP in condizioni di anaerobiosi
Ciclo dell’Acido Citrico
Macromolecole Biologiche
Regolazione del ciclo
Tappe che limitano la velocità del ciclo
condizioni
standard
- 3 enzimi operano in condizioni
lontane dall’equilibrio
- meccanismi di regolazione
a) disponibilità del substrato
(specialmente NAD+)
b) inibizione da prodotto
c) inibizione retroattiva competitiva
di intermedi prodotti più avanti
nel ciclo
d) regolazione allosterica
e) modificazioni covalenti (fosforilazione)