IL PRINCIPIO
DI PAULI
IN ASTRONOMIA
di Elisa Londero
Com’è noto
, gli elementi chimici che costituiscono la tavola periodica
vengono identificati attraverso il loro numero atomico, detto “Z”. Infatti, un atomo
elettricamente neutro contiene “Z” protoni nel nucleo e “Z” elettroni che vanno a
formare la cosiddetta nuvola elettronica.
Per uno stesso elemento, prendendo in
considerazione il numero di neutroni “N”
nel nucleo, si distinguono poi i diversi isotopi. Infine, il numero di massa A = N+Z,
indica il numero complessivo delle particelle nucleari nel nucleo atomico.
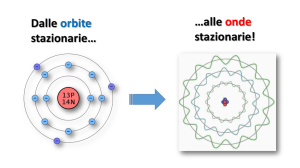
Premettiamo che con il termine orbitale
si indica la zona intorno al nucleo dove
esiste la massima probabilità di trovare
l’elettrone. Questa interpretazione statistica proposta dal fisico tedesco M. Born
sostituì nel 1926 la descrizione più ingenua degli elettroni che si muovono su determinate orbite attorno al nucleo come i
pianeti attorno al Sole.
Nel 1925, il fisico austriaco W. Pauli, attraverso il principio di esclusione (o principio
di Pauli) ha determinato la regolarità
secondo la quale vengono riempiti i gusci
energetici: uno stato elettronico (definito
da certi numeri quantici) può essere occupato al massimo da un elettrone.
Ciò significa che due elettroni non possono avere gli stessi numeri quantici,
ovvero in termini di quanto è stato
appena detto, due elettroni possono
coesistere in uno stesso orbitale solo se
dotati di spin opposto.
Il principio di Pauli non vale solo per gli
elettroni ma per tutti i fermioni (particelle a spin semintero): due fermioni
identici non possono occupare gli stessi
numeri quantici.
Le caratteristiche chimiche di un elemento dipendono dalla configurazione elettronica della nuvola di elettroni. Quindi
si può concludere che tutti gli atomi che
stanno in un certo gruppo del sistema
periodico degli elementi possiedono una
struttura simile, per lo meno per quanto
riguarda gli elettroni più esterni (elettroni
di valenza, quelli che vengono coinvolti
nei legami chimici), questo perché le strutture elettroniche esterne degli elementi
periodicamente si ripetono ogniqualvolta
si conclude il riempimento di un livello
per iniziarne un altro. Quindi i gas nobili
(He, Ne, Ar, Kr), i metalli alcalini (Li, Na,
K) e gli alogeni (F, Cl, Br, I) sono tutti
esempi in cui le proprietà chimiche all’aumentare di Z si ripetono.
Queste ricorrenze sono state classificate
indipendentemente dal russo D. Mendeleev nel 1969 e dal tedesco L. Meyer
nel 1970, in un archetipo della moderna
tavola periodica degli elementi e sono
essenzialmente conseguenza del principio
di esclusione di Pauli.
Esso nasce nel contesto della meccanica
quantistica, quindi per spiegare ciò che
accade a livello microscopico, tuttavia
gioca un ruolo essenziale in un grande
numero di fenomeni fisici ove sia coinvolta la stabilità su larga scala della materia.
L’astronomia fornisce la più spettacolare
dimostrazione di quanto detto nel caso di
nane bianche e delle stelle di neutroni.
Una nana bianca è ciò che gli astronomi
chiamano il nucleo residuo di una stella
Sopra: orbitale di tipo s (l=0, simmetria
sferica) e orbitale px (l=1, forma bilobata,
orientato lungo x) secondo l’interpretazione
probabilistica data da M. Born.
A sinistra: le dimensioni comparate della Terra
e di una nana bianca.
32
www.cortinastelle.it
che non può essere ulteriormente sottoposto a fusione nucleare, ma che tuttavia,
pur essendo estremamente denso, non
collassa sotto la sua stessa gravità. Ciò
che permette ad una nana bianca di esistere è proprio il principio di esclusione
di Pauli che, come visto, non permette
che gli elettroni vengano ulteriormente
avvicinati una volta raggiunta una certa
densità critica (un milione di grammi per
centimetro cubo).
Entro il nucleo di una stella che diventerà
una nana bianca la materia è costituita
da nuclei di carbonio ed elettroni. I primi
sono il prodotto della fusione nucleare
e non vengono coinvolti dal principio di
esclusione, cosicché se il nucleo fosse costituito soltanto da essi, si contrarrebbe
all’infinito.
I secondi non possono essere costretti
ad occupare un volume minore, e questo
fa in modo che ciò non possa succedere
nemmeno per i nuclei di carbonio. Infatti
ciascun elettrone possiede una carica
negativa e ciascun nucleo è caricato positivamente, quindi dato che cariche di segno opposto si attraggono, ogni elettrone
viene attirato da ogni nucleo di carbonio
e viceversa. Una volta che la densità del
nucleo aumenta al punto tale che gli elettroni non possono essere ulteriormente
avvicinati, l’attrazione degli elettroni nei
confronti dei nuclei tiene questi ultimi
in posizioni fisse e quindi non permette
alla gravità della stella di comprimerli in
volumi di spazio inferiori (pressione di
degenerazione).
A questo punto entro il nucleo non può
più avere luogo la fusione nucleare proprio perché il principio di esclusione la
vieta: a causa della scarsa possibilità di
movimento evidenziata sopra, i nuclei
non possono collidere uno contro l’altro
ad alte velocità come è richiesto che
avvenga affinché si realizzi la fusione.
Senza quest’ultima il nucleo denso non
può produrre nuova energia e quando
gli strati più esterni della stella saranno
evaporati resterà visibile il nucleo (nana
bianca), ciò che resta di una stella un
tempo attiva. La nana bianca diventerà
lentamente meno luminosa, ma non si
contrarrà ulteriormente.
Le stelle di neutroni, derivanti dall’esplosione di supernovae, mostrano forze
gravitazionali ancora più grandi e gli
elettroni sono costretti a fondersi con i
Una stella di neutroni, o una di quark, pur avendo massa superiore
al Sole, possono essere contenute all’interno del Grand Canyon.
protoni a formare neutroni e neutrini,
che producono una pressione di degenerazione ancora maggiore. I neutrini che
sono privi di massa si allontanano alla
velocità della luce lasciandosi alle spalle
un nucleo costituito interamente da
neutroni. Le stelle di neutroni hanno una
massa simile a quella del Sole. Ma il loro
raggio è dell’ordine di 10 km, cioè 70.000
volte più piccolo del Sole. La loro massa
è perciò impacchettata in un volume
70.0003 (circa 1014) volte più piccolo, e la
densità media è quindi 1014 volte più alta.
Questi valori di densità sono i più alti conosciuti, e sono impossibili da riprodurre
in laboratorio: per dare un’idea delle condizioni estreme di una stella di neutroni,
per riprodurre la densità osservata occorrerebbe comprimere una portaerei nello
spazio occupato da un granello di sabbia.
Si tratta di una densità simile a quella dei
nuclei atomici, ma estesa per decine di
chilometri. In effetti, le stelle di neutroni
possono essere considerate nuclei atomici
giganti, tenuti insieme dalla forza gravitazionale.
Per comprendere il principio di Pauli è necessario parlare di numeri quantici. Essi derivano
dal fatto che le quantità fisiche a livello microscopico sono “quantizzate”, possono cioè
assumere solo valori discreti.
Il numero quantico principale si indica con “n” e rappresenta sostanzialmente il livello di
energia dell'elettrone. Da questo numero dipende la dimensione dell'orbitale (che cresce
all'aumentare di “n”). Gli orbitali aventi lo stesso valore di numero quantico “n” si dice che
appartengono allo stesso guscio. I gusci si contrassegnano con le lettere K, L, M, N,... a
seconda che n sia uguale a 1, 2, 3, 4,...
Il numero quantico secondario (o angolare) si indica con la lettera “l” e differenzia i vari
tipi di orbitale che possono esistere in un determinato livello energetico. Può assumere
tutti i valori che vanno da 0 a n-1 a ognuno dei quali corrisponde quindi un sottolivello di
energia. I simboli usati per i primi quattro sottolivelli sono: s, p, d ed f, ordinati secondo
l'energia crescente all'interno del livello. A ogni sottolivello corrisponde un tipo di orbitale
avente una ben determinata forma geometrica, che è sferica per l'orbitale s, a simmetria
bilobata per gli orbitali p e a simmetria più complessa per gli orbitali d ed f.
Il numero quantico m indica il numero di orbitali che possono coesistere in un determinato
sottolivello. Tali orbitali hanno tutti la stessa forma e la stessa energia ma sono
diversamente orientati nello spazio. Il numero di valori che m può avere dipende da l,
infatti può assumere i valori -l, 0 e +l (2l+1 valori).
Il sottolivello s (l=0) comprende un solo orbitale e non ha alcuna direzione preferenziale
(simmetria sferica, m=0).
Per il sottolivello p (l=1) sono permessi tre valori di m (-1, 0, +1) che definiscono i tre
orbitali p orientati lungo i tre assi x, y, z tra loro perpendicolari. Analogamente per il
sottolivello d (l=2) ed f (l=3) si hanno 5 e 7 valori di m che individuano, rispettivamente, 5
e 7 orbitali diversamente orientati nello spazio.
Oltre a questi tre numeri quantici ne esiste un quarto che riguarda la natura intrinseca
dell'elettrone. Esso viene chiamato numero quantico di spin ms e può assumere solo i
valori +1/2 e -1/2.
il principio di pauli in astronomia
33