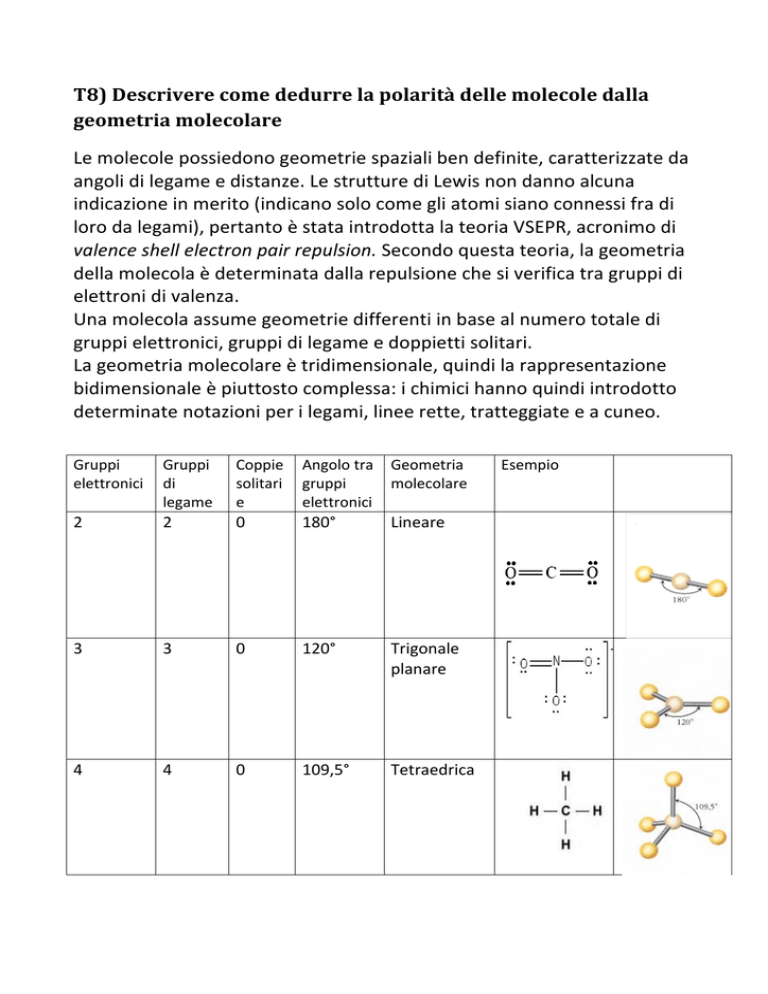
T8) Descrivere come dedurre la polarità delle molecole dalla geometria molecolare Le molecole possiedono geometrie spaziali ben definite, caratterizzate da angoli di legame e distanze. Le strutture di Lewis non danno alcuna indicazione in merito (indicano solo come gli atomi siano connessi fra di loro da legami), pertanto è stata introdotta la teoria VSEPR, acronimo di valence shell electron pair repulsion. Secondo questa teoria, la geometria della molecola è determinata dalla repulsione che si verifica tra gruppi di elettroni di valenza. Una molecola assume geometrie differenti in base al numero totale di gruppi elettronici, gruppi di legame e doppietti solitari. La geometria molecolare è tridimensionale, quindi la rappresentazione bidimensionale è piuttosto complessa: i chimici hanno quindi introdotto determinate notazioni per i legami, linee rette, tratteggiate e a cuneo. Gruppi Gruppi elettronici di legame Coppie Angolo tra Geometria solitari gruppi molecolare e elettronici Esempio 2 0 2 180° Lineare 3 3 0 120° Trigonale planare 4 4 0 109,5° Tetraedrica 4 3 1 109,5° Trigonale piramidale 4 2 2 109,5° angolare Alcuni legami consistono di una coppia elettronica, ovvero due elettroni condivisi da due diversi atomi. Spesso accade che gli atomi non condividano equamente la coppia di elettroni: questo fenomeno è detto elettronegatività, ovvero la capacità di un elemento di attrarre elettroni all’interno di un legame covalente. L’elettronegatività di un elemento può essere facilmente dedotta dalla tavola periodica: infatti l’elettronegatività cresce lungo il periodo e diminuisce lungo i gruppi. L’atomo con maggiore elettronegatività assume parzialmente una carica negativa (δ-­‐) e l’atomo con minore carica elettronegativa assume carica positiva (δ+). Il risultato di questo fenomeno è detto momento di dipolo: i legami covalenti che presentano un momento di dipolo sono detti polari. Se tra i due atomi coinvolti nel legame esiste una notevole differenza di elettronegatività superiore a 1,9 (come accade tra un metallo e un non metallo) l’elettrone viene trasferito e si assiste alla formazione di un legame ionico; se al contrario 1: il cloroformio risulta polare per la diversa polarità dei legami C-­‐CH e C-­‐Cl. la differenza di elettronegatività è minima 2: nella struttura tertraedrica del tetracloruro di carbonio i dipoli si annullano. (come nel caso di due non metalli), allora il legame è detto covalente polare. In una molecola biatomica è relativamente semplice distinguere se essa è o meno polare poiché, se contiene un legame polare significa che l’ intera molecola è polare, ma in molecole contenenti più di due atomi è necessario determinare se la molecola contiene legami polari (se non sono presenti legami polari la molecola non è polare) e se essi si sommano per formare un dipolo netto. Nel caso in cui si verifichino entrambe le condizioni, è indispensabile determinare la geometria della molecola attraverso la teoria VSEPR: se la molecola è simmetrica e se le forze si annullano, la molecola risulta apolare poiché non si forma nessun momento di dipolo. Se invece la molecola è asimmetrica e le forze non si annullano, allora la molecola è polare. È fondamentale stabilire se una molecola è polare o meno poiché le molecole polari interagiscono fortemente con altre molecole polari a causa dell’attrazione della carica positiva di una con la carica negativa dell’atra. In un miscuglio di molecole polari e apolari, la reciproca attrazione tra molecole polari esclude quelle apolari, come accade nel caso di un miscuglio di acqua e olio.












