DERIVATI DEGLI ACIDI CARBOSSILICI
DERIVATI DEGLI ACIDI CARBOSSILICI
cloruro acilico
anidride
estere
O
R
Cl
ammide
O
R
NH2
nitrile
ALOGENURI ACILICI:
ACILICI: NOMENCLATURA
Si sostituisce il suffisso –oico del nome dell’acido corrispondente con –oile e la
parola acido con la parola alogenuro.
cloruro di etanoile
(cloruro di acetile)
4‐bromo‐benzoil cloruro
4
b
b
il l
(p‐bromo‐benzoil cloruro)
ESTERI:: NOMENCLATURA
ESTERI
Viene indicato il nome dell’acido in cui il suffisso –oico è sostituito dal suffisso –oato e p
poi il
nome del gruppo alchilico (arilico) legato all’ossigeno preceduto dalla preposizione di.
etanoato di metile
etanoato
di metile
(acetato di metile)
benzoato di isopropile
ESTERI CICLICI: LATTONI
ESTERI CICLICI: LATTONI
Il suffisso –oico nel nome dell’acido viene sostituito con il suffisso –olattone.
La posizione dell’ossigeno nell’anello è indicata con un numero o con una lettera greca (α,
β γ,
β,
γ δ).
4‐butanolattone
( b ti l tt
(γ‐butirrolattone)
)
5‐esanolattone
(δ
(δ‐caprolattone)
l tt
)
ANIDRIDI DEGLI ACIDI
ACIDI:: NOMENCLATURA
Si sostituisce la parola acido nel nome dell’acido corrispondente con la parola anidride.
anidride acetica
anidride
acetica
(simmetrica)
anidride benzoica
anidride
benzoica
(simmetrica)
anidride acetica benzoica
anidride
acetica benzoica
(mista)
AMMIDI:: NOMENCLATURA
AMMIDI
Il suffisso –oico
oico del corrispondente acido viene sostituito con il suffisso –ammide
ammide.
etanammide
acetammide
(ammide 1°)
N‐metilpropanammide
(ammide 2°)
(ammide 2°)
N,N‐dimetilmetanammide
N,N‐dimetilformammide
N,N
dimetilformammide
(ammide 3°)
AMMIDI CICLICHE: LATTAMI
AMMIDI CICLICHE: LATTAMI
AMMIDI CICLICHE: Il suffisso –oico nel nome dell’acido viene sostituito con il suffisso –olattame.
La posizione dell’azoto nell’anello è indicata con un numero oppure con una lettera greca
greca (α, β, γ, δ).
4‐butanolattame
(γ‐butirrolattame)
5‐esanolattame
(δ‐caprolattame)
NITRILI:: NOMENCLATURA
NITRILI
Seguono lo schema alcanonitrile. I nomi comuni si ottengono togliendo il suffisso –oico dal
nome dell’acido corrispondente ed aggiungendo il suffisso –onitrile.
etanonitrile
(acetonitrile)
benzonitrile
DERIVATI DEGLI ACIDI CARBOSSILICI
CARBOSSILICI:: REATTIVITÀ
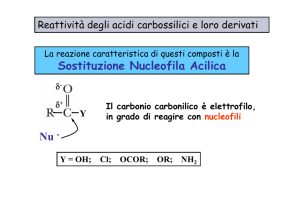
REAZIONE DI SOSTITUZIONE NUCLEOFILA ACILICA
REAZIONE DI SOSTITUZIONE NUCLEOFILA ACILICA
O
R
O
Y
+
Nu
YY = OR
= OR1, alogeno,
alogeno
OCOR1, NHR1
R
Nu
+
Y
DERIVATI DEGLI ACIDI CARBOSSILICI
CARBOSSILICI:: REATTIVITÀ
REAZIONE
REAZIONE DI SOSTITUZIONE NUCLEOFILA ACILICA
DI SOSTITUZIONE NUCLEOFILA ACILICA
addizione
eliminazione
Y = OR1, alogeno,
OCOR1, NHR1
Il nucleofilo può essere anche una molecola neutra (per es., H
l
l fl
ò
h
l l
(
2O, ROH, RNH2)
Confronto con la reazione di addizione ad aldeidi e chetoni
O
R1
R
Nu
DERIVATI DEGLI ACIDI CARBOSSILICI
CARBOSSILICI:: REATTIVITÀ
L
La reattività dei derivati degli acidi carbossilici dipende dall’elettrofilia
tti ità d i d i ti d li idi b ili i di
d d ll’ l tt fili
del carbonio carbonilico e dalle caratteristiche del gruppo uscente.
O
R
O
O
R
elettrofilia crescente
Mappe di potenziale elettrostatico dei derivati dell’acido acetico
DERIVATI DEGLI ACIDI CARBOSSILICI
CARBOSSILICI:: REATTIVITÀ
ELETTROFILIA DEL CARBONIO CARBONILICO
ELETTROFILIA DEL CARBONIO CARBONILICO
O
O
R
O
O
O
Cl
R
R
O
O
O
R
OR1
O
R
NH2
R
elettro
ofilia cresscente
R
DERIVATI DEGLI ACIDI CARBOSSILICI
CARBOSSILICI:: REATTIVITÀ
GRUPPO USCENTE
più debole è la base, migliore è il gruppo uscente
basicità crescente
O
NR2
OR
O
R
abilità del gruppo uscente abilità
del gruppo uscente
crescente
reattività con i nucleofili crescente
X
DERIVATI DEGLI ACIDI CARBOSSILICI
CARBOSSILICI:: REAZIONI
1. Reazione con acqua
2 R i
2. Reazione con alcoli
l li
3. Reazione con ammoniaca ed ammine
4. Reazione con composti organometallici
p
g
5. Reazione di riduzione
REAZIONE CON ACQUA
I cloruri acilici e (in parte) le anidridi non necessitano di catalisi: si idrolizzano rapidamente in acqua
p
q
Gli esteri sono idrolizzati in ambiente acido e basico.
Le ammidi ed i nitrili richiedono condizioni drastiche: catalisi acida/basica ad elevata temperatura.
REAZIONE CON ACQUA
ACQUA:: ALOGENURI ACILICI E ANIDRIDI
Meccanismo di reazione
H
H
O
O
CH3
H
H O
CH3
O
O
CH3
O O
O
H2O
CH3
H O
CH3
H3O
H3O
O
CH3
O
O
CH3
O O
O
H3O
CH3
OH
H2O
Il meccanismo di
reazione degli
alogenuri acilici con
acqua è analogo
REAZIONE CON ACQUA
ACQUA:: ESTERI
IDROLISI IN AMBIENTE ACIDO
IDROLISI IN AMBIENTE BASICO
REAZIONE CON ACQUA
ACQUA:: ESTERI
IDROLISI IN AMBIENTE ACIDO (esteri di alcoli 1° e 2°)
meccanismo di reazione (catalisi acida specifica
meccanismo di reazione (catalisi acida specifica)
OH
CH3
H
OH
CH3
H
OCH3
O
H
H
O
H
CH3
H
OH CH3
O
H
O
OCH3
O
H
REAZIONE CON ACQUA
ACQUA:: ESTERI
IDROLISI IN AMBIENTE ACIDO (esteri di alcoli 3°)
meccanismo di reazione H
H O
CH H
O
R
3
O
CH3
CH3
REAZIONE CON ACQUA
ACQUA:: ESTERI
IDROLISI IN AMBIENTE BASICO
meccanismo di reazione
pKa acido acetico = 4.74
pKa metanolo = 16
la reazione è irreversibile
L’elettrofilia del carbonio del gruppo carbossilato
è molto bassa
REAZIONE CON ACQUA
ACQUA:: AMMIDI
IDROLISI IN AMBIENTE ACIDO
O
O
NH2
+ H2O
HCl
Ph
2 fenilbutanammide
2‐fenilbutanammide
OH
+
NH4 Cl
Ph
acido 2 fenilbutanoico
acido 2‐fenilbutanoico
IDROLISI IN AMBIENTE BASICO
sodio 2‐fenilbutanoato
sodio 2
fenilbutanoato
REAZIONE CON ACQUA
ACQUA:: NITRILI
I nitrili addizionano acqua:
1. in ambiente acido
2. in ambiente basico
IDROLISI DEI NITRILI AD AMMIDI La reazione può procedere idrolizzando le ammidi ad acidi carbossilici
acidi carbossilici.
IDROLISI DEI NITRILI AD ACIDI CARBOSSILICI
REAZIONE CON ALCOLI
O
R
O
Y
R1OH
R
OR1
HY
I cloruri acilici e (in parte) le anidridi non necessitano di catalisi. Gli esteri richiedono la catalisi acida.
Le ammidi ed i nitrili non reagiscono, anche in presenza di catalisi.
REAZIONE CON ALCOLI
ALCOLI:: ALOGENURI ACILICI E ANIDRIDI
CH3
O
O
O
O
CH3
O
+
+ CH3OH
CH3
OCH3
CH3
OH
La reazione produce una mole di acido per ogni mole di estere formato.
Il meccanismo di reazione è analogo a quello della reazione dei cloruri acilici e delle anidridi con acqua.
Nel caso di alcoli acido labili si aggiunge una base, il cui ruolo è quello di neutralizzare l’acido formato (e di accelerare la reazione).
benzoile cloruro
l
3 metil 1
3‐metil‐1‐
‐butanolo
piridina
benzoato di
benzoato di 3‐metilbutile
piridinio
cloruro
REAZIONE CON ALCOLI
ALCOLI:: ESTERI
TRANSESTERIFICAZIONE IN AMBIENTE ACIDO
O
CH3
O
HCl(g)
OCH3
+ CH3CH2OH
CH3
OCH2CH3
meccanismo di reazione (
meccanismo di reazione (catalisi acida specifica
catalisi acida specifica))
R
HO O H
CH3
OCH3
ROH
R
HO O
ROH
CH3
R
O
H
O
ROH2
R
O
CH3
ROH
ROH
H
O
CH3
+
CH3OH
REAZIONE CON AMMONIACA E AMMINE
ammide primaria
ammide secondaria
I cloruri acilici e (in parte) le anidridi reagiscono in condizioni blande
I cloruri acilici e (in parte) le anidridi reagiscono in condizioni blande.
Gli esteri sono meno reattivi.
Le ammidi ed i nitrili non reagiscono. REAZIONE CON AMMONIACA E AMMINE:
AMMINE:
ALOGENURI ACILICI E ANIDRIDI
Queste reazioni producono una mole di acido per ogni mole di ammide formata: si usano (almeno) 2 equivalenti di ammoniaca (ammina)
meccanismo di reazione
Con le anidridi, il meccanismo di reazione è analogo
REAZIONE CON AMMONIACA E AMMINE:
AMMINE: ESTERI
R è un gruppo alchilico
R è un gruppo arilico
INTERCONVERSIONE DEI DERIVATI FUNZIONALI
e
n
e
r
g
i
a
Ciascun composto può essere trasformato in un altro qualsiasi a più bassa energia
Ciascun composto può essere trasformato in un altro qualsiasi a più bassa energia
REAZIONE CON COMPOSTI ORGANOMETALLICI
Reazione degli esteri con i reattivi di Grignard
meccanismo di reazione
H3O / H2O
OH
CH3
R
R
HOMgBr
REAZIONE CON COMPOSTI ORGANOMETALLICI
Perché la reazione degli organomagnesio con gli esteri non si arresta al livello del chetone?
O
CH3
O
O
OR
CH3
OR
CH3
OR
Il carbonio del carbonile chetonico è più elettrofilo di quello del carbonile estereo
REAZIONE DI RIDUZIONE
Reazione degli esteri con LiAlH4
Reazione degli esteri con LiAlH
Reazione delle ammidi con LiAlH4
Reazione dei nitrili con LiAlH4