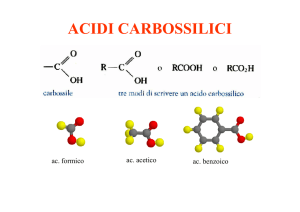
Reattività degli acidi carbossilici e loro derivati
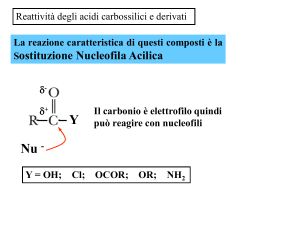
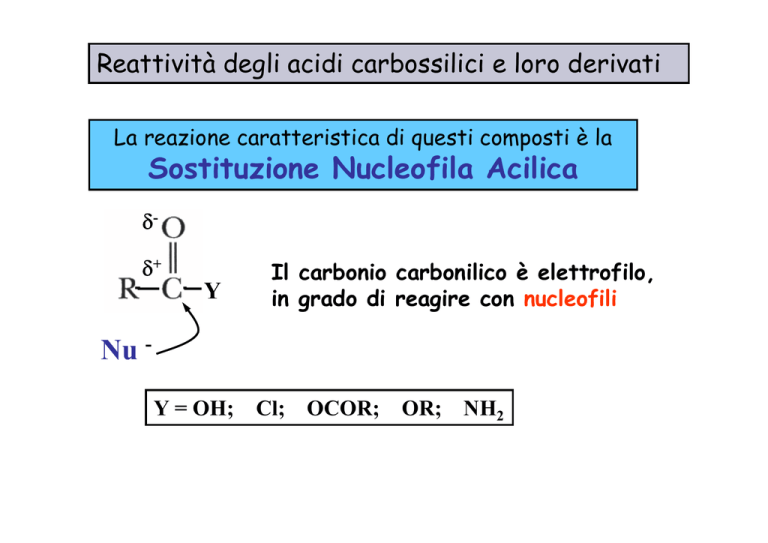
La reazione caratteristica di questi composti è la
Sostituzione Nucleofila Acilica
δδ+
Y
Il carbonio carbonilico è elettrofilo,
in grado di reagire con nucleofili
Nu Y = OH; Cl; OCOR; OR; NH2
Meccanismo generale della Sostituzione Nucleofila Acilica
Stadio 1:
il nucleofilo si addiziona al carbonile
Stadio 2:
l’intermedio tetraedrico rigenera il carbonile
ed espelle il gruppo uscente (eliminazione)
Complessivamente, addizione + eliminazione =
reazione di sostituzione
La forza del nucleofilo attaccante influenza la velocità del
primo stadio (stadio lento)
La “bontà” del gruppo uscente (facilità con cui può essere
eliminato) determina la velocità del secondo stadio
Gruppo
uscente
Capacità come gruppo uscente
Basicità crescente
Scala di reattività dei derivati degli acidi carbossilici:
Reattività crescente
Perché aldeidi e chetoni danno addizione nucleofila al
C=O mentre i derivati degli acidi carbossilici danno
sostituzione nucleofila al C=O ?
Addizione
Sostituzione
La differente reattività è dovuta al fatto che aldeidi e
chetoni non posseggono un buon gruppo uscente. Non
possono eliminare un carbanione (R-) o uno ione idruro (H-),
che sono basi fortissime e quindi pessimi gruppi uscenti.
Una reazione classica degli acidi carbossilici:
l’esterificazione di Fischer
Etanoato di etile
(acetato di etile)
È una reazione di equilibrio
catalizzata da acidi ed è una
Sostituzione Nucleofila Acilica
Meccanismo dell’esterificazione di Fischer
Esteri come aromatizzanti
Reazione con l’acqua:
idrolisi dei derivati degli acidi carbossilici
Cloruri degli acidi e anidridi reagiscono con l’acqua
spontaneamente, cioè anche in assenza di catalizzatori
Cloruro di acetile
Anidride acetica
Come prodotto finale, si
ottiene l’acido carbossilico
Gli esteri reagiscono con l’acqua:
1) in presenza di catalizzatori acidi; 2) in ambiente basico.
Idrolisi degli esteri in ambiente acido
L’idrolisi di un estere in ambiente basico è
detta saponificazione
Sale dell’acido carbossilico
Meccanismo di idrolisi basica di un estere
Idrolisi di un’ ammide in ambiente acido
Le ammidi si idrolizzano più difficilmente degli esteri
(sia in ambiente basico che acido). In genere si
preferisce utilizzare una idrolisi in ambiente acido,
che richiede comunque condizioni di reazione molto
drastiche (alte T, tempi di reazione molto prolungati).
2-fenilbutanammide
Reazioni con gli alcoli: Sintesi degli esteri
A partire dai cloruri degli acidi
A partire dalle anidridi
L’Aspirina si ottiene da una reazione di esterificazione
(acetilazione) di un composto di origine naturale
Acido salicilico
Anidride
acetica
Acido acetilsalicilico
(Aspirina)
Reazione dei derivati degli acidi carbossilici con
l’ammoniaca o un’ ammina: sintesi di ammidi
A partire da cloruri degli acidi:
1
2
3
meccanismo
Reazione dei derivati degli acidi carbossilici
con l’ammoniaca o un’ ammina: sintesi di Ammidi
A partire da una Anidride di un acido carbossilico:
A partire da un Estere:
Reattività decrescente
Reattività generale dei derivati degli acidi carbossilici e
loro possibili interconversioni
Gli esteri reagiscono con i reattivi di
Grignard
Sintesi
di
alcoli
Sale
dell’alcol
(ione
alcossido)
Sale
dell’alcol
(ione
alcossido)
Nell’addizione ad 1 eq. di estere sono consumati 2
eq. di reattivo di Grignard!
Meccanismo
1)
2)
Riduzione degli esteri
Alcol primario
LiAlH4
Riduzione delle ammidi
Ammine
Penicilline e Cefalosporine
Antibiotici con attività battericida
Le penicilline furono scoperte nel 1928 dal batteriologo
scozzese A. Fleming. Furono introdotte nella pratica medica
nel 1943.
Penicillina G
(un antibiotico β-lattamico)
anello β-lattamico
Cefalosporina
(un antibiotico β-lattamico)