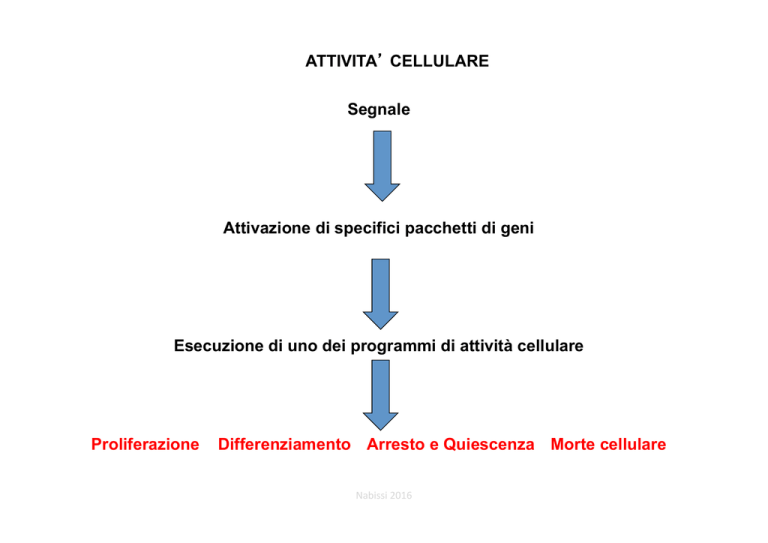
ATTIVITA’ CELLULARE
Segnale
Attivazione di specifici pacchetti di geni
Esecuzione di uno dei programmi di attività cellulare
Proliferazione
Differenziamento Arresto e Quiescenza Morte cellulare
Nabissi2016
Nabissi2016
MORTE CELLULARE
Nabissi2016
MECCANISMIDIMORTECELLULARE
•
•
NECROSI
– Eventoaccidentale
– Passivamentesubitodallecellule
– Interessagruppidicellule
– Dovutoatrauma,veleno,anossia,ecc
– Lalisidellacellulacausafenomenidiinfiammazioneediautoimmunità
APOPTOSI
– Eventoprogrammato
– A8vamenterealizzatodallecellule
– Interessacellulesingole
– Realizzatodinormaincondizionifisiologiche
– Laframmentazionedellacellulaelemodificazionidisuperficiefavorisconolafagocitosi
AUTOFAGIA
-PermeFeallecelluleincondizionedimalnutrimentooprivedifaForidicrescitadi
sopravvivere.SelamancanzadisImolipersistelecellulesi“autodigeriscono”e
muoiono.
Nabissi2016
LA NECROSI
La necrosi, è l’ evidenza strutturale della morte di gruppi di cellule di un tessuto o
di un organo. Nella zona di avvenuta necrosi le delimitazioni extracellulari
scompaiono ed il tessuto si trasforma in una massa amorfa, con conseguente
rilascio di sostante intracellulari negli spazi extracellulari. Questo fenomeno
comporta, spesso, attivazione di un processo infiammatorio in quanto le sostanze
rilasciate dalla cellula necrotica possono richiamare (chemiotassi) i leucociti o
attivare una risposta antigenica
Nabissi2016
Necrosi
LemodificazioniultrastruFuralidellacellula,incuisièaKvatoilprocessodi
mortepernecrosi,possonoesseresuddivisecomesegue:
-Cariolisi(degradazionedelDNAcausatadall’aKvitàdelleDNasi)
-Picnosi:(riduzionedelnucleo)
-Cariolessi:(frammentazionedelnucleopicnoIco,finoallasuascomparsa)
- Alterazioni della membrana plasmaIca, deplezione di ATP e della struFura dei
mitocondri, dilatazione del reIcolo endoplasmaIco (per aumento del Ca2+
intracellulare,perditadell’osmolaritàcellulare
Nabissi2016
Nabissi2016
CARATTERISTICHE
NECROSI
VOLUME CELLULARE
AUMENTO
NUCLEO
PICNOSI-CARIOLESSI-CARIOLISI
MEMBRANA CITOPLASMATICA
DANNEGGIATA
CONTENUTO CELLULARE
DIGESTIONE ENZIMATICA
INFIAMMAZIONE DELLE AREE
ADIACENTI
FREQUENTE
RUOLO FISIOLOGICO O
PATOLOGICO
SEMPRE PATOLOGICO
Nabissi2016
Inoltre la cellula necrotica puo’ avere un aspetto piu’ trasparente
rispetto alla cellula normale (perdita del contenuto di glicogeno).
Un altro fenomeno presente nel processo necrotico consiste nella
calcificazione delle cellule, con riempimento della cellula morta con
fosfolipidi degradati (dette figure mieliniche), che vengono poi
degradate dai macrofagi, con formazione di saponi di calcio ed di un
sito infiammatorio.
Nabissi2016
STEATONECROSI CON SAPONIFICAZIONE.
Saponi di calcio nelle zone di distruzione
lipidica
Figure mieliniche
Nabissi2016
La necrosi del tessuto puo’ essere classificata come:
Necrosi coagulativa: denaturazione completa della cellula, tessuto duro e biancastro
in cui le proteine possono andare incontro ad un processo di denaturazione. La
necrosi coagulativa implica la conservazione della struttura della cellula per alcuni
giorni, come nel caso dell’infarto del miocardio dove il danno o l’aumento di acidosi
cellulare denatura le proteine ma anche gli enzimi degradativi .
Un tipo particolare di necrosi coagulativa è la necrosi caseosa, che si incontra
spesso nel granuloma tubercolare. Deve il suo nome all’aspetto macroscopico del
tessuto (bianco e simile al formaggio). Si distingue dalla normale necrosi coagulativa
perché in essa la normale architettura del tessuto appare completamente scomparsa.
Nabissi2016
POLMONE TUBERCOLARE- NECROSI CASEOSA
Nabissi2016
• LanecrosicoagulaIvaimplicalaconservazionedellastruFura
dellacellulaperalcunigiorni,comenelcasodell’infartodel
miocardiodoveildannool’aumentodiacidosicellulare
denaturaleproteinemaancheglienzimidegradaIvi
A) Miocardio normale, B) cellule del miocardio prive di nucleo
Nabissi2016
Necrosi colliquativa: predomina la digestione enzimatica, il tessuto diventa
molle e liquefatto principalmente come conseguenza dell’azione degli enzimi litici
rilasciati dai leucociti, richiamati nel sito necrotico (chemiotassi).
La necrosi
colliquativa è caratteristica delle infezioni batteriche, dato che questi organismi
stimolano l’accumulo di cellule infiammatorie. La completa digestione delle
cellule morte, con conseguente trasformazione del tessuto in una massa fluida e
viscosa, comprende spesso la formazione di pus.
Nabissi2016
NecrosicolliquaBva
CaraFerisIcadelleinfezionibaFeriche,datochequesIorganismisImolano
l’accumulodicelluleinfiammatorie.
CompletadigesIonedellecellulemorte,conconseguentetrasformazionedel
tessutoinunamassafluidaeviscosa.Spessoconprendelaformazionedipus.
Nabissi2016
Un altro tipo particolare di necrosi è la gangrena che si verifica in un arto
con interruzione completa dell’irrorazione sanguigna e conseguente necrosi
coagulativa. Se si sovrappone un’infezione batterica con conseguente
colliquazione si definisce gangrena umida.
Necrosi grassa (steatonecrosi): indica la presenza di zone di distruzione
lipidica causate dal rilascio di lipasi
Nabissi2016
Mediatoridelprocessodinecrosi
SpeciereaKvedell’ossigeno,ionicalcio,PARP(poly–ADP–ribosepolymerase)
PARP è una DNA-repair enzyme che puo’ diminuire fortemente le riserve di ATP
quandocatalizzalariparazionedelDNA,cheavvieneduranteundanno.
Nabissi2016
Proteasi calcio-aKvate non lisosomiali (Calpaine) e catepsine mediano il processo di
necrosi.
CalpainesiaKvanoquandolaconcentrazionedicalcioèelevata.
Le Catepsine vengono liberate nel citoplasma dopo che le calpaine aKvate compromento
l’integritàdellemembranelisosomiali.
Ilisosomicontengonopiu’di80IpidiversidienzimiidroliIci,inclusolecatepsine.RilasciaI
nel citoplasma quesI enzimi degradano le struFure cellulari, interferendo con il normale
metabolismo,elamorteèinevitabile.
Nabissi2016
Nabissi2016
DETERMINAZIONEDELPROCESSONECROTICO
MarcaturaconPI(iodurodipropidio)
AnalisieleFroforeIcadelDNA
AKvazioneenzimidegradaIvi
medianteWesternBlotanalisi
Nabissi2016
LANECROSIINDUCE
INFIAMMAZIONE
LANECROSIPUO’
INDURREFENOMENIDI
AUTOIMMUNITA’
DAMP’S:damage-associated
molecularpaFerns
APOPTOSI:“suicidiocellulare”
Èunamodalitàdimortecellulare“aKva”,Ipicadellecelluledi
organismipluricellularievieneanchedescriFacomeunaforma
di“suicidioaltruista”,inquantospessolacellula“sisacrifica”
perilbenedell’interoorganismo.Lemodalitàdellamorteper
apoptosisonofinalizzateaevitarel’instaurarsidifenomenidi
INFIAMMAZIONEediAUTOIMMUNITÀ,edilfaFochenon
dialuogoafenomenidiinfiammazionefasìchelamorte
cellularenonsiaavverItadall’organismo(morteindolore)
Nabissi2016
PERCHÉ SI PARLA DI PROGRAMMA APOPTOTICO?
Perché l’apoptosi è un processo cellulare innescato da induttori specifici, in
quanto richiede la trascrizione di specifici geni. L’apoptosi fisiologica avviene
naturalmente nell’organismo, per favorire l’eliminazione di cellule che hanno
terminato la loro funzione, in cellule danneggiate o in condizioni d’adattamento
cellulare
Nabissi2016
SVILUPPO EMBRIONALE/FETALE E METAMORFOSI
NORMALE TURN-OVER TISSUTALE: epitelio intestinale, i neutrofili dopo il
termine dell’infiammazione, linfociti al termine di una risposta immunitaria.
ONTOGENESI E OMEOSTASI DEL SISTEMA IMMUNITARIO:
L’eliminazione di linfociti auto-reattivi potenzialmente pericolosi, prima e
dopo la loro formazione e maturazione.
ATROFIA ORMONE-DIPENDENTE: L’involuzione ormone-dipendente
nell’adulto, come la distruzione delle cellule dell’endometrio durante il ciclo
mestruale, atresia dei follicoli ovarici nella menopausa, regressione della
mammella dopo svezzamento, atrofia prostatica dopo castrazione.
DEPRIVAZIONE DI FATTORI DI CRESCITA o INDUCENTI: L’eliminazione
cellulare in popolazioni cellulari proliferanti.
Nabissi2016
APOPTOSI
TOSSINE,FARMACI
RADIAZIONI
INFEZIONIVIRALI
CITOTOSSICITÀCELLULO-MEDIATA:lamortecellulareindoFadailinfociI
citotossici,unmeccanismididifesacontrolinfociIinfeFaIdavirusocontrocellule
tumorali.
Perapoptosipatologicas’intendelamortecellulareindoFadaunaseriedisImoli
dannosi,adesempioildannocellulareinparIcolarimalaKevirali,comel’epaIte
viraleincuil’eliminazionedellecelluleèlargamentedipendentedall’apoptosi,
l’atrofiapatologicanegliorganiparenchimalidopoostruzionedeidoK(pancreas,
reni)elamortecellularenelleneoplasie.
Nabissi2016
Quindi l’apoptosi si puo’definire un programma intracellulare
strettamente regolato, in cui le cellule destinate a morire
attivano enzimi che degradano il DNA, le proteine nucleari e
citoplasmatiche. La membrana citoplasmatica rimane intatta
ma la struttura della cellula si altera a tal punto da essere
bersaglio di cellule fagocitarie .
Nabissi2016
Nabissi2016
Immaginidicelluleinapoptosi
Nabissi2016
CARATTERISTICHE
NECROSI
APOPTOSI
VOLUME CELLULARE
AUMENTO
RIDOTTO
NUCLEO
PICNOSI-CARIOLESSICARIOLISI
FRAMMENTAZIONE
MEMBRANA
CITOPLASMATICA
DANNEGGIATA
INTATTA
CONTENUTO
CELLULARE
DIGESTIONE
ENZIMATICA
INTATTO, PUO’ ESSERE
SECRETO IN CORPI
APOPTOTICI
INFIAMMAZIONE
DELLE AREE
ADIACENTI
FREQUENTE
NO
RUOLO FISIOLOGICO O
PATOLOGICO
SEMPRE PATOLOGICO
SPESSO FISIOLOGICO,
MEZZO PER
ELIMINARE LE
CELLULE
Nabissi2016
CARATTERISTICHEBIOCHIMICHEDELL’APOPTOSI
LecelluleapoptoIchemostranodellecaraFerisIchebiochimichechesonoalla
basedellemodificazionistruFutalidescriFe.
CLIVAGGIODELLEPROTEINE
LadegradazionedelleproteinecoinvolgeleCASPASI,proteasicisteina-dipendenI,
chesonopresenI,comeproenzimi,nellacellulaincondizionefisiologicaedevono
essereaKvaIperindurreapoptosi.Lecaspasioltrechedistruggerealtreproteine
aKvanoDnasichedegradanoilDNA.
AUMENTODELLACONCENTRAZIONEDICa2+INTRACELLLULARE
LemodificazionibiochimichedellamembranaplasmaIcainduconovariazioni
osmoIcheeddellaconcentrazioneeleFroliIcanellacellulaapoptoIca.Tali
variazioniinduconoentratadiCa2+dall’ambienteextracellulareerilasciodiCa2+
daideposiIintracellulari(reIcoloendoplasmaIcoliscio,mitocondri).L’aumento
diCa2+èallabasedell’aKvazionedidiversienzimiconaKvitàdegradaIviverso
proteineeDNA.
Nabissi2016
MECCANISMIdia8vazionedell’APOPTOSI
L’APOPTOSIE’INDOTTADASTIMOLIESTERNIE/OINTERNI,INGRADODI
ATTIVAREDUEVIE(PATHWAYS)INPARTEDISTINTECHEVENGONOIDENTIFICATI
COME:
PATHWAYINTRINSECO,controllatodallapermeabilizzazionedellamembrana
mitocondriale
PATHWAYESTRINSECO,nelqualereceForidimortesImolanolacascata
dievenIapoptoIci.
ImediatoridientrambiipathwayssonoLECASPASI,infaKilprocesso
apoptoIcoconsisteinunafaseiniziatrice(durantelaqualevengonoaKvate
lecaspasiiniziatrici)einunafaseeffeFriceincuiilsecondogruppodicaspasi
(effeFrici)agisconoperindurrelamortecellulare.
Nabissi2016
CASPASI
• C=cisteinanelcentroreaKvo;ASP=riconosconounresiduodiacidoasparIco
nell’ambitodiunasequenzadi4aminoacidi;ASI=sonoenzimiproteoliIci
• LecaspasisonopresenInelcitoplasmainformadizimogenievengonoaKvate
successivamenteall’aKvazionedeipathwaysapoptoIci.
• Lecaspasi“iniziatrici”(2,8,9,10)sonoaKvatedagli“adaFatori”;alorovolta
aKvanolecaspasi“effeFrici”(3,6,7).(Lacaspasi1,4,5sonocoinvoltenella
maturazionedicitochine).
• L’aKvazioneconsisteneltaglioproteoliIco,conformazionedidueframmenI;i2
frammenIbreviei2frammenIlunghididuecaspasiugualiformanountetramero
(formaaKva).
Nabissi2016
Nabissi2016
ROTTURADELDNA
IlDNAvienetagliatoinmulIplidi180-200bpdaendonucleasiMg2+eCa2+dipendenI
RICOGNIZIONEFAGOCITARIA
LecelluleapoptoIcheesprimonofosfaAdilserinasullaparteesternadellamembrana
(evidenziabilecolorandolecelluleconannexinaV).
Questemodificazionialivellodimembranapossonoesserericonosciutedaimacrofagiche
fagocitanocosìlecelluleapoptoIche.
A-DNAcelluleintegre
B-DNAdicelluleinapoptosi
C-DNAdicelluleinnecrosi
Nabissi2016
Apoptosis and Necrosis
analysis
Annexin + PI Facs Analysis
Nabissi2016
APOPTOSI ESTRINSECA
Nabissi2016
ViaApoptoIcaEstrinseca
LaviaestrinsecaopathwaydeireceForidimorteèaKvatadallafamigliadei
receSoridelTNF(tumornecrosisfactor),laqualeècompostadareceForiche
inoltrehannounruolofondamentalenelmantenerel’omeostasicellulareenel
riconoscimentoimmunitario.L’aKvazionediquestaviasihaquandounligandodi
mortesilegaaldominioextracellularedelsuoreceForeconconseguente
aKvazionedellecaspasiiniziatrici.
LafamigliaditalireceForiècompostadadiversimembri,iqualisono
differentementeespressinellevariepopolazionicellulari.QuesIreceForisono:
-TNFR1(receForedelTNF)
-CD95(denominatoancheApo1oFas)
-TRAIL-R1,-TRAIL-R2,NGFR
Nabissi2016
Nabissi2016
TNF;tumornecrosisfactoroFasL;ligandodelreceFore
Fas)siassociaallaporzioneextracellularedelreceFore,il
IlreceForetrimerizzaelaPorzioneintracellulare,
caraFerizzatadaundominioDD(DeathDomain),dirige
laformazionediuncomplessoProteicodenominatoDISC
(death-inducingsignalingcomplex)medianteil
reclutamentodiunaspecificaproteinaadaFatriciFADD
(Fas-associateddeathdomain,perilFas)oTRADD(TNFR-
associateddeathdomain)perilTNFR.Questaproteina
trasportaundominioDED(deatheffectordomain)che
permeFedireclutarelepro-caspasi8el’aKvano
(induzioneperprossimità).Lacaspasi-8aKvataagisce
aKvandolapro-caspasi3cheagiscesuisubstraIsensibili.
Nabissi2016
InalcuniIpicellularilecaspasi8nonsonoparIcolarmenteefficacinelclivaggiodellacaspasi3e
quindiagisconosullaproteinaBIDchetroncatadallacaspasi8,informacorta(t-BID)traslocanella
membranamitocondrialedovesilegaedaKvaBAXeBAD.QuestaaKvazionepermeFela
traslocazionediBAXnellostratoesternodellamembranamitocondriale,causando
l’oligomerizzazionediBAXeBADconconseguenterilasciodicitocromocedinibizionedelleIAP
(inhibitorofapoptosispathways)stabilendounlegamefraviaestrinsecaeviaintrinseca.
Nabissi2016
INIBITORIDELL’APOPTOSI(cFLIP)
Un’altraproteinacheregola
negaIvamentel’apoptosi
interferendoconl’aKvazionedelle
caspasièlaproteinaFLICE(cFLIPo
usurpina),checonIeneundominio
DEDmancantedel
sitocataliIcoaKvoedeiresidui
aminoacidicicheformanoilpaccheFo
diproteine
necessarie(DISC)peraKvarelaprocaspasi8.
Nabissi2016
L’INIBIZIONE DEL SEGNALE
APOPTOTICO PUO’ INDURRE
PROLIFERAZIONE
CELLULARE
Nabissi2016
APOPTOSI
INDOTTA DAI
LINFOCITI
CITOTOSSICI
Nabissi2016
SUBSTRATIDELLECASPASIEFFETTRICI
Nabissi2016
Substrati sensibili
CAD (deossiribonucleasi caspasi-sensibile): presente nel citosol in forma
inattiva e mediante distacco dell’inibitore causato dalla caspasi 3, la CAD
migra nel nucleo degradando i nucleosomi, frammentando il DNA in
frammenti di circa 180 bp.
Nabissi2016
PARP-1 (poli-ADP-ribosio polimerasi) che inaKvata dalla caspasi 3 , non puo’ piu’
svolgerelafunzionedienzimaresponsabiledellariparazionedelDNAed’inibitoredelle
endonucleasi.
Nabissi2016
Casp-3edegradazionedelleproteinedelcitoscheletro
Nabissi2016
VIA INTRINSECA
La via intrinseca è attivata da stress cellulari (deprivazione di fattori di crescita,
ipossia, danno al DNA) o agenti antitumorali. Nelle cellule normali, il danno al DNA
puo’ indurre due possibili reazioni; la riparazione e/o la tolleranza del danno,
oppure la stimolazione della cascata di segnali che inducono la morte della cellula
danneggiata. Nella trasformazione neoplastica queste reazioni sono
normalmente alterate.
Le principali lesioni letali al DNA sono le rotture del doppio filamento (double strand
breaks; DSB), le quali sono riconosciute da proteine (chinasi) con capacità di
riparazione. Una di queste proteine è ATM (ataxia telangiectasia mutated) attivata
dopo lesione del DNA indotta da radiazioni ionizzanti. ATM induce la fosforilazione
di diversi substrati coinvolti con il blocco del ciclo cellulare e nell’induzione
dell’apoptosi (p53, CHK1, CHK2, p21). In base al danno o alla capacità di
riparazione p53 puo’ indurre la trascrizione di geni pro-apoptotici (Bax, PUMA)
Nabissi2016
Nabissi2016
Laviamitocondriale
L’aKvazionedellaviamitocondrialesiaKvamedianteuna
permeabilizzazionedellamembranamitocondrialeinternacon
conseguentedissipazionedelgradientediprotonicheè
responsabiledelpotenzialetransmembranamitocondriale.La
permeabilizzazionecoinvolgeanchelamembranamitocondriale
esternaconconseguenteperditadiproteinesolubili,normalmente
confinateneglispaziointermembranalideimitocondri.
QUALEMECCANISMOINDUCELAPERMEABILIZZAZIONE?
Nabissi2016
Laformazionediporiditransizionedimembranaalivellomitocondrialecoinvolge
proteinepro-apoptoIchedellafamigliaBcl-2(es.Bax,tBid)
Lapermeabilizzazionedellamembranainternaavvienecomeconseguenzadella
formazionediporinonspecifici(indoKdasImoliapoptoIci).
Canalianionicivoltaggio-dipendenI(VCAD),chesonoleproteinemaggiormente
presenInellamembranamitocondrialeesterna.IncondizionenormalequesI
canalisonopermeabiliaproteineconunpesomolecolarefinoa5kD.
La formazione dei pori di transizione di membrana nasce dalla fusione dei VCAD con i
poriaspecifici(modello2),soFoilcontrollodelleproteinedellafamigliaBcl-2.
QUALUNQUE SIA IL MODELLO, LA PERMEABILIZZAZIONE DELLE
MEMBRANE MITOCONDRIALI INDUCONO LA FUORIUSCITA DEL
CITOCROMO C NEL CITOPLASMA.
Nabissi2016
intermembranespace(IMS)
proteinsthatdirectlybind
XIAPandantagonizeitsability
toinhibitcaspases
Nabissi2016
Viaintrinseca
LosImolocheinducelaviaintrinsecainducelapermeabilizzazione
dellamembranamitocondrialeesternaerilasciodelcitocromoc
chesilegaalfaForeApaf-1(apoptoIcprotese-acIvaIngfactor-1)
inducendooligomerizzazioneecambiandonelasuaconformazione.
Questocambiamentocomportal’esposizionedelDOMINIODI
RECLUTAMENTODELLECASPASI(ARD),inpresenzadiATP.
Apaf-1,ècosi’ingradodireclutareedaKvarelapro-caspasi9
formandouncomplessochiamatoAPOPTOSOMA,ilqualeaKvala
pro-caspasi9,cheasuavoltaaKvalecaspasieffeFrici(3,6,7)con
conseguenteiniziodeifenomeniapoptoIci(frammentazionedel
DNA,disgregazionedelcitoscheletro,ecc..).
Nabissi2016
Nabissi2016
MODULATORIDELL’APOPTOSI
• Localizzandosi sulla membrana esterna del mitocondrio, favoriscono (se proapoptoIci)orendonomenofacile(seanI-apoptoIci)laformazionedimegacanali
elaconseguentefuoriuscitadimolecolepro-apoptoIche
• SonostruFuralmentesimilitraloro(dominiBH1-4+dominiotransmembrana)
• AnI-apoptoIci:Bcl-2,BclXL,
• Pro-apotoIci:Bad,Bax,Bak,Bid
• SImoliendogeniedesogeniagisconosullapropensioneall’apoptosidellacellula
alterandolaloroquanItà,localizzazioneestatodiaKvità
Nabissi2016
LafamigliaBcl-2
• Il gene Bcl-2 (B-cell leukemia/lymphoma 2) fu idenIficato nelle cellule B del
linfoma follicolare e la sua over-espressione antagonizza l’induzione
dell’apoptosi mediata da diversi sImoli, compresi quelli da chemioterapici. La
suaover-espressioneindiversiIpiditumorecontribuisceallacrescitacellulare
ed in combinazione con l’over-espressione di altri oncogeni (c-myc), alla
trasformazioneneoplasIca.
• Diversi membri della famiglia Bcl-2 sono staI idenIficaI e caraFerizzaI per la
lorofunzionepro-apoptoIcaequindipotenzialioncosoppressori(Bax,Bak,Bim,
Bid….),ofunzioneanI-apoptoIcaequindipotenzialioncogeni(Bcl-2,Bcl-XL,..).
• Inoltreilgenomadialcuniviruspatogeni(Epstein-Barr,sarcomadiKaposivirus)
codificanoperproteinesimiliaBcl-2.
Nabissi2016
LeproteineanI-apoptoIcheBcl-2contengonoquaFrodominiconservaI
BH(1-4),omologhiaBcl-2,mentreimembripro-apoptoIcipossonoessere
suddivisiinquellicontredominiomologhi(Bax,Bak)oconsoloildominioBH3
conservato(Bid,Bim,Bad).
InoltremolIdiquesImembricontengonoregionicarbossi-terminalichehanno
affinitàperlemembrane,inparIcolarequellaesternadeimitocondri.
Inassenzadisegnalidimorte,molImembripro-apoptoIcisonolocalizzaInel
citosolonelcitoscheletroesolodoposegnalidimorteassumonouna
modificazioneconformazionalechelirendecapacidimigrareversolemembrane
mitocondriali.
LeinterazioniframembriproedanI-apoptoIcimodulalaredistribuzionedel
citocromocnelmitocondrio.
Nabissi2016
a) Leproteinepro-apoptoIchepossonoesseresuddiviseineffeSori(causanodepolarizzazione)osolo
BH3(sensibilizzatori,trasmeFonoilsegnaleapoptoIcoaglieffeFori).
b) Modello indireSo: BAX e BAD sono legaI ed inibiI da Bcl-2 quando sono nello stato
cosItuIvamente aKvo e il legame di BH3 a Bcl-2 è sufficiente per liberare Bad/BAX. Modello
direSo: Bad/Bax sono aKvaI da BH3 e Bcl-2 previene la depolarizzazione della membrana
mitocondrialesequestrandoBH3oinibendoBad/BaxaKvaI.
Nabissi2016
Nabissi2016
VIA INTRINSECA
Fattori stimolanti l’apoptosi
Le altre proteine pro-apoptotiche, (come BID), cooperano con BAX e BAD
nell’indurre il rilascio di citocromo c.
Inoltre il dimeri Bax-Bid induce il rilascio di AIF (Apoptosis Inducing Factor)
e Smac/DIABLO che blocca i fattori IAP (proteine inibitrici l’apoptosi).
AIF collabora nell’indurre il rilascio di citocromo c, ma ha anche la capacità
di traslocare nel nucleo ed indurre la condensazione della cromatina e
l’apoptosi mediante una via caspasi indipendente (attivazione di
endonucleasi).
Nabissi2016
Inibitoridell’apoptosi
(IAPfamily)
LeproteineIAP(InhibitorofApoptosisProtein)sonoproteinealtamente
conservateesonocaraFerizzatedaalmenoundominioBIR(baculovirus
inhibitorofapoptosisrepeat).
QuestodominioèpresenteindiverseproteinefracuicIAP1,cIAP2,XIAPe
Survivina.
LamaggiorpartedelleproteineIAPsonaltamenteespresseneitessuI
embrionaliequasiassenInellecelluledifferenziate,mentrelaloroespressione
aumentanellecelluletumorali.
LeIAPsileganoerendonoinaKvelecaspasi,mapossonosvolgereunruolo
inibitoriodelprocessoapoptoIcoanchelegandosialleproteinepro-apoptoIche
Smac/DIABLO(proteinechepromuovonol’aKvazionedellecaspasi,riducendo
l’inibizionedellecaspasiIAP-mediata).
Nabissi2016
Nabissi2016
Il citocromo c si lega ad APAF-1 monomero e ne induce la eptamerizzazione, formando
l’apoptosoma.LivellifisiologicidiATPotRNAbloccanoillegamedelcitocromocadAPAF-1
CitocromocrichiedeunamolecoladiFe,fornitadallaspaziointermembranale,perpotersi
legareadAPAF-1.
La fosforilazione della caspasi-9 da parte delle chinasi cicline dipendenN (CDK)-B [ciclo
cellulare] e ERK 1/2 [proliferazione], inibiscono la caspasi 9, mediante un meccanismo
ancorasconosciuto.
Nabissi2016
APOPTOSIDOVUTAADANNODELDNA
Laduplicazionecellulareèaccuratamenteregolatadauncomplessodiproteinechesonole
ciclineelechinasiciclinadipendenI(CDKs).
PerevitarelareplicazionediDNAdanneggiatodurantelafaseSolasuasegregazione
durantelafaseM,l’integritàdelDNAèmonitoratadaunaseriedivieditrasduzionedel
segnalechepossonoinibirelaprogressionedelciclocellularemedianteinibitoriche
interagisconoconicomplessiC/CDK,permeFendolariparazionedelDNA.
QuesIcontrolliavvengonoinduefasidelciclo(G1eG2).
IlcontrollodelDNAnellafaseG1coinvolgeduechinasi(ATReATM)chefosforilano
p53aKvandoloodistaccandoilsuoinibitoreMDM2.
IlfaForetrascrizionalep53aKvalatrascrizionedigeni(p21)ilcuiprodoFoinibiscela
sintesidiciclineelafosfoforilazionediRb.
Nabissi2016
RegolazionetrascrizionaledeiBcl-2
UnulImomeccanismocheregolal’espressioneelafunzionediBcl-2èla
suaregolazionetrascrizionale.p53silegaalpromotoredelgeneBax
mentredown-regolal’espressionediBcl-2.
Nabissi2016
CaspasieHSP
Hsp70eHsp27agisconosequestrandoAPAF-1eCit.C,prevenendola
maturazionedellacasp-9ediconseguenzainibendol’apoptosi.L’effeSo
inibitorioagisceanchealivellodellacas-3
Nabissi2016
NF-kBedApoptosi
PerquantoriguardailruolodelfaForetrascrizionaleNF-kB
nell’ambitodelprocessoapoptoIco,èbendescriFocomeNF-kB
inibiscal’apoptosimedianteaKvazionedifaForianI-apoptoIci
dellafamigliaBcl-2(inparIcolareilgeneBcl-xL)odelgeneFLIP
(faForeinibitoredell’apoptosi).Comunqueinaltresituazioni
fisiologicheNF-kBinducelamortecellularemedianteaumento
dell’espressionedip53oaKvandol’espressionedeigeniperFaso
FasL.InsintesiilruolodiNF-kBnelprocessoapoptoNcosembrasia
regolatodallacondizionefisiologicaedalNpodipopolazione
cellulare.
Nabissi2016
Nabissi2016
AUTOFAGIA
Autofagia (autodigesIone) si
riferisceapathwayscellulariche
coinvolgono il trasporto di
porzioni citoplasmaIche ai
lisosomi.
1)vesiclenucleaIon
(formazionedimembrane
(fagofori).
2)Allungamentodellevescicole
ecompletamento(crescitae
chiusura).
3)Fusionedell’autofagosoma
conillisosoma.
4)Lisidellemembranadell’
autofagosomaedegradazione
delsuocontenuto
1
2
3
4
Nabissi2016
Autofagiaaumenta:
1. Perturnoverdelleproteinee
organellicitoplasmaIci
2. Generazioneintracellularedi
nutrienIedenergia(es.duranteil
digiuno,riduzionedifaForidi
crescita,aumentodelladomanda
bioenergeIca)
3. Temperatura,concentrazionediO2,
densitàcellulare
REGOLATORICHIAVEDELL’AUTOFAGIA:
TORkinasecomplex,
ClassIIIPI3K
Nabissi2016
Nabissi2016
L’alterazione nei differenI sTeps
dell’autofagiahadiverseconseguenze:
reduced off-rate: risulta in una
d e g r a d a z i o n e l i s o s o m i a l e
compromessa, con accumulo di
autofagosomi.
decreased on-rate : nei dife8
(mutazioni, delezioni) di geni ATG si
ha riduzione di vacuoli autofagici e
accumulo di proteine aggregate e
danniagliorganuliintracellulari.
Nabissi2016
Fluorescencemicroscopy(Acidotropicdyes)
LysotrackerRed
WeaklybasicaminesselecIvelyaccumulate
incellularcompartmentswithlowinternal
pHandcanbeusedtoinvesIgate
thebiosynthesisoflysosomes.
Nabissi2016
Invecchiamentocellulare
• L’invecchiamentoèunprocessodeterminato
esclusivamentedaFATTORIGENETICI(teoria
geneIca)
• L’invecchiamentodipendedaevenIcasuali
checolpisconogliorganismivivenInelcorso
dellaloroesistenza(TeoriaStocasIca)
• faSoriesogeni+faSoriendogeni
Nabissi2016
LECARATTERISTICHEDELL’INVECCHIAMENTO
• LecaraSerisBchesono:
1. Instabilitàgenomica
2. Logoramentodeitelomeri
3. AlterazioniepigeneIche
4. Perditadiproteostasi
5. De-regolazione
dell’assorbimentodinutrienI
6. Disfunzionimitocondriali
7. Senescenzacellulare
8. Esaurimentocellulestaminali
9. Alterazionedella
comunicazioneintercellulare
Nabissi2016
Instabilitàgenomica
• AccumulodidannigeneIcidurantelavita:
1. MutazionipunIformi
2. Traslocazionigeniche
3. Perditaoguadagnodicromosomi
4. Dis-regolazionegenicacausatada
integrazioneviraleotrasposoni
DDR:DNADamageResponsemeccanismiingradodi
controllareeriparareidanni
Nabissi2016
AlterazioniepigeneIche
• I cambiamenI epigeneIche coinvolgono alterazioni nella meIlazione del
DNA, modificazioni post-traduzionali degli istoni e rimodellamento della
cromaIna.
• H4K16:istoneaceIlasi
• H4K20:trimeIlazione
• H3K9:meIlazione
• SIR2:deaceIlasi
Sonogeni,consideraBmarkersepigeneBci,associaBall’invecchiamento
Nabissi2016
Logoramentodeitelomeri
I telomeri sono legaN ad un complesso mulNproteico denominato Shelterin e il
logoramento dei telomeri è associato a perdita della funzionalità di questo complesso
proteico. In modelli sperimentali (loss of FuncBon) si ha un rapido declino della
rigenerazioneBssutaleedunacceleramentodeiprocessid’invecchiamento
Nabissi2016
PerditadiProteostasi
Perditadeimeccanismidicontrollodellaqualità,stabilitàefunzionalità.
QuesN sistemi funzionano in modo coordinato per ristabilire la struZura delle
proteine appaiate in modo non correZo, rimuovere e degradare quelle
danneggiate
Nabissi2016
Disfunzionimitocondriali
Nabissi2016
De-regolazionedell’assorbimentodinutrienI
L’assesomatotropico,comprendeilGH,
prodoFo dall’ipofisi anteriore e il
mediatore secondario IGF-1 (prodoFo
damolIIpicelluari).
IGF-1 signaling è fortemente correlato
con l’invecchiamento, in parIcolare
aFraversoFOXOemTOR.
Polimorfismi o mutazioni che riducono
il sistema IGF sono correlaI con la
l o n g e v i t à ( p a t h w a y s t r o fi c i e
bioenergeIci).
La restrizione calorica è correlata
all’invecchiamento normale e alla
longevità.
Nabissi2016
Senescenzacellulare
• La senescenza cellulare è definita
come l’arresto stabile del ciclo
cellulareaccoppiataacambiamenI
fenoIpici.
• L a s e n e s c e n z a è c a u s a t a
dall’accorciamento dei telomeri e
da fenomeni indipendenI dai
telomeri.
• Danni al DNA e de-repressione del
l o c u s I N K 4 / A R F a v v e n g o n o
p r o g r e s s i v a m e n t e e
c r o n o l o g i c a l m e n t e c o n
l’invecchiamento
Nabissi2016
Senescenzacellulare
• Le cellule in senescenza in un tessuto sono circa un 20%
(analisi del DNA danneggiato e della beta-galaFosidasi
(SABG))
• Quindi la senescenza cellulare non è un conceFo
generalizzatodituKitessuIdiunorganismo
• L e c e l l u l e i n s e n e s c e n z a s o n o s o g g e F e a
immunosorveglianzaefagocitate.
• La senescenza, previene la propagazione di cellule
danneggiateesImolailsistemaimmunitario.
• Quindi la senescenza è una risposta compensatoria che
contribuisceaproteggereitessuIdacelluledanneggiatee
celluletumorali
Nabissi2016
DelezionediINK4/ARF
BubR1progeroidmouse
BubR1progeroidmouselackingp16Ink4a
SABGstaining
Nabissi2016
MeccanismiaFraversocuilarimozionedellecelluleinsenescenzadaitessuIinvecchiaIpuo’
influiresullafunzionalitàIssutale.
Le cellule invecchiate mantengono comunque caraFerisIche e danni anche in assenza di
cellule in senescenza, dimostrando che i tessuB non possono regredire a condizioni preinvecchiamento.
Nabissi2016
Metodiperanalizzarel’aMvitàdellaSA-βgal
Cytochemical assay uses the chromogenic substrate 5-bromo-4-chloro-3- indoyl β-Dgalactopyranoside(X-gal),whichyieldsaninsolublebluecompoundwhencleavedby
β-galactosidase.
Nabissi2016