La chimica dei principi nutritivi
idee di base
Appunti ridotti all’
per gli allievi della 4A
1
La chimica dei principi nutritivi
Gli alimenti apportano agli animali le sostanze nutritive di cui questi hanno bisogno. Un unico
alimento è generalmente incapace di far fronte, da solo, all’insieme dei fabbisogni animali. E’
per questo che in ogni razione occorre associare vari alimenti.
Tutti gli alimenti sono formati dalle stesse sostanze: acqua, minerali, glucidi (o carboidrati),
lipidi, sostanze azotate.
ACQUA
Macroelementi
Cloro, fosforo, zolfo, calcio, sodio,
potassio, magnesio
Microelementi
Ferro, rame, zinco, cobalto,
manganese, iodio, selenio…
citoplasmatici
Pentosi
Esosi
Disaccaridi
Fruttosani
Amido
parietali dei
vegetali
Cellulosa
Emicellulosa
Sostanze pectiche
Lignina
SOSTANZA ORGANICA
SOSTANZA SECCA
TAL QUALE
CENERI
glucidi
lipidi
protidi
Sostanze
azotate
non protidi
Gliceridi
Steroidi
Cere
Aminoacidi liberi
Peptidi
Polipeptidi
Proteine
Ammidi (urea…)
Ammine
Ammoniaca
Basi azotate
La massa dell’alimento “così com’è” viene anche definita “tal quale”.
Essiccando l’alimento, otteniamo un residuo secco chiamato sostanza secca (s.s.). Perciò
umidità = massa prima dell’essiccazione (tal quale) - s.s.
La sostanza secca, sottoposta ad incenerimento a 550°C, lascia un residuo minerale chiamato
“ceneri”. La massa scomparsa durante l’incenerimento è chiamata sostanza organica (s.o.). Si
calcola così:
s.o. = s.s. – ceneri
La sostanza organica è formata da glucidi, lipidi e sostanze azotate.
2
La chimica dei principi nutritivi
1. Glucidi
I glucidi, o carboidrati, sono molecole presenti sia nei vegetali sia negli animali. Hanno
numerose e importanti funzioni vitali.
Le funzioni dei glucidi sono le seguenti:
• danno energia immediata (glucosio, fruttosio..)
• formano tessuti in grado di assicurare struttura ad animali e vegetali (chitina,
cellulosa)
• danno energia a più lenta cessione (amido e glicogeno).
I glucidi sono detti anche carboidrati perché la formula chimica di molte molecole appartenenti
a questo gruppo può essere espressa come idrato di carbonio (CH2O)n, con n≥3. Per esempio,
il glucosio ha formula C6H12O6.
I carboidrati sono classificati in base alla loro struttura:
Monosaccaridi e disaccaridi sono noti anche col nome di “zuccheri” per il loro sapore dolce.
Sulla base della loro complessità molecolare, distinguiamo tra
3
La chimica dei principi nutritivi
• monosaccaridi, composti da una sola molecola, come ad esempio glucosio,
fruttosio, mannosio, galattosio;
• disaccaridi, composti da due monosaccaridi legati tra di loro con eliminazione
di una molecola d’acqua (legame glicosidico); sono disaccaridi, ad esempio,
maltosio, cellobiosio, lattosio, saccarosio;
• polisaccaridi, formati da molte molecole legate insieme. Possono essere
omopolisaccaridi se sono composti dalla stessa molecola che si ripete, come
ad esempio amido, glicogeno, cellulosa; eteropolisaccaridi se nella loro
composizione entrano molecole diverse.
Monosaccaridi
Osserviamo la struttura di due zuccheri tra i più semplici: la gliceraldeide e il diidrossiacetone.
Notiamo tre atomi di carbonio, tre di ossigeno, sei di idrogeno: C 3H6O3. Entrambe le molecole
hanno la stessa formula molecolare, ma è diversa la loro formula di struttura.
Qual è la differenza?
Nel primo caso si tratta di un’aldeide; nel secondo caso, si tratta di un chetone. Sono due
isomeri.
I monosaccaridi dunque possono essere distinti in due gruppi: aldosi e chetosi.
4
La chimica dei principi nutritivi
Il glucosio, ad esempio, è un aldoso, perché contiene un gruppo aldeidico; il fruttosio, invece, è
un chetoso, perché ha il gruppo chetonico.
Altre differenze dipendono dalla posizione dei gruppi ossidrilici (-OH), che possono trovarsi
disposti in modo diverso intorno al carbonio. In realtà, in natura, esistono solo poche
combinazioni di questo tipo.
Se osserviamo la posizione dell’ossidrile sul penultimo atomo di carbonio, notiamo che esso
può trovarsi a destra o a sinistra. Nel primo caso viene attribuita la lettera D (destro), nel
secondo caso la lettera L (levo, cioè sinistro). Le formule di struttura usate sono quelle di
Fisher, semplici ma non reali.
Data la conformazione spaziale naturale della catena carboniosa, gli zuccheri non sono MAI
MOLECOLE LINEARI; sono dei semi – cicli che, reagendo fra gruppi funzionali vicini, tendono
a chiudersi formando degli anelli.
Data l’instabilità della molecola ciclica, questa si riapre in emiciclo generando così un equilibrio
tra la forma aperta e quella chiusa.
Entrambe le forme coesistono in soluzione acquosa. Il D – glucosio viene a formare un anello
a 6 C e si può rappresentarlo anche semplicemente con un esagono:
glucosio
fruttosio
Anche per il fruttosio è possibile una forma ciclica, però a pentagono.
La formula ciclica è detta “di HAWORTH” ed è più reale.
Formando un anello, il C in posizione 1 della catena può dare origine a due isomeri (=
anomeri), che differiscono per la posizione dell’ossidrile legato:
5
La chimica dei principi nutritivi
tipo α
tipo β
L’OH, come si vede, può trovarsi sotto o sopra il piano su cui sta l’anello. Nel primo caso è un
glucosio α (alfa), nel secondo è un glucosio β (beta). La posizione del gruppo OH sarà
importantissima per definire le proprietà dei carboidrati.
Infine, i monosaccaridi possono essere classificati secondo il numero di atomi di carbonio che li
compongono. Distinguiamo così:
3C
= TRIOSI
6C
= ESOSI
4C
= TETROSI
7C
= EPTOSI
5C
= PENTOSI
Ad esempio, il glucosio è un ALDOESOSO, il fruttosio un CHETOESOSO.
Osserviamo ancora alcuni monosaccaridi:
D – glucosio
D – mannosio
D glucosio e D mannosio sono isomeri che differiscono per la disposizione di un solo
gruppo OH. Si dicono in questo caso EPIMERI. D glucosio e D mannosio sono epimeri in
C 2.
6
La chimica dei principi nutritivi
D glucosio
D galattosio
D glucosio e D galattosio sono EPIMERI in C 4.
Disaccaridi
Il maltosio è il disaccaride che si forma dall’idrolisi dell’amido e del glicogeno. Anche
durante la germinazione dell’orzo si ha una progressiva demolizione della molecola
dell’amido in maltosio, ad opera di enzimi del seme stesso. L’orzo che ha subito una
germinazione controllata ed essiccamento successivo prende il nome di malto ed è usato
per fare la birra.
Dal punto di vista chimico il maltosio è fatto di due molecole di D–glucosio, unite da un
legame tra carbonio in posizione 1 del primo α glucosio e carbonio 4 del secondo glucosio.
Il legame è perciò detto “α 1-4”.
Il cellobiosio non esiste in natura, ma si forma nel corso delle fermentazioni batteriche
che avvengono nel rumine a carico della cellulosa. E’ formato da due glucosi di tipo D uniti
anch’essi con legame 1-4; la differenza rispetto al maltosio sta nel fatto che il primo
glucosio ha configurazione β. Il legame β 1-4 ha la caratteristica di non poter essere
scisso dagli enzimi digestivi animali.
Il lattosio è lo zucchero del latte ed è prodotto esclusivamente dalla ghiandola mammaria.
Ha un potere dolcificante meno accentuato rispetto al saccarosio. E’ formato da una
molecola di β – D galattosio, unita da un legame β 1-4 ad una molecola di D glucosio.
7
La chimica dei principi nutritivi
Il lattosio viene fermentato da molti microrganismi, che possono ad esempio trasformare il
lattosio in acido lattico (CH3 – CHOH – COOH) – come ad esempio avviene nello yogurt.
Quando viene fortemente riscaldato (175°C) il lattosio caramellizza.
Il saccarosio è formato da una molecola di α – D – glucosio e da una molecola di β – D –
fruttosio, unite insieme da un legame α 1 β 2. Questo tipo di legame interessa entrambi i
carboni anomerici delle due molecole, diversamente da quanto accadeva nei disaccaridi
osservati fin qui.
Il saccarosio è molto comune, presente in tutte le piante ma particolarmente nella canna
da zucchero e nella barbabietola da zucchero. Scaldato a 160°C si trasforma nel
cosiddetto zucchero d’orzo; a 200°C caramellizza.
In tutti i monosaccaridi e in tutti i disaccaridi qui esaminati, ad eccezione del saccarosio,
c’è sempre un punto della molecola particolarmente reattivo (gruppo aldeidico o
chetonico). Tali gruppi, nei disaccaridi, restano reattivi quando il legame è di tipo 1-4; sono
invece indisponibili se il legame, come appunto nel caso del saccarosio, è di tipo diverso
(1-2). Gli zuccheri “reattivi” sono detti riducenti o riduttori, in quanto la loro reazione può
comportare la propria ossidazione, con contemporanea riduzione di un’altra sostanza.
Sono perciò riducenti tutti i monosaccaridi e tutti i disaccaridi, ad eccezione del saccarosio.
La sostanza che viene utilizzata in laboratorio per verificare le proprietà riducenti di un
composto zuccherino (e quindi a quantificarne e qualificarne la presenza) si chiama
liquido di Fehling.
Polisaccaridi
L’amido, polimero dell’α-D-glucosio, è la sostanza che si forma nelle piante per
accumulare glucosio a scopo di riserva. E’ presente in larga percentuale nei cereali, inclusi
mais e riso, e nelle patate. E’ formato da due frazioni: amilosio e amilopectina. La prima
frazione ha una struttura soprattutto lineare, data da legami prevalentemente α 1-4 tra i
glucosi, con rari legami α 1-6. Si tratta di una frazione a maggiore solubilità e digeribilità.
L’amilopectina ha una struttura più ramificata e complessa, dovuta alla presenza di
numerosi legami α 1-6.
A questa struttura altamente ramificata e complessa è dovuto il fenomeno del
rigonfiamento dei granuli di amido in presenza di acqua, e della formazione di soluzioni
acquose colloidali.
In presenza di iodio l’amido dà una colorazione blu.
8
La chimica dei principi nutritivi
Nel disegno si osserva un tratto di amilosio con legami α 1-4.
Il glicogeno è un polisaccaride del glucosio a catena estremamente ramificata.
Costituisce anch’esso un accumulo di glucosio a scopo di riserva, ed è specifico per gli
animali ed i funghi. Poiché serve come riserva prontamente disponibile di glucosio, lo si
trova in quegli organi che hanno importanti richieste di energia, come fegato e muscoli.
Nei muscoli viene utilizzato anche dopo la macellazione, per tutte le trasformazioni
chimiche che prendono il nome di “frollatura” e che sono indispensabili per dare una carne
che risulti tenera al consumatore.
La cellulosa, presente in grandi quantità nella parete dei vegetali, è un polimero del β –
glucosio. Le molecole di β – glucosio che formano la cellulosa sono disposte a formare
catene lineari in cui il carbonio in posizione 1 della prima molecola è legato al carbonio 4
della seconda e così via. Si parla perciò di legame β 1-4 tra le singole molecole di
glucosio.
Le catene sono saldate una all’altra grazie ai legami idrogeno fra i gruppi ossidrilici
presenti su catene adiacenti.
L’idrolisi della cellulosa avviene per opera di particolari enzimi che riconoscono il legame β
1-4. Tali enzimi, assenti negli animali, sono invece prodotti dai batteri ospitati nel rumine
dei poligastrici. Grazie alla simbiosi tra batteri ruminali ed animale che li ospita, gli erbivori
possono utilizzare come fonte energetica la cellulosa.
Altri polisaccaridi di una certa importanza sono la chitina, sostanza che costituisce
l’esoscheletro degli artropodi ed è particolarmente abbondante nei crostacei. La chitina
contiene anche azoto, in quanto è il polimero di una molecola derivata da un
amminozucchero, combinazione di un esoso con un gruppo amminico. E’ presente anche
nei funghi e in qualche alga verde. Per la sua diffusione negli artropodi è probabilmente il
polisaccaride più diffuso in natura dopo la cellulosa.
9
La chimica dei principi nutritivi
La pectina è tra i componenti delle pareti delle cellule vegetali. E’ particolarmente
abbondante nelle bucce di agrumi e nella polpa delle barbabietole da zucchero. Ha
proprietà gelatinizzanti ed è perciò utilizzata industrialmente per la produzione di gelatine
di frutta o marmellate.
Le gomme sono prodotte dalle piante a scopo di proteggersi da ferite e talvolta sono
prodotte normalmente dalle cortecce e dalle foglie. La “gomma arabica” si ottiene per
indurimento all’aria del liquido fuoriuscito dalle incisioni praticate su varie piante (Ficus
elastica, Hevea brasiliensis ecc.) ed è famosa perché la sua soluzione ha potere adesivo.
Cellulosa, emicellulosa, lignina: la “fibra” dei vegetali
La cellula vegetale ha come propria caratteristica il possedere una parete esterna alla
membrana plasmatica.
La parete cellulare è costituita da pectina, emicellulosa, cellulosa, lignina.
I costituenti della parete cellulare non sono presenti nella stessa quantità in tutti i tessuti
vegetali. Infatti, i tessuti che devono costituire la struttura portante della pianta
(sclerenchimi) posseggono una parete molto spessa, a più strati; invece i tessuti verdi
hanno pareti molto più sottili.
10
La chimica dei principi nutritivi
I diversi tipi di cellule, con il loro differente contenuto di emicellulosa, cellulosa e lignina,
caratterizzano le varie parti della pianta ma anche le diverse fasi di sviluppo di una stessa
pianta che, mano a mano che invecchia, tende a sviluppare le parti lignificate.
a – paglia di frumento; b – foglia di loiessa
Nel corso delle fermentazioni batteriche, l’emicellulosa e la cellulosa vengono utilizzate dai
batteri. Anche l’amido contenuto nei semi ed i glucidi solubili che si trovano nei tessuti
verdi subiscono la stessa sorte.
11
La chimica dei principi nutritivi
Le attività di fermentazione si svolgono in tempi e quantità molto diverse, secondo la
complessità della molecola utilizzata dai batteri.
Nel caso esaminato in figura, l’amido dell’orzo dimostra la caratteristica di fermentare più
velocemente di quello del mais; invece è evidente che le polpe, che contengono molta
12
La chimica dei principi nutritivi
emicellulosa, fermentano di più e più velocemente della crusca di frumento, che contiene
relativamente più cellulosa. Ancora più lentamente e in modo incompleto fermenta la paglia di
frumento, che contiene più lignina.
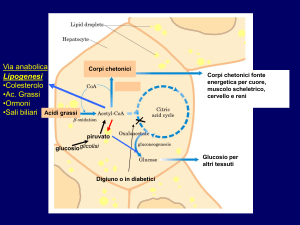
Una volta assorbiti, il glucosio e gli acidi grassi volatili (AGV) vengono utilizzati dall’animale
per il proprio metabolismo energetico, secondo lo schema seguente.
13
La chimica dei principi nutritivi
Lignina
La lignina non è un carboidrato, ma è in stretta relazione con i carboidrati della parete
cellulare vegetale in quanto anch’essa ne fa parte. In realtà, con questo termine si indica,
più che una molecola, tutto un gruppo di composti di varia struttura chimica. Resiste alle
attività di digestione animale ma anche alle fermentazioni ruminali; perciò la sua presenza
nei vegetali, che aumenta con l’invecchiamento della pianta, riduce la digeribilità degli
alimenti.
14
La chimica dei principi nutritivi
2. Lipidi
I lipidi sono sostanze organiche di elevato interesse biologico, non idrosolubili. Sono invece
solubili in solventi organici come il benzolo, l’etere, il cloroformio. Ciò dipende dalla loro natura,
prevalentemente idrocarburica e, perciò, apolare. Anche nel caso in cui nelle loro molecole vi
siano gruppi polari, questi costituiscono una parte troppo piccola per modificare le
caratteristiche dell’intera molecola.
I lipidi si trovano sia nei tessuti vegetali sia in quelli animali. Hanno funzione di riserva
energetica, sono componenti delle membrane biologiche, servono come trasportatori di
substrati e come sostanze “impermeabilizzanti”. Nei vegetali si trovano localizzati soprattutto
nei cloroplasti delle cellule, nel germe dei semi, nella cuticola delle foglie. Le piante i cui semi
contengono elevate quantità di trigliceridi sono dette “oleaginose”. Per esempio. Il seme di
sesamo contiene il 53% di olio; il ricino 47%; l’arachide 45%; il colza e il lino 37%; il cotone
20%; il mais solo il 4,5%.
I lipidi vengono classificati come si vede nella figura:
15
La chimica dei principi nutritivi
a) Gliceridi
I) semplici
I trigliceridi sono formati da acidi grassi (AG) e glicerolo. Gli acidi grassi possono essere diversi
tra loro a seconda:
• del numero di atomi di carbonio da cui sono composti: AG corti o volatili (C1 - C4);
AG medi (C6 - C14); AG lunghi (C16 - C22);
• del numero dei doppi legami presenti nella loro catena carboniosa, vale a dire a
seconda del grado di insaturazione: gli acidi linoleico, linolenico, oleico sono, ad
esempio, acidi grassi insaturi
All’interno dei trigliceridi distinguiamo grassi ed oli. I grassi sono tipici del mondo animale. Sono
solidi a temperatura ambiente e nella loro composizione prevalgono gli acidi grassi saturi. Gli
oli, invece, sono tipici del mondo vegetale. Sono liquidi a temperatura ambiente e nella loro
composizione prevalgono gli acidi grassi insaturi. A parte questo, grassi e oli hanno entrambi la
stessa struttura generale e le stesse proprietà chimiche.
In evidenza, notiamo il legame tipico dell’estere. Con le lettere R1, R2 e R3 vengono indicati in
questo caso gli acidi grassi, formati da catene idrocarburiche sature o insature. Nel caso in cui
R1 = R2 = R3 il trigliceride è definito “semplice” (ad esempio, la trioleina nell’olio) Se invece R1 ≠
R2 ≠ R3, il trigliceride è detto “misto”.
La sintesi di un trigliceride (per esempio per formare il grasso del latte) avviene mediante
l’esterificazione di una molecola di glicerina con tre acidi grassi; si ottiene una molecola di
trigliceride e tre d’acqua.
+ 3 R-COOH →
+ 3 H2O
Si realizzano così tre legami esterici (alcool + acido) sulla glicerina. Per questo motivo ci si
riferisce al trigliceride anche come ad un triestere della glicerina.
16
La chimica dei principi nutritivi
Un modo sintetico di rappresentare il trigliceride può essere anche questo:
ovvero come una specie di forchetta con tre lunghe punte. La
lunghezza delle catene carboniose dipende, naturalmente, dal tipo di
acidi grassi esterificati.
Nel caso in cui manchino una o più catene, si parlerà di digliceridi e monogliceridi.
Gli acidi grassi insaturi (con legame C = C) presenti negli acidi grassi dei trigliceridi sono tutti in
forma CIS.
In seguito a trattamenti termici si possono osservare fenomeni come lo slittamento dei doppi
legami e la trasformazione da cis a TRANS.
Forma CIS:
Forma TRANS:
Per esempio, se sottoposto a surriscaldamento l’acido oleico può mantenere inalterata la
posizione del doppio legame e passare a forma trans, trasformandosi in acido elaidinico;
oppure può far slittare il doppio legame ai due carboni successivi, diventando acido vaccinico.
L’idrolisi di un trigliceride è il processo con cui, da un trigliceride, in presenza di tre molecole
d’acqua e di solito per l’azione di un enzima (lipasi), si ottengono nuovamente tre acidi grassi e
un glicerolo. Questa reazione avviene normalmente durante la digestione, per azione delle
lipasi pancreatica ed enterica; ma avviene anche ad opera di batteri e muffe, provocando allora
un’alterazione dei grassi nota comunemente come irrancidimento idrolitico o lipolitico. La
maggior parte degli acidi grassi che si distacca è inodore e insapore, ma in alcuni casi si
liberano invece acidi grassi dal sapore e odore sgradevoli, che rendono il grasso, nel caso di
un alimento, immangiabile.
Se l’idrolisi avviene in ambiente alcalino, essa porta alla formazione di glicerolo e tre sali di
acidi grassi. Se i sali (esempio: R-COO‾Na+) hanno catene lunghe, cioè con C≥12, sono detti
SAPONI. Essi possiedono una lunga coda idrofoba e una testa idrofila.
Un altro importante fenomeno che riguarda i grassi è rappresentato dall’ossidazione. In
questo caso la molecola degli acidi grassi si rompe nel sito in cui vi è il doppio legame degli
acidi grassi insaturi, o per sostituzione di due idrogeni con un ossigeno negli acidi grassi saturi.
Si crea una catena di reazioni, particolarmente favorite dalla presenza di ossigeno, radiazione
luminosa, temperatura elevata, ioni metallici. L’alterazione dell’odore e del sapore è anche in
questo caso importante, e si usa il termine di irrancidimento ossidativi o chimico.
Infine l’idrogenazione è un processo con cui, in condizioni di forte pressione ed elevata
temperatura, gli acidi grassi insaturi si trasformano in saturi, cambiando il proprio stato fisico da
liquido a solido. E’ il processo con cui viene ad esempio prodotta la margarina, grasso
fisicamente simile al burro, a partire da oli vegetali.
17
La chimica dei principi nutritivi
II) complessi
Tra i gliceridi vanno ancora ricordati i fosfolipidi, componenti della membrana cellulare,
costituenti della guaina mielinica e con funzioni di trasporto nel sangue di oli e grassi; e i
glicolipidi, anch’essi associati a strutture biologiche soprattutto, negli animali, a livello di nervi e
materia cerebrale.
b) Non gliceridi
Le cere sono miscele di esteri derivati da alcoli e acidi organici, entrambi caratterizzati da
lunghe catene carboniose sature. Vediamone un esempio:
C15H31COOH + C31H63OH → C15H31COOC31H63 + H2O
Acido palmitico + alcool miricilico→ miricil-palmitato (cera d’api).
Possono essere vegetali, con funzioni di riduzione delle perdite d’acqua da traspirazione
fogliare; animali, con funzione di impermeabilizzazione di peli, lana e piume, come la lanolina;
montane, da ligniti fossili; artificiali, prodotte in laboratorio.
I terpeni sono composti di unità di isoprene ed hanno spesso struttura ciclica. Hanno odori
intensi e si trovano come componenti degli oli essenziali, ad esempio di canfora, di geranio, di
limone. Sono dei terpeni anche le vitamine A, E e K ed i carotenoidi.
CH2=C(CH3)-CH=CH2
isoprene
terpene
Sono steroidi alcuni composti di grande importanza biologica, come il colesterolo, gli acidi
biliari, diversi ormoni (estrogeni, progesterone, testosterone, ormoni della corteccia surrenale).
Sono dei lipidi non gliceridi infine anche le prostaglandine, sostanze con diverse attività
biologiche come la stimolazione della muscolatura liscia e l’abbassamento della pressione del
sangue o il riassorbimento del corpo luteo (PG – F 2α).
18
La chimica dei principi nutritivi
3. Proteine
Le proteine sono composti organici molto complessi. Contengono carbonio, idrogeno,
ossigeno, azoto e anche piccole quantità di zolfo. Sono molecole di natura colloidale.
Le proteine sono presenti in tutti gli esseri viventi in una grandissima quantità di tipi diversi.
Ogni tessuto ha proteine “speciali”, ogni specie ha proteine caratteristiche, addirittura ogni
essere vivente ha qualche piccola differenza proteica rispetto agli altri esseri della sua
stessa specie e razza.
La grandissima varietà di proteine è dovuta alle enormi possibilità di combinazione dei loro
costituenti fondamentali, gli aminoacidi. Come con sole 10 cifre (da 0 a 9) si possono
scrivere infiniti numeri, e con 26 lettere si possono scrivere milioni di libri diversi uno
dall’altro, così con soli 20 aminoacidi (quelli comunemente presenti nelle proteine) si
possono avere milioni di proteine diverse.
Aminoacidi
Dall’idrolisi delle proteine si ottengono gli aminoacidi. In natura ne esistono più di 170 tipi
diversi, ma, come si è detto, sono solo 20 quelli che compongono le proteine animali ed
umane:
Glicina
Alanina
Valina
Leucina
Isoleucina
Serina
Treonina
Cisteina
Metionina
Prolina
Fenilalanina
Tiroxina
Triptofano
Acido aspartico
Acido glutammico
Asparagina
Glutammina
Lisina
Arginina
Istidina
Gli aminoacidi vengono indicati con una sigla di tre lettere, di cui la prima maiuscola: ad
esempio, per l'aminoacido alanina si usa la sigla Ala; per l'aminoacido serina si usa la sigla
Ser; eccetera.
La loro formula generale è la seguente:
R è diverso a seconda dell’aminoacido: può essere un semplice atomo di idrogeno, ma
anche un radicale anche particolarmente complesso.
La presenza di un gruppo amminico –NH2 (basico) e di un gruppo carbossilico –COOH
(acido), chimicamente reattivi, determina la formazione della reale struttura di un aa, detta
forma dipolare:
19
La chimica dei principi nutritivi
forma neutra
forma salinica o
zwitterionica dipolare
A causa di questa caratteristica, gli aminoacidi possono comportarsi sia da acidi (in
ambiente basico) sia da basi (in ambiente acido). Perciò vengono definiti composti
anfoteri, dalla radice greca amphi che significa “entrambi”. Questa loro caratteristica
permette di esporre cariche differenti in diverse condizioni di pH.
a pH molto acido
a pH intermedio
a pH molto alcalino
Se la soluzione è acida, l’aminoacido è presente soprattutto nella forma cationica; nella
soluzione basica è presente soprattutto come anione. Per esempio, la caseina nel latte
manifesta carica negativa (pH = 6,7) e nel vino positiva (pH = 3). Il valore di pH a cui un
dato aminoacido si presenta come elettricamente scarico è detto punto isoelettrico.
In teoria possono esistere aminoacidi L e D, a seconda della posizione del gruppo
amminico. Tuttavia gli aminoacidi presenti nelle proteine hanno tutti configurazione L.
L - aminoacido
D - aminoacido
Gli aminoacidi sono uniti tra loro mediante il legame peptidico (ammidico) che si stabilisce
tra il gruppo amminico e il gruppo carbossilico di due aminoacidi adiacenti con liberazione
di una molecola d'acqua. Per questo le proteine sono anche dette polipeptidi. Ecco un
esempio di catena polipeptidica:
20
La chimica dei principi nutritivi
aa N - terminale
aa C - terminale
Ricorda che tutte le proteine sono polipeptidi, ma non tutti i polipeptidi sono proteine.
Le piante riescono a sintetizzare aminoacidi e proteine a partire da sostanze azotate più
semplici (ad esempio i nitrati presenti nel terreno o forniti con la concimazione). Anche i
microrganismi riescono ad elaborare sostanze azotate semplici in proteine complesse.
Gli animali, invece, per costruire le proprie proteine devono alimentarsi con fonti di
aminoacidi. Devono poi trasformare gli aminoacidi alimentari in aminoacidi corporei. In
alcuni casi non possiedono gli enzimi per farlo e devono necessariamente assumere tali
aminoacidi dall’esterno, attraverso il cibo. Gli aminoacidi che gli animali non riescono a
sintetizzare sono perciò detti essenziali.
Ad esempio, nel caso del maiale gli aminoacidi essenziali sono questi:
isoleucina
fenilalanina
leucina
treonina
lisina
triptofano
metionina
valina
I ruminanti hanno caratteristiche del tutto particolari riguardo agli aminoacidi: infatti i
microrganismi che vivono nel rumine riescono a fornire loro anche gli aminoacidi essenziali,
a partire da sostanze azotate anche molto semplici come l’urea o l’ammoniaca. Quando le
produzioni sono molto elevate, però, la produzione di aminoacidi essenziali da parte dei
batteri non basta. Allora anche ai ruminanti sarà necessario fornire aminoacidi essenziali
alimentari.
Nel caso degli esseri umani, sulla base delle più recenti ricerche, si è stabilito che soltanto
treonina e lisina sono realmente in aminoacidi essenziali, in altre parole non possono
essere sintetizzati dell'uomo e devono essere assunti con la dieta.
Classificazione delle proteine
Le proteine possono essere classificate in:
1) Semplici, se costituite solo da aminoacidi
21
La chimica dei principi nutritivi
2) coniugate, se ad esse è legato un gruppo non proteico, organico o inorganico,
indicato con il termine di gruppo prostetico (cioè "messo davanti"). Ad esempio nelle
glicoproteine il gruppo prostetico è uno zucchero, nelle fosfoproteine è l'acido
fosforico.
Livelli di organizzazione strutturale delle proteine
Alla grande varietà di funzioni delle proteine corrisponde anche una grande varietà di
strutture tridimensionali.
Ogni proteina presenta diversi livelli di organizzazione:
Struttura primaria: é data da numero, tipo e sequenza degli aminoacidi nella catena
polipeptidica.
Esempio: un pezzo della sequenza dell'insulina
Gly- Ile – Val – Glu – Gln – Cys – Cys – Ala – Ser – Val – Cys – Ser – …
Struttura secondaria: è data dei legami idrogeno che si instaurano fra i vari aminoacidi.
Determina una disposizione regolare ripetitiva nello spazio. Le due principali struttura
secondaria sono l'alfa-elica e la struttura a foglietto beta
alfa - elica
22
La chimica dei principi nutritivi
foglietto beta
Nella struttura ad alfa-elica i gruppi NH e CO di un segmento polipeptidico formano legami
H originando un giro destrorso di circa quattro aminoacidi.
Nel foglietto beta diversi segmenti della catena polipeptidica, che hanno una disposizione
distesa, sono paralleli tra loro. La struttura è stabilizzata dal legame idrogeno tra gruppi NH
e CO di segmenti adiacenti. L'affiancamento di diversi segmenti della catena polipeptidica
dà origine a strutture indicate con il termine di foglietti beta (beta sheet) ondulati a causa
degli angoli di legame.
Struttura terziaria: è la conformazione spaziale dovuta legami (ponti disolfuro S-S) che si
stabiliscono tra catene laterali di cisteina, aminoacido contenente gruppi sulfidrile (-SH).
In questo modo le proteine acquistano una conformazione tridimensionale caratteristica.
La funzione di una proteina è sempre correlata alla sua conformazione tridimensionale.
Nelle cheratine, ad esempio, i ponti disolfuro si formano tra catene di alfa eliche intrecciate.
Ciò consente flessibilità ed estensibilità.
Negli enzimi, la particolare struttura "a gomitolo" è dovuta ad anse presenti nella catena
formate da ponti disolfuro; ciò consente facilmente il movimento in mezzi acquosi.
Struttura quaternaria: è data dal modo in cui sono disposte o raggruppate nello spazio più
catene polipeptidiche (subunità). Per esempio l'emoglobina è un tetramero formato da
quattro subunità.
23
La chimica dei principi nutritivi
La proteina completa dell'emoglobina è formata cioè da quattro catene polipeptidiche
ripiegate (i gruppi prostetici eme sono legati alle catene polipeptidiche e contengono atomi
di ferro che servono a trasportare ossigeno e anidride carbonica.
Dal punto di vista della loro struttura, le proteine vengono classificate in:
Fibrose o strutturali, a forma di lunghe catene. Sono generalmente insolubili in
acqua. Vi appartengono le cheratine (pelle, capelli, unghie), il collagene (cartilagini,
vasi sanguigni, pelle) e le sete.
Globulari, a forma sferica. Sono solubili in acqua in quanto contengono molti gruppi
polari o ionici. Vi appartengono enzimi, alcuni ormoni, proteine di trasporto, deposito
e riserva.
Funzioni delle proteine
La funzione di una proteina, strettamente legata alla sua conformazione tridimensionale,
dipende dall’interazione con altre molecole: per esempio gli anticorpi si legano a virus o
batteri.
La sostanza che si lega alla proteina è detta ligando e la regione specifica della proteina
che aderisce ad esso si chiama sito di legame. Le interazioni tra sito di legame e ligando
sono interazioni tra forme complementari e sono dovute a legami deboli (legami idrogeno,
forze di Van der Waals).
È evidente che variazioni, anche minime, nella struttura primaria di una proteina alterano la
sua forma tridimensionale (in quanto modificano le interazioni tra aminoacidi)
compromettendone la funzionalità.
24
La chimica dei principi nutritivi
Tra le principali funzioni delle proteine vanno ricordate:
- catalisi enzimatica: gli enzimi aumentano fino a 1020 volte la velocità delle reazioni
biochimiche
- riserva: albumina dell'uovo, caseina del latte, zeina del mais
- trasporto: emoglobina, mioglobina
- struttura: cheratina, collagene, seta
- ormoni: insulina, ormone della crescita, ossitocina
- anticorpi: immunoglobuline
- tossine: veleni dei serpenti, tossina del Clostridium botulinum
- contrazione: miosina dei muscoli
Denaturazione proteica
L'esposizione delle proteine ad eccessi di pH o di temperatura (superiore ai 60°C) provoca
un cambiamento della struttura con relativa perdita della funzionalità.
Nelle proteine globulari, ad esempio, la denaturazione provoca un dispiegamento della
catena che si avvolge a caso e con irregolarità.
Un classico esempio di denaturazione proteica è la cottura dell'albume.
Utilizzazione delle proteine negli animali domestici
Le proteine presentano due diversi tipi di utilizzazione, a seconda che si tratti di un animale
monogastrico o poligastrico.
Il monogastrico digerisce la proteina grazie agli enzimi gastrici, pancreatici, enterici. La
sequenza degli enzimi è la seguente:
pepsina; tripsina, chimotripsina, carbossipeptidasi; erepsina.
Alla fine del processo digestivo si ottengono aminoacidi che vengono assorbiti dall’intestino
ed utilizzati dall’animale per le sue produzioni (accrescimento; latte per i piccoli; feti; uova;
pelo o piume…) e per il rinnovo dei tessuti corporei (muscolo, scheletro, epiteli, connettivi,
cartilagini, sangue…).
I tessuti corporei vengono continuamente demoliti e ricostruiti; nel corso di queste attività
una parte degli aminoacidi viene definitivamente persa e deve essere reintrodotta con
l‘alimentazione.
E’ fondamentale che l’alimento apporti gli aminoacidi essenziali, senza i quali il
monogastrico non può ricostruire le proprie proteine.
25
La chimica dei principi nutritivi
Nel corso delle attività di mantenimento e produzione, il monogastrico elimina una certa
quantità di sostanze azotate, sia attraverso le feci che attraverso le urine.
Nell’azoto fecale si ritrovano le sostanze azotate che non sono state digerite, e
proteina proveniente dalle desquamazioni dell’epitelio intestinale o dai batteri che
popolano l‘intestino;
nell’azoto urinario è compresa l’urea che deriva dai processi di rinnovamento dei
tessuti e dagli eventuali eccessi di aminoacidi provenienti dall’alimentazione rispetto al
fabbisogno dell’animale.
Per diminuire le perdite di azoto (che vanno a finire nei reflui, con effetti di inquinamento
dell’ambiente) si può agire utilizzando proteine molto digeribili e fornendo miscele ottimali di
aminoacidi essenziali rispetto alle necessità dell’animale (è il concetto della proteina
ideale).
Il poligastrico, invece, prima di digerire le proteine nell’intestino le vede trasformare in gran
parte (70-80%) per azione dei batteri ruminali, secondo lo schema seguente:
Anche il ruminante presenta nelle feci e nelle urine una certa quantità di sostanze
proteiche.
Per diminuirne la quantità si possono scegliere alimenti più digeribili. Non ha senso,
invece, il concetto di proteina ideale, in quanto gli aminoacidi essenziali vengono
prodotti dai batteri secondo le proprie necessità, con le quali no è possibile interferire.
Invece, è possibile fare in modo che i batteri lavorino al meglio delle loro possibilità,
•
garantendo quantitativi corretti di proteina alimentare (non eccedere né dare
meno del necessario),
•
fornendo ai batteri anche l’energia necessaria per le loro sintesi,
•
mantenendo il pH del rumine al giusto livello (6,2 – 6,8).
26