CHIMICA ORGANICA
PON C1 di SCIENZE
Esperto prof. C. Formica
Immagini e testi tratti dai website di: genome.wellcome.ac.uk, dnaftb.org, unipv.it, unimi.it,
wikipedia.it, unibs.it, unisi.it, unina.it, uniroma2.it, nih.gov, zanichelli.it, sciencemag.org, ncbi.gov
Atomo di carbonio
Z=6; configurazione: 1s 2 2s2 2p2
Nuclidi: 12C, 13C, 14C, 15C, 16C.
12C
è il più abbondante
14C
è il più “famoso”: si usa per la radiodatazione
fossili di migliaia di anni (t1/2 = 5730 anni)
2
IBRIDAZIONE ORBITALI
Configurazione del carbonio
2s2
2p2
Stato fondamentale
1s2 2s22p2 di questi solo 2s22s2 , cioè i 4 elettroni di
valenza, sono indispensabili per comprendere i legami
del C
2s2
2p2
Stato eccitato
Dallo stato fondamentale (a sinistra), per eccitazione energetica
(promozione) , uno degli elettroni 2s trasloca verso uno degli orbitali
2p . In questo modo si passa allo stato eccitato (destra), con i 4
elettroni distribuiti uno per ogni orbitale 2s, 2px, 2py, 2pz. Il
risultato è la formazione di orbitali IBRIDI, (funzioni algebriche
degli orbitali di partenza 2s e 2p che hanno energie abbastanza
simili) con disposizione spaziale differente dagli orbitali iniziali.
3
Orbitali ibridi
Le ibridazioni possibili tra s e p sono 3:
sp3: 3 orbitali 2p + 1 orbitale 2s (somma esponenti
1+3= 4). Questa ibridazione produce la formazione
di 4 legami σ , es. negli ALCANI
sp2: 2 orbitali 2p + 1 orb. 2s (2+1=3) mentre il 4°
orb. 2p non è ibridato. Questa ibridazione produce
la formazione di 3 legami σ e 1 π, quindi si forma 1
doppio legame, come negli ALCHENI e nell’O2
sp: 1 orbitale 2p + un 2s (1+1=2). Non ibridati 2
orbitali 2p. Questa ibridazione produce la
formazione di 2 legami σ e 2π, con formazione di un
TRIPLO legame, come negli ALCHINI e nell’N2
4
nuovi legami derivanti dall’ibridazione:
σ: elettroni distribuiti simmetricamente lungo l’asse di legame
π: elettroni distribuiti da parti opposte rispetto all’asse di legame,
perpendicolare al piano dell’asse
σ - 1/4 caratteri del 2s, ¾ del 2p
a)CH4, CH3-CH3 ecc. i 4 sp3 del C si combinano con 1s dell’H
b)CH2 = CH2 : 2 sp2 del C con 1s di H, 1 sp2 di C-C (+ 1 legame π)
c) CH ≡CH: 1 sp di C con 1s di H, 1 sp di C con sp dell’altro C (+ 2
legami π )
CO2 : sp di C con 2p di O (+ 2 legami π)
5
IBRIDAZIONE ORBITALI - schema riassuntivo
Legami
4σ
s p3 l’orbitale s si
ibrida con tutti i
3 orbitali p
s p2 l’orbitale s si
3σ + 1π
ibrida con 2
orbitali p
s p l’orbitale s si 2σ + 2π
ibrida con 1 solo
orbitale p
Geometria Angoli di
dei legami legame* Esempi
Tetraedrica 109,5°
CH4
CH3-CH3
Triangolare 120°
planare
CH2=CH2
Lineare
CH≡CH
180°
*Per confronto si rammentano gli altri angoli di legame:
H2O=104°
NH3 = 107,3°
6
IBRIDAZIONE ORBITALI – altri esempi
ibridazione
s p3
s p2
sp
molecola
Nome IUPAC (nome tradizionale)
NH3
NH4+
H2 O
BF3
BH3
SO3
Triidruro di azoto (ammoniaca)
Catione ammonio
Acqua
Trifluoruro di boro
Triidruro di boro
Triossido di zolfo (anidride solforica)
CO2
BeF2
Diossido di carbonio (anidride carbonica)
Difluoruro di berillio
7
ISOMERI
Atomi di C e
H legati in
modo diverso
ISOMERI DI
STRUTTURA o di
CATENA
Sono presenti
altri atomi,
oltre a C e H
ISOMERI DI
POSIZIONE
legami simili
Esempi
2-metil propano e N-butano;
N-pentano, 2-dimetilpropano, 2-metilbutano
Propanolo e isopropanolo;
ISOMERI
GEOMETRICI
Sono presenti doppi legami
STEREOISOMERI
diversa orientazione
spaziale degli atomi
CONVERTIBILI per rotazione intorno a un legame:
ROTAMERI
(NON CONVERTIBILI per rotazione: doppi legami nella
molecola. CONFIGURAZIONALI
Es. isomeri CIS e TRANS (es.dicloruro di etilene)
8
L’atomo di C può essere:
Primario
CH3 –CH3
Secondario
CH3-CH2–CH2-CH3
Terziario
CH2-CH -(CH3)CH2-CH3
Quaternario
(CH3)3–C-CH2CH3
legato a un solo carbonio
legato a 2 carboni
legato a 3 carboni
legato a 4 carboni
In parentesi i carboni delle catene laterali
Proprietà fisiche e geometriche degli idrocarburi
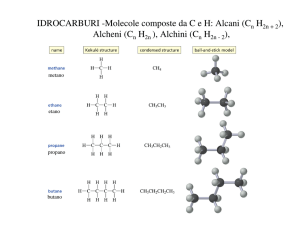
SATURI: ALCANI
INSATURI: ALCHENI, DIENI, ALCHINI
Meno idrogeno contengono, più sono insaturi
Il punto di ebollizione aumenta all’aumentare della massa molecolare.
Le catene lineari hanno punti di ebollizione superiori a quelli delle catene ramificate (le
forze di London sono più deboli), ma hanno punti di fusione inferiori alle ramificate.
Alcani CnH2n+2 e cicloalcani CnH2n sono apolari e fungono da solventi per le sostanze
apolari, come per esempio i grassi e sono insolubili in acqua, non formando legami a
idrogeno.
Gli alcheni CnH2n sono idrocarburi che presentano almeno un doppio legame nella
molecola, ibridazione sp2, geometria planare e angoli di legame di 120°.
Gli alchini CnH2n-2 sono idrocarburi con almeno un triplo legame nella molecola,
ibridazione sp, geometria lineare e angoli di legame di 180°.
Alcheni e alchini danno reazioni di addizione elettrofila al doppio e triplo legame, poiché
accettano doppietti elettronici.
Le reazioni in cui c’è un donatore di doppietti sono dette nucleofile.
Punto di ebollizione idrocarburi
Radicali alchilici degli idrocarburi
Si formano quando l’idrocarburo cede un idrogeno per sostituirlo con: -OH, -Cl, .F, COOH ecc.
Radicali degli alcani:
Metano CH4
metile -CH3
Etano CH3 CH3
etile –CH2-CH3
Propano CH3 CH2 CH3
Butano CH3 (CH2)2 CH3
propile –CH2-CH2 -CH3
butile –CH2 (CH2)2 CH3
Radicali degli alcheni:
Dall’etene CH2=CH2
vinile CH2=CH-
Dal propene CH2=CH-CH3
allile CH2=CH-CH2-
Scheletro carbonioso
CnH2n+2
Butano
angolo di legame 109,5° Le moioecole
possono assumere varie conformazioni inrorno al legame sigma
ciclopropano
ciclobutano
CnH2n sono apolari e fungono da solventi per le sostanze apolari, come per esempio i
grassi e sono insolubili in acqua, non formando legami a idrogeno.
Gli alcheni CnH2n sono idrocarburi che presentano almeno un doppio legame nella
molecola, ibridazione sp2, geometria planare e angoli di legame di 120°.
Gli alchini CnH2n-2 sono idrocarburi con almeno un triplo legame nella molecola,
ibridazione sp, geometria lineare e angoli di legame di 180°.
.
Composti aromatici
risonanza del
benzene C6H6
Il fenomeno dello spostamento dei doppi
legami si chiama DELOCALIZZAZIONE.
Il risultato finale viene rappresentato con un
cerchio al centro.
A causa della delocalizzazione degli elettroni
del benzene, una nuvola elettronica si
estende sopra e sotto il piano degli atomi di
carbonio
3/23/2014
14
Composti aromatici
OH
Il benzene può avere dei gruppi sostituenti laterali .
FENOLI: OH
ACIDI: COOH
AMMINE: NH2
ALOGENURI: Cl, F, Br, I
NH2
FENILAMMINA
(Anilina) mostra
proprietà debolmente
basiche
.
FENOLO mostra
proprietà debolmente
acide
Cl
COOH
ACIDO BENZOICO
BENZOCLORURO :
si ottiene mediante
ALCHILAZIONE
(reazione di
sostituzione)
3/23/2014
15
La nomenclatura degli idrocarburi alifatici C3
desinenza
formula bruta o
molecolare
propano
-ano
C3H8
CH3-CH=CH2
propene
.ene
C3H6
CH3-C≡CH
propino
.ino
C3H4
ciclopropano
.ano
C3H6
Classe di
composti
Formula di
struttura
ALCANI
CH3-CH2-CH3
ALCHENI
ALCHINI
CICLOALCANI
formula ciclica
CH2-CH2-CH2
nome IUPAC
∆
C3: composti organici con 3 atomi di carbonio
prof. Ciro Formica
16
La nomenclatura degli idrocarburi C6
Classe di
composti
Formula di struttura
nome IUPAC
desinenza
formula bruta
o molecolare
ALCANI
CH3-(CH2)4- CH3
esano
-ano
C6H14
ALCHENI
CH3-CH=CH-CH2-CH2-CH3
esene
-ene
C6H12
ALCHINI
CH3-C≡C-CH2-CH2-CH3
esino
-ino
C6H10
CH2-CH2-CH2-CH2-CH2-CH2
cicloesano
-ano
C6H12
benzene
-ene
C6H6
CICLOALCANI
Formula ciclica
IDROCARBURI CH=CH-CH=CH-CH=CH
AROMATICI
C6: composti organici con 6 atomi di carbonio
prof. Ciro Formica
17
La nomenclatura dei composti organici C3
dotati di gruppi funzionali
Classe di
composti
formula (esempio
composti a 3 atomi
di carbonio)
nome IUPAC
nome
tradizionale
gruppo
funzionale
desinenza
formula
bruta
(molecolare
ALCOLI
CH3-CH2-CH2-OH
propanolo
alcol
propilico
-OH
ossidrile
-olo
C3H8O
ACIDI
CARBOSSILI
CI
CH3-CH2-COOH
acido
propanoico
acido
propionico
-COOH
carbossile
.oico
C3H6O2
ALDEIDI
CH3-CH2-CHO
propanale
aldeide
propionica
-CHO
carbonile
.ale
C3H6O
CHETONI
CH3-CO-CH3
propanone
dimetilcheto
ne (acetone)
-COcarbonile
.one
C3H6O
AMMINE
CH3-CH2-CH2-NH2
propanammina
Amminopro
pano/propila
mmina
-NH2
amminico
-ammina
C3H9N
prof. Ciro Formica
18
COMPOSTI DOTATI DI GRUPPI FUNZIONALI
ALCOLI
ACIDI
ORGANICI
AMMINE
ALIFATICHE
ALDEIDI
Gruppo Formula e
funzionale nomenclatura
-OH
CH3CH2OH
-COOH
CH37COOH
-NH2
CH3-NH2
-CHO
CH3CHO
CHETONI
-C=O
CH3-CO-CH3
ESTERI
-COO-
CH3-COO-CH3
AMMIDI
ETERI
-CO- NH2 CH3-CO-NH3
-O-
CH3-O-CH3
Nome IUPAC e
tradizionale
Etanolo
(alcol etilico)
Ac. Etanoico
(ac. acetico)
Metal-ammina
Formula generale
Propr. chimiche
R-OH
neutro
R-COOH
Acido debole
R-NH2
Base debole
Etanale
(acetaldeide)
Propanone
(acetone)
Etanoato di
etile
Etammide
(acetammide)
dimetiletere
R-CHO
-
R-C=O
-
R-COO-R
-
R-CO-NH3
-
R-O-R’
Gli alcoli possono essere:
- primari, secondari e terziari a seconda del carbonio cui è legato l’OH
-monovalenti, bivalenti e trivalenti se posseggono rispettivamente 1, 2 o 3 OH
Le ammine possono essere: primarie, secondarie e terziarie a seconda del carbonio cui è legato
l’OH
19
Proprietà fisiche dei composti dotati di gruppi funzionali
A parità di massa molecolare, gli alcoli e i fenoli hanno punti di ebollizione
più alti rispetto agli idrocarburi e agli eteri.
La solubilità degli alcoli decresce all’aumentare del numero di atomi di
carbonio perché:
-prevale il carattere idrofobico della catena rispetto al carattere idrofilo
dell’ossidrile,
Si formano legami a idrogeno che rendono abbastanza solubili metanolo,
etanolo e propanolo in acqua
Le ammine primarie e secondarie formano legami a idrogeno
intermolecolari, pertanto i loro punti di ebollizione sono più alti di quelli
degli alcani a uguale massa molecolare.
I punti di ebollizione delle aldeidi e dei chetoni sono più alti di quelli degli
idrocarburi a uguale massa molecolare, ma minori a quelli degli alcoli
corrispondenti.
Proprietà chimiche dei composti dotati di gruppi funzionali
Gli alcoli :
-sono acidi molto deboli
-si disidratano in presenza di acidi molto forti
-danno reazioni con rottura del legame C—O,
-danno reazioni di ossidazione:
•alcoli primari: si ossidano ad aldeidi e poi ad acidi carbossilici
•secondari: si ossidano a chetoni
I fenoli sono circa un milione di volte di più acidi degli alcoli
Le ammine sono basi deboli
ACIDI ORGANICI (CARBOSSILICI)
HCOOH
CH3COOH
ACIDI
ORGANICI 1 carbossile
COOH
CH3CH2COOH
Esempi
ACIDO METANOICO
(formico)
AC. ETANOICO (acetico)
AC. PROPANOICO
(propionico) ecc.
metil propano
ACIDO OSSALICO
COOH-COOH
AC. MALICO
2 o più
carbossili
COOH
COOH –CH-OH-CH2COOH
COOH -CH3CH-COOH-COOH
AC. CITRICO(ciclo di
Krebs) ecc.
22
ac. formico
ac. acetico
ac. benzoico
Gli acidi carbossilici sono polari, liberano H+ e hanno punti di ebollizione elevati
Reazioni tipiche degli acidi carbossilici
Esempi
Base
forte
Acido+
Acido
alifatico+ alcol
Acido
aromatico + alcol
ammin
Acido +
a
CH3-COO-Na
Sale
CH3-COOH + NaOH
Estere
alifatico
CH3-COOH + CH3CH2-OH CH3-COO-CH2CH3
Estere
aromatico C6H5-COOH + CH3CH2-OH C6H5-COO-CH2CH3
CH3-CO-NH2 +
CH3OH
Ammide CH3-COOH + CH3NH2
Prodotto
finale
Acetato di
sodio
Acetato di
etile
Benzoato di
etile
etanammide
Viene eliminata una molecola d’acqua H2O come nelle condensazioni
24
ACIDI GRASSI SATURI
Formula e nomenclatura
CH3(CH2)10COOH
Laurico
CH3(CH2)12COOH
Miristico
CH3(CH2)14COOH
Palmitico
CH3(CH2)16COOH
Stearico
CH3(CH2)18COOH
Arachidico
CH3(CH2)22COOH
Lignocerico
Atomi C
n-Dodecanoico
12
n-Tetradecanoico
14
n-Esadecanoico
16
n-Ottadecanoico
18
n-Eicosanoico
20
n-Tetracosanoico
24
ACIDI GRASSI INSATURI
Formula e nomenclatura
3/23/2014
Atomi C
CH3(CH2)5CH=CH(CH2)7COOH
Palmitoleico
16
CH3(CH2)7CH=CH(CH2)7COOH
Oleico
18
CH3(CH2)4CH=CHCH2CH=CH(CH2)7COOH
Linoleico
18
CH3CH2CH=CHCH2CH=CHCH2CH=CH(CH2)7COOH Linolenico
18
CH3(CH2)4(CH=CHCH2)3CH=CH(CH2)3COOH
20
Arachidonico
25