UNIVERSITÀ DEGLI STUDI DI CATANIA
DIPARTIMENTO DI SCIENZE BIOLOGICHE, GEOLOGICHE ED
AMBIENTALI
Corso di laurea magistrale in Biologia Sanitaria
STEFANIA TIDONA
TESI DI LAUREA
INFLUENZA DELLE TERAPIE ORMONALI SULLA QUALITÀ DEL
LIQUIDO SEMINALE NELLA CURA DELL’IPOGONADISMO IPONORMOGONADOTROPO.
Relatrice:
Chiar.ma Prof.ssa RenataVISCUSO
Correlatore:
Dott. Giovanni BRACCHITTA
ANNO ACCADEMICO 2014-2015
INDICE
Premessa................................................................................................................
Pag. 04
Introduzione................................................................................................ Pag. 05
Cap. I
L’apparato genitale maschile...........................................
Pag. 07
Cap. II La spermatogenesi............................................................
Pag. 15
Cap. III La regolazione ormonale della spermatogenesi................
Pag. 19
Cap. IV Lo spermatozoo maturo e il liquido seminale................... Pag. 26
Cap V
La fecondazione………………….……..........................
Pag. 29
Cap VI
Infertilità........................................................................... Pag. 42
Cap VII
Infertilità maschile…....................................................... Pag. 44
Cap VIII Ipogonadismo ipogonadotropo ....................................... Pag. 55
Cap IX
Terapia per l’ipogonadismo…………………................. Pag. 61
Cap X
Gonal F………………………………………................. Pag. 70
Scopo del lavoro.......................................................................................
Pag. 75
Materiali e Metodi....................................................................................... Pag. 77
Risultati........................................................................................................ Pag. 86
Conclusioni.................................................................................................. Pag. 99
Bibliografia.................................................................................................. Pag. 100
Ringraziamenti…………………………………………………………..... Pag. 106
2
L’inclinazione di due persone di sesso diverso è la volontà di vivere
nel nuovo individuo che esse potranno e desidereranno generare,
una volontà che si agita nell’incontro dei loro sguardi.
Arthur Schopenhauer
3
Premessa
Nel corso della storia dell’uomo il desiderio di generare dei figli è sempre stato
predominante. Altrettanto presente è stata però la difficoltà in alcuni casi ad ottenere
una gravidanza.
Fin dall’antichità il concetto d’infertilità è stato sempre attribuito ad una condizione
femminile ed ha influenzato fortemente la vita di molte donne, appartenenti a tutte le
classi sociali. Regine ripudiate, popolane lapidate o addirittura ritenute streghe e
mandate al rogo. In molti casi la sterilità maschile non era nemmeno contemplata
come ipotesi, proprio per questo forte condizionamento che versava sulla donna.
Negli ultimi decenni l’attenzione si è spostata sulla considerazione che l’infertilità è una
condizione di coppia, non necessariamente legata ad un problema esclusivamente
femminile. Ciò ha spinto ad indagare maggiormente sui parametri che governano lo
stato di fertilità maschile: qualità del liquido seminale e corretto funzionamento del
processo di regolazione della spermatogenesi.
Oggi dai dati forniti dall’Istituto Superiore di Sanità (ISS) è noto che l’infertilità
maschile ha una prevalenza sovrapponibile all’infertilità femminile. Questo dato non
dipende soltanto dall’aumento dell’infertilità in generale ma è dovuto proprio ad una più
alta incidenza del fattore maschile.
In tal senso si è potuta orientare la ricerca per quanto concerne i trattamenti
farmacologici applicabili al maschio infertile.
4
Introduzione
Negli ultimi decenni si è assistito ad un forte aumento dei tassi di infertilità maschile a
seguito di nuove conoscenze che hanno permesso di superare quello che in passato era
pensiero comune e cioè che nella coppia fosse solo ed esclusivamente la donna la causa
dell’infertilità. In più oggi oltre alla figura del ginecologo, si sta sempre di più
affermando la figura dell’andrologo come punto di riferimento per il benessere della
fertilità maschile.
Per giungere ad una corretta diagnosi è possibile ricorrere a numerosi esami che
consentono di indagare efficientemente lo stato di fertilità maschile: esame del liquido
seminale, visita andrologica, ecografia specialistica, test di separazione nemaspermica,
test di frammentazione e spermiocolture.
Nonostante ciò i maschi italiani, ed in particolar modo i giovani, difficilmente si
rivolgono ad un andrologo, sottovalutando che anche la fertilità maschile ha bisogno di
prevenzione.
Inoltre, ciò che contribuisce ad aumentare la percentuale di infertilità maschile è lo stile
di vita scorretto che viene condotto dall’uomo moderno.
La promiscuità sessuale e il numero elevato di partner aumentano il rischio di diffusione
delle infezioni genitali che rappresentano una delle cause più comuni di infertilità da
patologie flogistiche.
Abitudini voluttuarie, quali fumo di sigaretta e abuso di alcol, incidono in modo
decisivo sull’aumento dell’infertilità maschile. Il fumo ha effetti negativi su tutti i
parametri seminali e aumenta il rischio di danni al DNA spermatico, mentre l’alcol
interferisce con la regolazione ormonale sia a livello testicolare riducendo la produzione
di testosterone sia a livello centrale inducendo uno scompenso della funzione delle
gonadotropine.
Oggi si tende sempre più ad essere sedentari e ad assumere comportamenti alimentati
anomali che portano all’obesità e al sovrappeso, anch’essi fattori di rischio importanti
per la fertilità. È stato dimostrato infatti che uomini sovrappeso o obesi hanno un minor
numero di spermatozoi normali e mobili e che l’obesità può influire negativamente
sulla funzione erettile.
5
Anche l’inquinamento ambientale ha la sua importanza; ad esempio l’uso spropositato e
la forte dipendenza dai cellulari, espone a continue radiazioni elettromagnetiche che
possono interferire sulla qualità del liquido seminale. Da una ricerca effettuata
dall’Università di Exeter, in Gran Bretagna, “Effect of mobile telephones on sperm
quality: A systematic review and meta-analysis” e pubblicata sulla rivista
“Environment International” è emerso che rispetto ai gruppi di controllo, nei quali il
50-85% dello sperma presenta motilità normale, nei soggetti esposti ai telefoni
cellulari si nota una diminuzione della motilità in media dell'8%. Lo stesso vale per
la vitalità, che risulta del 9% inferiore alla norma in presenza di un'esposizione
locale alle radiazioni.
Infine, un peso importante sull’aumento dell’infertilità maschile è dato dall’età. Come le
donne infatti, anche gli uomini per motivi differenti rimandano la paternità fino ai 35-40
anni. Diversi studi hanno però dimostrato che, al pari degli oociti, gli spermatozoi
invecchiano ed accumulano danni al DNA che si associano ad una maggiore probabilità
di generare figli affetti da disturbi neuro-cognitivi. In particolare, in un uomo di 50 anni
rispetto ad uno di 30:
Il volume dell’eiaculato si riduce dal 3% al 22%;
Il numero di spermatozoi nel liquido seminale diminuisce del 37%;
La motilità nemaspermica si riduce dal 4% al 18%.
6
L’apparato genitale maschile
L’apparato genitale maschile si sviluppa parzialmente verso l’esterno con il pene e lo
scroto, contenente i testicoli e gli epididimi; non sono invece visibili gli altri organi,
ovvero le vie spermatiche, le vescicole seminali, le ghiandole bulbo-uretrali e la
prostata.
Si può descrivere il pene dividendolo nelle seguenti regioni: la radice, che è connessa al
periostio dell’osso pubico, il corpo, o peduncolo libero, e l’estremità sensibile
ipertrofizzata che include il glande sul quale la pelle è ripiegata due volte per formare
una porzione retrattile bassamente legata, il prepuzio. All’interno, il pene comprende tre
corpi erettili spongiosi, detti corpi cavernosi, che consentono l’erezione del pene, e
l’uretra [1].
Nella parte superiore sono posti i corpi cavernosi appaiati e, nella parte inferiore, un
piccolo cilindro singolo che contiene l’uretra, il corpo spongioso. I tre corpi sono
avvolti da una forte guaina fibrosa, la tunica albuginea, spessa circa 1mm e ricca di
fibre elastiche, che compensano la distensione dei corpi cavernosi durante l’erezione
massima, e da cute lassa. Gli spazi presenti tra i corpi cavernosi sono maggiori al centro
rispetto alla periferia; essi sono pieni di sangue e circondati da uno strato appiattito di
cellule simile ad un endotelio e contengono fasci di muscoli lisci e di fibre elastiche [1].
Anteriormente l’estremità del corpo spongioso è dilatata e forma un’espansione, che
prende il nome di glande, sulla quale si apre l’orifizio uretrale esterno verticale, a forma
di fessura. Immediatamente sopra il glande si trova la base del prepuzio, il quale copre
completamente il glande quando il pene non è in erezione [1].
L’uretra maschile si estende dall’orifizio uretrale interno nella vescica all’orifizio
uretrale esterno a un’estremità del pene, misura circa 20 cm di lunghezza ed è divisa in
quattro parti:
1. La pars intramuralia, lunga 0,5-1 cm, si estende a partire dalla parte caudale
della parete muscolare della vescica.
2. La pars prostatica misura circa 3 cm di lunghezza e attraversa verticalmente la
prostata, infatti a livello della parete posteriore di questo tratto si riscontra un
piccolo dotto, il colliculus seminalis, su cui sono localizzate le aperture dei
canali prostatici escretori e dei dotti eiaculatori.
7
3. La pars membranosa misura 1-2 cm di lunghezza e attraversa il diaframma
urogenitale, è la porzione più stretta del canale ed è avvolta dalle fibre del
muscolo dello sfintere uretrale.
4. La pars cavernosa è contenuta nel corpo spongioso e rappresenta la parte più
lunga dell’uretra (15 cm), si dilata nel glande e forma la fossetta navicolare
prima di aprirsi nell’orifizio uretrale esterno.
La mucosa dell’uretra maschile presenta delle differenze regionali: in particolare, nella
porzione prossimale essa presenta il profilo tipico dell’urotelio, nella porzione distale si
differenzia in epitelio prismatico pseudostratificato e nella fossetta navicolare, l’epitelio
prismatico si appiattisce per diventare colonnare; esso contiene del glicogeno, che viene
metabolizzato in lattato attraverso i lattobacilli non patogeni, generando un ambiente
acido che evita le infezioni ascendenti urinarie [1].
I testicoli sono organi pari di forma ovale sospesi fuori dalla cavità pelvica addominale,
nella quale la temperatura è 2-3 °C sotto quella corporea centrale di 37 °C perché lo
sviluppo degli spermatozoi può essere normale solo a questa temperatura; il plesso
venoso pampiniforme è la struttura che contribuisce al raffreddamento perché si svolge
intorno all’arteria testicolare per assorbire il calore del sangue arterioso, raffrendandolo
così prima che penetri nella gonade. Prima della nascita, i testicoli scendono dalla cavità
addominale, dove si sviluppano, nello scroto attraverso il canale inguinale.
Ogni testicolo è circondato dalla tunica albuginea, che contiene cellule muscolari lisce:
sulla superficie dorsale, la tunica albuginea si ispessisce e forma il mediastino
testicolare a livello del quale il sangue e i vasi linfatici, i nervi e i dotti deferenti che
drenano gli spermatozoi all’epididimo entrano nelle gonadi o ne escono [2].
A partire dalla tunica albuginea, circa 250 trabecole fibrose si dipartono in direzione
centripeta, suddividendo il parenchima testicolare in lobuli, in ogni lobulo si osservano
da uno a quattro tubuli seminiferi molto sinuosi che producono spermatozoi. I tubuli
seminiferi proseguono ad ogni estremità con altri tubuli, i dotti deferenti, che
trasportano gli spermatozoi dal testicolo nel canale epididimario.
I testicoli svolgono due funzioni principali:
1. La spermatogenesi, mediante cui si opera la differenziazione dei gameti, gli
spermatozoi;
8
2. La steroidogenesi che prevede la sintesi e la secrezione controllata degli
androgeni, in particolare di testosterone.
Tuttavia, la produzione di androgeni e spermatozoi ha luogo in due compartimenti
diversi del testicolo e grazie alla funzione di due tipi di cellule somatiche, dette
accessorie: gli spermatozoi si sviluppano nei tubuli seminiferi in stretta associazione
con le cellule di Sertoli, mentre gli androgeni sono prodotti nelle cellule di Leydig,
localizzate nello spazio interstiziale tra i tubuli in cui sono compresi soprattutto
fibrociti, vasi sanguigni e linfatici e un numero significativo di leucociti [1].
Le cellule del Sertoli si trovano a stretto contatto con la membrana basale dell’epitelio
seminifero e sono cellule molto grandi, infatti si estendono dalla membrana basale fino
al versante luminale del tubulo. Queste cellule sono strettamente associate fra di loro
mediante dei sistemi di giunzione: le tight junction, o giunzioni serrate, collegano le
cellule più vicine alla membrana basale ed essendo provviste di punti di chiusura che
bloccano il passaggio di sostanze provenienti dallo spazio interstiziale, costituiscono la
barriera ematotesticolare che crea un ambiente idoneo e protetto per la spermatogenesi;
invece le gap junction, o giunzioni comunicanti, collegano le cellule sul versante
luminale.
Le cellule del Sertoli principalmente promuovono la proliferazione e la differenziazione
delle cellule germinali ma svolgono anche numerose altre funzioni:
Sostegno dell’epitelio seminifero.
Protezione e nutrizione delle cellule della linea germinale.
Coordinamento della spermatogenesi grazie alle gap junction.
Fagocitosi delle cellule in degenerazione o del citoplasma residuo.
Secrezione di varie proteine: la proteina ABP (Androgen Binding Protein)
mantiene la concentrazione ottimale di testosterone all’interno del tubulo, la
transferrina e la ceruloplasmina trasportano rispettivamente ferro e rame
all’interno del tubulo, gli attivatori del plasminogeno mediano le reazioni
proteolitiche necessarie per la migrazione degli spermatozoi dal testicolo.
Tutte le funzioni delle cellule del Sertoli sono indotte dall’interazione dell’ormone
follicolo-stimolante (FSH) con i recettori presenti sulla membrana cellulare.
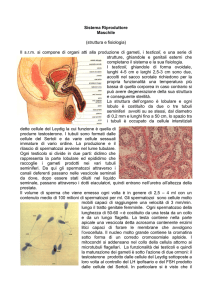
Le cellule di Leydig sono provviste di un citoplasma rosa abbondante con lipidi, un
lipocroma pigmentoso, soluzioni cristalloidi di Reinke e nuclei rotondi con nucleoli
9
distinti, e sono spesso associate alle fibre nervose. Costituiscono il tessuto interstiziale,
cioè il tessuto connettivo interposto tra i tubuli e si organizzano in gruppi in prossimità
dei vasi, inoltre alcune cellule di Leydig sparse sono anche trovate nel funicolo
spermatico, così come nella tunica albuginea. Le cellule di Leydig sintetizzano il
testosterone come principale androgeno e numerosi fattori proteinergici quali i fattori di
crescita, i neuropeptidi e le citochine. La funzione normale della cellule di Leydig è
dipendente dall’ormone luteinizzante (LH).
Figura 1. Sezione trasversale del tubulo seminifero con cellule del
Sertoli e cellule di Leydig.
10
Figura 2. Organizzazione del tubulo seminifero in sezione trasversale.
Nella parte posteriore del testicolo i tubuli seminiferi di ogni lobulo si anastomizzano
poi a formare la rete testis che, attraverso i dotti efferenti è connessa all’epididimo,
distinto in due regioni, una testa più contorta e una coda leggermente più rettilinea. Il
canale deferente è il prolungamento del canale epididimario e il suo diametro è di circa
3 mm. Fa parte del funicolo spermatico e attraversa, pertanto, il canale inguinale per
entrare nella cavità pelvica. Prima di entrare nella prostata a livello della sua superficie
dorsale, il canale deferente si ingrandisce formando un’ampolla e raggiunge, in seguito,
il canale della vescicola seminale per formare il dotto eiaculatore, il quale passa
attraverso la prostata e sbocca nella porzione prostatica dell’uretra, in prossimità
dell’orifizio dell’utricolo prostatico. Il dotto deferente è palpabile nel funicolo
spermatico grazie alla sua parete densa. Il canale deferente dell’adulto è rivestito da un
epitelio prismatico pseudo-stratificato che si appoggia su un unico strato di cellule
basali. Il rivestimento muscolare spesso si compone di due-tre strati. L’avventizia
esterna si compone di tessuto connettivo, vasi sanguigni e fibre nervose.
La prostata è una ghiandola solida, delle dimensioni di una castagna, situata nella cavità
pelvica presso l’origine dell’uretra. Sviluppata da una capsula di tessuto connettivo, essa
è composta da una serie radiale di circa 30-50 ghiandole tubulo-alveolari ramificate
11
circondate da un denso stroma fibromuscolare. La contrazione dei muscoli lisci libera il
contenuto della ghiandola prostatica nell’uretra al momento dell’eiaculazione. Dal punto
di vista embriologico e istologico, la struttura interna della prostata umana è divisa in
quattro sezioni:
Lo stroma non ghiandolare.
Il segmento preprostatico, che è la parte periuretrale considerata la sede
principale dello sviluppo dell’ipertrofia prostatica benigna.
La zona periferica.
La zona centrale che circonda i dotti eiaculatori ed è costituita da acini; ha una
configurazione relativamente semplice ed è inserita a cuneo nella zona
periferica.
La prostata umana ha una duplice funzione, in quanto produce numerosi composti
secretori che influenzano la superficie uretrale al passaggio del liquido seminale e che
agiscono sugli spermatozoi e sulle proteine della coagulazione follicolare. La secrezione
è leggermente acida (pH 6,4) e ricca di zinco, citrato, fosfatasi acida e proteasi, tra cui
l’antigene specifico della prostata (PSA), utilizzato a scopo diagnostico [1].
Le vescicole seminali sono strutture pari, allungate, a forma di sacco o di tubulo,
circondate da un rivestimento spesso di muscoli lisci. Le ghiandole sono situate tra il
fondo della prostata e il retto. Le vescicole seminali producono circa il 60-70% del
liquido seminale. Le loro parti prossimale e ampollare hanno una funzione di
riassorbimento di liquido e di spermatofagia (ingestione e degradazione da parte delle
cellule epiteliali degli spermatozoi lesi). Ogni vescicola è costituita da un unico tubulo,
ripiegato su se stesso e all’origine di molti diverticoli irregolari. Il lume è rivestito da
uno o da due strati di un epitelio prismatico che si piega fornendo un aspetto reticolato.
L’epitelio è circondato da un rivestimento muscolare [1].
L’attività secretoria della vescicole è una misura dell’apporto di testosterone all’epitelio.
I prodotti della secrezione delle vescicole seminali comprendono ioni, fruttosio,
prostaglandine, peptidi e proteine. Oltre alle forme di proteine legate al plasma quali la
transferrina,
la
lattoferrina
e
la
fibronectina,
sono
sintetizzati
dei
fattori
immunosoppressori e delle proteine specifiche, come la semenegelina,, responsabile del
coagulo del liquido seminale e sulla quale si esercita l’azione enzimatica dell’antigene
specifico della prostata (PSA).
12
Le funzioni della vescicole seminali riguardano dunque: la formazione del coagulo
seminale, la modificazione della funzioni degli spermatozoi (motilità, capacitazione) e
l’immunosoppressione.
Infine, le ghiandole bulbo-uretrali, o ghiandole di Cowper, sono ghiandole pari, della
dimensione di un pisello, situate sotto la prostata. Esse producono un muco denso e
chiaro che drena nell’uretra e che viene liberato prima dell’eiaculazione. Si ritiene che
la secrezione neutralizza le tracce di urina acida nell’uretra e che essa agisca come
lubrificante [2].
Figura 3. Apparato genitale maschile.
13
Figura 4. Gonade maschile.
14
La spermatogenesi
Si definisce spermatogenesi l’insieme delle tappe proliferative e delle modificazioni
morfologiche attraverso le quali gli elementi germinali maschili immaturi, gli
spermatogoni, si trasformano in elementi maturi, gli spermatozoi. Il processo completo
di sviluppo delle cellule germinali
avviene a livello dell’epitelio seminifero del
testicolo adulto.
La spermatogenesi può essere divisa in quattro fasi [1]:
1. Spermatocitogenesi. La spermatocitogenesi comprende la proliferazione ed il
differenziamento delle cellule germinali primordiali (PGC). Da queste si
differenziano gli spermatogoni. Gli spermatogoni di tipo A1 sono cellule
tondeggianti situate nella porzione periferica del tubulo seminifero e dotate di un
nucleo di forma ovoidale contenente cromatina finemente dispersa; tali cellule
inizialmente proliferano attraverso diversi cicli mitotici generando una
popolazione di cellule staminali dello stesso tipo e una popolazione di cellule ad
un grado maggiore di differenziazione, gli spermatogoni di tipo A2. Anche questi
vanno incontro a divisione mitotica e danno origine agli spermatogoni di tipo A3
i quali formano infine gli spermatogoni di tipo A4 [2]. A questo punto gli
spermatogoni di tipo A4 possono affrontare tre destini differenti:
Originare
altri
spermatogoni
A4
attraverso
un
processo
di
autorinnovamento;
Attivare il meccanismo apoptotico in modo da limitare la popolazione
delle cellule germinali in condizioni fisiologiche;
Formare cellule più differenziate dette spermatogoni intermedi che
effettuando la mitosi una sola volta dando origine agli spermatogoni di
tipo B; questi ultimi i quali presentano un nucleo arrotondato con
cromatina addensata in zolle. La successiva divisione mitotica di queste
cellule dà luogo poi agli spermatociti di primo ordine, cellule
rotondeggianti
più
voluminose
che,
appena
formate,
entrano
immediatamente nella profase della prima divisione meiotica.
2. Meiosi. Grazie alla meiosi gli spermatociti di primo ordine operano due cicli di
divisione, con dimezzamento del corredo cromosomico: in particolare, dalla
15
prima divisione meiotica, detta anche riduzionale perché il numero dei
cromosomi viene ridotto da diploide ad aploide, derivano gli spermatociti di
secondo ordine mentre dalla seconda divisione meiotica, detta equazionale
perché vede la divisione di ogni cromosoma nei due cromatidi costituenti,
originano gli spermatidi [3]. Ciascuno spermatide possiede 23 cromosomi che
sono differenti da quelli sia materni che paterni, possedendo tratti sia
degli uni che degli altri grazie al processo di crossing over, cioè lo scambio di
segmenti corrispondenti di cromosomi appaiati a livello di siti specifici, i
chiasmi. È importante precisare che tutte le popolazioni cellulari che derivano
dallo spermatogonio di tipo A1 effettuano, ad ogni ciclo di divisione, una
citodieresi incompleta e rimangono connesse tra loro mediante ponti
citoplasmatici durante tutta la fase di differenziazione. Ciò permette la
sincronicità di sviluppo delle cellule a livello di ciascuna area dell’epitelio
seminifero, infatti i singoli spermatozoi si separano solamente alla fine della fase
di citodifferenziazione che porta appunto alla loro genesi.
3. Spermioistogenesi. Consiste nell’insieme di modificazioni post-meiotiche molto
complesse attraverso le quali gli spermatidi si differenziano in spermatozoi.
Comprende quattro fasi [1, 2]:
Fase del Golgi. Nella regione citosolica adiacente al nucleo prende forma
l’idiosoma, costituito dai due centrioli, cioè dal diplosoma, circondati
dalle vescicole che formano il complesso del Golgi. Nel corso di questa
fase le vescicole migrano ad un polo della cellula mentre al polo opposto
permane il diplosoma a livello del quale i due centrioli si sistemano uno
dietro l’altro ed in particolare, il centriolo prossimale permane in
prossimità della carioteca e servirà allo zigote, poiché la cellula uovo
durante la sua maturazione ne perde uno, mentre il centriolo distale si
allontana e va incontro a modifiche che portano alla costruzione
dell’assonema flagellare [1, 2].
Fase del cappuccio. Una volta raggiunto il polo della cellula opposto a
quello in cui sta organizzandosi il flagello, le vescicole del Golgi
prendono il nome di granuli procrosomiali e iniziano ad aggregarsi
formando così l’acrosoma. Questo organulo contiene gli enzimi che
16
vengono rilasciati all’inizio della fecondazione per aiutare lo
spermatozoo a penetrare negli involucri che circondano l’oocita
secondario.
Intanto i mitocondri migrano nella regione posteriore dove vanno ad
avvolgere la porzione intermedia del flagello formando la guaina
mitocondriale e fornendo al gamete l’energia necessaria al suo
movimento [1, 2].
Fase dell’acrosoma. Il nucleo subisce una disidratazione e l’eucromatina
al suo interno viene fortemente condensata in quanto gli istoni sono
sostituiti dalle protammine che, essendo più basiche, legano più
saldamente il DNA permettendo così la riduzione del volume cellulare,
un movimento più agevole ed una maggiore protezione del DNA da
danni fisici o mutazioni durante il trasporto al sito di fecondazione [1, 2].
Fase di maturazione. La formazione dell’acrosoma spinge il citoplasma
verso la parte posteriore della cellula e ne induce l’eliminazione.
Figura 5. Spermioistogenesi.
17
4. Spermiazione. Comprende le fasi finali del processo di spermatogenesi, quali
l’interruzione del sincizio e il rilascio degli spermatozoi maturi nel lume del
tubulo. I gameti, ancora immobili, subiscono poi ulteriori modificazioni
morfologiche e funzionali all’interno dell’epididimo, infatti acquistano motilità e
vanno incontro a decapacitazione. Questo processo consiste nel legame di
proteine che, associandosi ai fosfolipidi di membrana, hanno la funzione di
stabilizzare la membrana stessa evitando che la reazione acrosomiale, cioè il
rilascio del contenuto acrosomiale, si verifichi troppo precocemente [1, 2].
Nei mammiferi le cellule germinali a diversi stadi di sviluppo si dispongono sulla
membrana basale dell’epitelio seminifero in una combinazione ordinata e ripetitiva sia
in senso temporale sia in senso spaziale, infatti cellule sempre più mature si sistemano
in direzione radiale, dalla membrana basale verso il lume del tubulo, e longitudinale,
lungo un tratto del tubulo [1, 2]. Questa organizzazione, visibile in sezione trasversale, è
definita onda dell’epitelio seminifero e si compone di un numero differente di stadi
secondo la specie: nell’uomo si distinguono VI fasi che comprendono otto stadi della
spermatogenesi (Wistuba et al. 2003). La durata di questa onda nel tempo costituisce il
ciclo dell’epitelio seminifero e nell’uomo è pari a 16 giorni, ciò significa che la
progressione da uno spermatogonio agli spermatozoi derivanti dura circa 70-75 giorni,
cioè quattro cicli e mezzo (Heller e Clermont 1964).
Figura 6. Onda dell’epitelio seminifero. In azzurro la membrana basale, in rosso
gli spermatogoni, in verde gli spermatociti primari, in giallo gli spermatidi, in
grigio spermatozoi a vari stadi del processo di spermioistogenesi.
18
La regolazione ormonale della spermatogenesi
L’adeguata secrezione di ormoni e la normale spermatogenesi da parte della gonade
maschile sono garantiti dalla presenza di sofisticati sistemi di controllo integrati tra
l’ipotalamo, l’ipofisi e il testicolo; questi meccanismi caratterizzano l’asse ipotalamoipofisi-testicolo. L’ipotalamo è il principale mediatore dell’attività cerebrale per la
regolazione di tutti i processi omeostatici dell’organismo, infatti è proprio a questo
livello che i segnali provenienti dall’ambiente interno e quelli provenienti dall’ambiente
esterno vengono confrontati per generare le risposte adeguate [4]: in particolare, i
neuroni neuroendocrini dell’ipotalamo secernono un fattore di rilascio, o releasing
factor, per le gonadotropine (GnRH) attraverso il quale essi sono in grado di controllare
l’attività ipofisaria e la produzione di ormoni, quali l’ormone follicolo-stimolante (FSH)
e l’ormone luteinizzante (LH), che agiranno sulle gonadi, in questo caso sul testicolo,
stimolando sia la sua funzione riproduttiva sia la sua funzione endocrina.
Il GnRH rappresenta l’ormone principale per il controllo della funzione riproduttiva in
quanto agisce stimolando la sintesi e il rilascio delle gonadotropine da parte dell’ipofisi.
È un decapeptide e viene sintetizzato da una rete neuronale localizzata in una specifica
regione ipotalamica che comprende la zona del setto, il nucleo arcuato e l’area preottica,
tuttavia è stato osservato che il GnRH può essere sintetizzato anche da alcuni neuroni
posti all’esterno dell’ipotalamo ma di comune origine embrionale, come quelli che
costituiscono il lobo olfattivo [4].
La forma attiva del GnRH si ottiene a partire da un preproormone, un precursore di 92
aminoacidi, il quale in primo luogo subisce un taglio proteolitico che lo converte in un
proormone di 69 aminoacidi; quest’ultimo viene infine convertito nella forma attiva di
decapeptide a livello delle terminazioni nervose secernenti dell’ipotalamo.
Il GnRH viene secreto in modo pulsatile (ogni 60-90 minuti circa) e presenta un’emivita
di circa 10 minuti [5]. Per mezzo del circolo venoso portale ipotalamo-ipofisario
raggiunge l’eminenza mediana della ghiandola pituitaria dove, interagendo con il
proprio recettore specifico (GnRH-R), stimola una specifica via di trasduzione:
1. Produzione di diacilglicerolo (DAG) ed inositolo trifosfato (IP3) come secondi
messaggeri;
19
2. Aumento della concentrazione citoplasmatica di Ca2+ sia attraverso il rilascio
dello ione dalle riserve intracellulari sia mediante l’apertura dei canali ligandodipendenti posti sulla membrana cellulare.
3. Attivazione della proteinchinasi C.
Le conseguenze dirette di questi meccanismi sono rappresentate dal rilascio della
gonadotropine ipofisarie mediante esocitosi e dalla successiva degradazione del
complesso recettoriale per il GnRH; questo verrà tuttavia ripristinato dalle cellule in un
arco di tempo che riflette l’intervallo tra due picchi di rilascio del GnRH [5].
La funzione essenziale del GnRH è quella di stimolare la sintesi e la secrezione delle
gonadotropine, FSH e LH, dalla regione anteriore della ghiandola pituitaria,
l’adenoipofisi; è importante però sottolineare che una bassa frequenza di rilascio di
GnRH favorisce la secrezione di FSH, viceversa l’alta frequenza di rilascio di GnRH
tende a stimolare preferibilmente la secrezione di LH [5].
La regolazione della secrezione di GnRH è dovuta all’interazione complessa tra diversi
neutrasmettitori e neuromediatori, infatti numerosi fattori e condizioni fisiopatologiche
del sistema nervoso, tra le quali lo stress, possono intervenire nelle secrezione di questo
ormone: ad esempio, la leptina e le afferenze dopaminergiche stimolano la secrezione di
GnRH mentre la prolattina, la dopamina, la serotonina, l’acido γ-aminobutirrico
(GABA) e l’interleuchina-1 svolgono un’azione inibitoria [4].
Nell’ultimo decennio studi effettuati sull’ipotalamo di uccello hanno evidenziato la
presenza di due importanti neuropeptidi ipotalamici, successivamente scoperti anche
negli altri Vertebrati: l’ormone inibente le gonadotropine (GnIH) e la kisspeptina.
Il GnIH, legandosi al suo recettore specifico GPR147, inibisce la sintesi delle
gonadotropine attraverso un meccanismo opposto a quello del GnRH.
La kisspeptina invece, è codificata dal gene KISS-1 e interagisce con il recettore
GPR54, in origine noto come metastasina per l’importante effetto sulla soppressione
delle metastasi, mediante il quale stimola la secrezione di GnRH [6]. Studi condotti
dalla University of Pittsburgh hanno osservato che la sintesi di kisspeptina viene
stimolata dal primo bacio e innesca una cascata di reazioni ormonali che portano
all’attivazione dei fattori di rilascio ipotalamici e di conseguenza, all’inizio della
pubertà.
20
In effetti la sintesi di GnRH comincia già durante il periodo fetale e ciò influenza i
livelli di gonadotropine durante le differenti età dell’individuo. Ad esempio, i bambini
mostrano quello che è definito “periodo finestra” durante i primi sei mesi di vita nel
quale è possibile individuare una certa funzione gonadica; dopo questo periodo, i livelli
di gonadotropine seriche si riducono fortemente ma possono essere identificati
nuovamente con l’inizio della pubertà [5].
Il legame del GnRH al suo recettore ipofisario induce la sintesi di gonadotropine da
parte delle cellule gonadotrope, o cellule β, nell’adenoipofisi. FSH e LH sono due
glicoproteine costituite ciascuna da due catene polipeptidiche definite subunità α e
subunità β [10]: la subunità α è identica per le due gonadotropine ed è la stessa che
compone anche l’ormone tireostimolante (TSH) e la gonadotropina corionica umana
(hCG) mentre la subunità β differisce tra FSH e LH e garantisce la specificità di legame
con il recettore, le differenti proprietà biologiche e l’identificazione a scopo diagnostico
ma l’attività biologica delle gonadotropine è dovuta anche alla componente
oligosaccaridica [7].
Il grado e la struttura di glicosilazione esprime differenti funzione, bioattività ed emivita
per ogni glicoproteina, infatti è noto che le glicoproteine possono essere dotate di:
1. O-glicosilazione caratterizzata dal legame di un residuo di N-acetilgalattosamina
(GalNAc) al gruppo carbossilico di un aminoacido tra serina e treonina [7].
2. N-glicosilazione che è caratterizzata dal legame di un residuo di Nacetilglucosamina (GlcNAc) all’estremità N-terminale di un’asparagina (Asn)
[7].
Gli oligosaccaridi terminano spesso con un residuo di acido sialico e/o con un gruppo di
GalNAc solforilata e ciò influenza ulteriormente le caratteristiche delle molecole, infatti
le isoforme ricche di solforilazioni vengono eliminate più velocemente dal circolo
sanguigno rispetto alle isoforme meno solforilate a causa della loro affinità con il
fegato; d’altro canto, le molecole ricche di acido sialico presentano un’emivita maggiore
[7].
Nell’uomo l’effetto di FSH e LH sullo sviluppo delle cellule germinali è mediato da
recettori per gli androgeni e per FSH accoppiati a proteine G e presenti rispettivamente
sulle cellule di Leydig e sulle cellule del Sertoli sebbene queste ultime presentino sia i
recettori per FSH sia i recettori per il testosterone perchè entrambe queste sostanze
21
stimolano l’inizio della gametogenesi e sono necessarie per il mantenimento di una
spermatogenesi quantitativamente normale.
L’FSH agisce all’interno del tubulo seminifero in quanto regola la funzionalità delle
cellule del Sertoli ma il suo legame con il recettore (FSH-r) attiva anche specifici geni
che codificano per fattori di crescita coinvolti nella regolazione della funzione delle
cellule di Leydig; in questo modo esso svolge quindi un’azione diretta e indiretta
sull’induzione della spermatogenesi, in sinergia con LH e sul suo mantenimento [8].
Invece, LH stimola la secrezione di testosterone da parte delle cellule di Leydig e
innesca lo sviluppo puberale maschile.
Il testosterone è un ormone di tipo steroideo e come tale, viene sintetizzato tramite una
cascata di eventi a partire dal colesterolo; tutte le tappe intermedie che caratterizzano la
sintesi di testosterone si trovano sotto il controllo di LH e sono catalizzate in massima
parte dagli enzimi del gruppo del citocromo P450 (CYP450) localizzati all’interno delle
cellule.
La prima tappa del processo è rappresentata dall’idrossilazione e scissione della catena
carboniosa laterale del colesterolo che porta alla formazione del pregnenolone il quale
fuoriesce poi dal mitocondrio e viene trasferito al reticolo endoplasmatico, dove subisce
le successive modificazioni enzimatiche da parte del CYP450. Il pregnenolone è il
precursore di tutti gli ormoni steroidei (mineralcorticosteroidei, glucocorticosteridei e
steroidi sessuali) e la sua sintesi controlla l’intero processo in quanto, anche in presenza
di abbondante colesterolo, il proseguimento della via biosintetica è strettamente
dipendente dall’attività del CYP450.
Nella biosintesi del testosterone il pregnenolone può seguire due differenti percorsi:
1. Via
del
pregnenolone.
Dal
pregnenolone
viene
ottenuto
il
17α-
idrossipregnenolone che viene poi trasformato in deidroepiandrosterone da cui si
ricava l’androstenediolo e quindi, il testosterone.
2. Via del progesterone. In questo caso il pregnenolone viene trasformato in
progesterone, questo viene convertito in 17α-idrossiprogesterone e infine si
formano prima l’androstenedione e poi il testosterone.
22
Via del progesterone
Via del pregnenolone
Figura 7. Via biosintetica del testosterone.
Una volta formato, il testosterone viene riversato nel lume del tubulo seminale e nel
circolo sanguigno attraverso il quale raggiunge i diversi organi bersaglio. In alcuni
tessuti, come la prostata, i testicoli, i follicoli piliferi e le ghiandole surrenali, viene
ulteriormente convertito in diidrotestosterone dall’enzima 5α-reduttasi per svolgere le
proprie funzioni androgene [2].
È importante ricordare che i livelli di testosterone intratesticolare sono circa 50 volte più
alti rispetto ai livelli di testosterone sierico, infatti i recettori per gli androgeni nel
testicolo normale raggiungono la saturazione [5].
Nel plasma gli ormoni steroidei viaggiano in massima parte legati a proteine di trasporto
specifiche, dotate di elevata affinità, in particolare la sex hormone-binding globulin
(SHBG) trasporta il 60% del testosterone circolante totale, il 38% è legato all’albumina
mentre solamente il 2% circola liberamente. Il testosterone libero rappresenta la forma
biologicamente attiva dell’ormone in quanto solo questo è in grado di interagire con i
23
recettori, invece la forma legata alle proteine plasmatiche costituisce un’importante
riserva ormonale [9].
Il testosterone prodotto dalle cellule di Leydig interagisce con il recettore per gli
androgeni esposto sulle membrane delle cellule del Sertoli, entra nella cellula e si lega
ad una proteina detta androgen-binding protein (ABP) agendo così per via paracrina.
Nei tubuli seminiferi il testosterone svolge numerose funzioni [2]:
Stimola la maturazione e la liberazione degli spermatozoi.
Influenza lo sviluppo ed il mantenimento dei caratteri sessuali secondari, quali la
crescita dei peli, l’ampliamento della laringe e lo sviluppo muscolare e
scheletrico.
Consente lo sviluppo ed il mantenimento della libido.
Esercita un meccanismo di feedback verso l’ipotalamo e l’ipofisi per regolare la
secrezione di GnRH e delle gonadotropine.
In realtà, nel mantenimento della vitalità delle cellule germinali, il ruolo del testosterone
e dell’FSH è operato in maniera sinergica, infatti nonostante la presenza di testosterone
sia indispensabile per la maturazione degli spermatozoi, l’FSH svolge un ruolo attivo
nella progressione degli spermatogoni di tipo A in spermatogoni di tipo B.
L’asse ipotalamo-ipofisi-testicolo mantiene l’equilibrio dinamico mediante un controllo
a feedback negativo poiché sono proprio i prodotti finali di questo meccanismo a
regolare la produzione dei fattori stimolanti a monte. Infatti, il testosterone secreto dalle
cellule di Leydig ha effetti soppressori sia sul rilascio di gonadotropine ipofisarie sia
sulla secrezione di GnRH dall’ipotalamo poiché a questo livello interagisce con
recettori specifici localizzati sui neuroni secernenti kisspeptina nel nucleo arcuato [5].
L'FSH invece, agendo sui recettori delle cellule del Sertoli, induce un meccanismo di
trasduzione del segnale che porta alla produzione di inibina B, una glicoproteina
costituita da due differenti subunità (α e β) unite da ponti disolfuro. L’inibina B, come il
testosterone, sopprime la secrezione ipofisaria di FSH ed è a sua volta inibita da esso, si
forma così un circuito chiuso nel quale concentrazioni elevate di FSH, legandosi ai
propri recettori sulle cellule del Sertoli, stimolano la produzione di inibina B viceversa,
ridotte concentrazioni della gonadotropina bloccano il rilascio di inibina B.
24
Figura 8. Regolazione dell’asse ipotalamo-ipofisi-testicolo.
Si pensa inoltre che la funzione testicolare sia regolata anche da altri fattori [5]:
1. Molecole secrete dalle stesse cellule germinali che agiscono sulle cellule del
Sertoli;
2. Estrogeni che possono legarsi ai recettori specifici scoperti nei dotti efferenti,
nelle cellule del Sertoli e nella maggior parte delle cellule germinali;
3. Gli ormoni tiroidei che intervengono nel sviluppo delle cellule del Sertoli.
25
Lo spermatozoo maturo e il liquido seminale
A conclusione del processo di spermatogenesi si ottiene una cellula altamente
specializzata, lo spermatozoo che è costituito da tre elementi: la testa, il collo e la coda.
La testa, ovale e appiattita, è la porzione più grande (diametro: 3 µm, lunghezza: 5µm) e
contiene il nucleo condensato e l’acrosoma; quest’ultimo occupa i due terzi anteriori
della testa e contiene una grande quantità di enzimi, tra i quali ialuronidasi, collagenasi,
neuraminidasi, fosfolipasi A e acrosina, la cui esocitosi a contatto con gli involucri
ovulari, definita reazione acrosomiale, è indispensabile per garantire l’ingresso dello
spermatozoo nella cellula uovo e quindi, l’efficienza della fecondazione [1].
Il collo è la regione di articolazione tra la testa e la coda del gamete maschile e contiene
nove colonne proteiche in connessione con le nove fibre esterne del segmento
intermedio della coda.
Infine la coda dello spermatozoo, lunga circa 55 µm, si compone di tre regioni [1]:
1. Segmento intermedio. È la porzione flagellare più spessa e più vicina alla testa,
al suo interno è presente l’assonema, costituita da una coppia di microtubuli
centrali circondata da altre nove coppie periferiche: i microtubuli della coppia
centrale sono circondati da una parete completa, mentre nelle coppie periferiche
un microtubulo è completo e l’altro è incompleto e si inserisce a C sul
microtubulo adiacente, inoltre le coppie microtubulari esterne sono collegati
mediante dei bracci laterali di dineina, una proteina ad attività ATP-asica
responsabile della conversione dell’energia chimica fornita dall’ATP in energia
meccanica. A livello del segmento intermedio della coda l’assonema è
circondata dalle fibre dense esterne e dalla guaina mitocondriale. Le prime si
ritengono responsabili del mantenimento della struttura elastica passiva che
rende possibile la curvatura del flagello e della protezione del gamete durante il
suo transito nell’epididimo (Baltz et al. 1990) mentre la guaina mitocondriale
risulta fondamentale per garantire il continuo apporto di ATP necessario al
movimento.
Il segmento intermedio termina in una struttura ad anello definita anello di
Jensen, o disco terminale, il quale impedisce lo spostamento dei mitocondri
26
verso la regione più caudale; inoltre, è proprio a questo livello che si
interrompono due delle nove fibre dense esterne.
2. Segmento principale. È il tratto intermedio della coda ed anche il più lungo (45
µm), è provvisto, oltre di sette fibre dense esterne, di una guaina fibrosa che
conferisce stabilità alla struttura flagellare.
3. Segmento terminale. È l’ultima regione del flagello ed è costituito solamente
dall’assonema circondato dal plasmalemma.
Figura 9. Parti principali di uno spermatozoo umano maturo.
Una volta maturi gli spermatozoi sono sospesi nelle secrezioni del testicolo e
dell’epididimo, a cui si aggiunge al momento dell’eiaculazione, la secrezione della
prostata, delle vescicole seminali e delle ghiandole bulbo-uretrali. Il prodotto finale è il
liquido seminale, un fluido viscoso composto quindi dal plasma germinale, contenente
sia componenti organici sia componenti inorganici e dai gameti che rappresentano la
componente cellulare.
Il plasma germinale consente la protezione e la nutrizione degli spermatozoi durante il
trasporto alle vie genitali femminili, infatti è costituito da proteine, lipidi,
27
prostaglandine, ormoni, ioni, acido citrico, fruttosio, vitamina C, numerosi enzimi,
zinco, carnitina e molte altre sostanze [2]. Ognuna di queste componenti svolge una
specifica funzione:
Il fruttosio e la carnitina sono coinvolti nel metabolismo e nella motilità degli
spermatozoi, in particolare il primo è utilizzato come fonte di energia mentre
l’altra viene impiegata per la produzione di energia.
Diversi enzimi proteolitici, insieme con l’acido citrico, si occupano della
liquefazione del liquido seminale.
I lipidi proteggono le membrane degli spermatozoi dalle variazioni ambientali e
possono anche rappresentare un’ulteriore fonte di energia.
Lo zinco possiede funzione battericida diretta e indiretta e stabilizza la cromatina
degli spermatozoi.
I bicarbonati svolgono la funzione di tamponi neutralizzando l’acidità
dell’ambiente vaginale.
Il muco aumenta la mobilità degli spermatozoi lungo le vie genitali femminili.
Le prostaglandine sono infine coinvolte nella soppressione della risposta
immunitaria femminile contro gli spermatozoi.
28
La fecondazione
La fecondazione rappresenta il momento fondamentale della riproduzione sessuale in
quanto permette la sopravvivenza della specie mediante la fusione dei due diversi
gameti, lo spermatozoo e la cellula-uovo; da questo processo casuale avrà origine lo
zigote, cioè la cellula da cui si svilupperà il nuovo individuo [10].
Nella specie umana e nei Mammiferi in generale, la fecondazione è interna perché
avviene all’interno dell’apparato genitale femminile in seguito ad una serie di
meccanismi che permettono il contatto tra i due gameti. Per poter descrivere
opportunamente questo processo è però necessario trattare brevemente il percorso del
gamete femminile, l’oocita, dalla gonade fino alla sede di fecondazione.
Il gamete femminile, a differenza dello spermatozoo, durante le fasi di maturazione si
presenta avvolto da diversi strati cellulari di origine gonadica implicate non soltanto nel
nutrimento dell’oocita ma anche nella secrezione di estrogeni. L’insieme di queste
cellule costituisce il follicolo ovarico al cui interno, durante la fase follicolare del ciclo
ovarico, l’oocita completa la prima divisione meiotica, cominciata durante il periodo
embrionale e intraprende la seconda divisione meiotica che verrà interrotta alla metafase
allo stadio di oocita secondario.
L’oocita secondario viene espulso dall’ovaio durante la fase di ovulazione del ciclo
ovarico in seguito alla stimolazione operata dal rilascio delle gonadotropine ipofisarie e
follicolari. Poiché la meiosi non è stata ancora portata a termine e la citodieresi della
prima divisione meiotica è asimmetrica, oltre all’oocita secondario che costituirà poi il
gamete femminile viene espulsa anche un’altra piccola cellula definita corpuscolo
polare, o polocita primario. L’emissione dell’oocita secondario e del corpuscolo polare
consente anche la formazione degli involucri ovulari che derivano dalle cellule
follicolari e rivestono ruoli molto importanti per la protezione e la maturazione del
gamete; nei Mammiferi essi sono così costituiti:
Zona pellucida. È una struttura di aspetto reticolare strettamente associata alla
membrana plasmatica dell’oocita e costituita da tre componenti glicoproteici
(ZP1, ZP2 e ZP3) organizzati diversamente per formare una zona superficiale, o
strato esterno, con fibre più lasse per garantire il contatto con lo spermatozoo ed
una zona profonda, o strato interno, con fibre più compatte e regolari coinvolta
29
nei processi molecolari che portano all’attivazione dell’oocita in seguito alla
fecondazione.
Cumulo ooforo. È formato da cellule ad azione steroidogenica immerse in un
materiale mucoso ricco di acido ialuronico.
Corona radiata. Pur presentando un’origine comune a quelle del cumulo ooforo
le cellule della corona radiata svolgono azioni differenti, infatti esse mantengono
un microambiente sano e favorevole alla fecondazione ed alle prime fasi dello
sviluppo embrionale ed inoltre operano una fagocitosi nei confronti degli
spermatozoi per limitare il numero di gameti maschili che giungono a contatto
con l’oocita secondario.
Figura 10. Meiosi per la formazione del gamete femminile. Maturazione del
follicolo ovarico all’interno della gonade femminile. In seguito all’emissione
dell’oocita secondario le cellule follicolari rimaste all’interno dell’ovaio
costituiscono il corpo luteo che mantiene la funzione steroidogenica: se l’oocita
viene fecondato il corpo luteo si accresce e prende il nome di corpo luteo gravidico
aumentando la sua produzione di ormoni fino alla 20a settimana di gestazione,
successivamente la sua funzione sarà sostituita dalla placenta; se invece la
fecondazione non ha luogo il corpo luteo degenera formando il corpo luteo
mestruale e viene riassorbito durante la mestruazione.
L’oocita secondario espulso dall’ovaio durante l’ovulazione viene accolto dalle fimbrie
digitiformi della tuba di Falloppio e condotto, mediante il movimento delle ciglia che
ricoprono la mucosa tubarica e i movimenti peristaltici della sua muscolatura, alla parte
più ampia della tuba, detta ampolla che costituisce la sede della fecondazione infatti è
30
proprio in questo punto delle vie genitali femminili che l’oocita incontrerà lo
spermatozoo.
Figura 11. Sezione frontale dell’apparato genitale femminile. 1. Cavità vaginale; 2.
Canale cervicale del collo dell’utero; 3. Miometrio; 4. Endometrio; 5. Porzione
intramurale della tuba uterina; 6. Istmo della tuba; 7. Porzione ampollare della
tuba; 8. Padiglione (o infundibulum)con le fimbrie; 9. Sezione dell’ovaio.
Al termine della loro maturazione all’interno del testicolo, gli spermatozoi subiscono
una serie di modificazioni, prima all’interno delle vie genitali maschili poi anche
durante il percorso nelle vie genitali femminili, che li rendono capaci di fecondare la
cellula-uovo.
Le prime trasformazioni necessarie per garantire la fecondazione da parte degli
spermatozoi sono a carico dell’epididimo, infatti al termine del processo di
spermioistogenesi gli spermatozoi vengono trasportati all’epididimo mediante
movimenti peristaltici del tubulo perché sono ancora immobili. Nel giro di pochi giorni
il sistema flagellare viene attivato e il gamete maschile diviene mobile. Inoltre, come
già accennato precedentemente, la parete dell’epididimo è in grado di secernere diverse
sostanze di natura proteica che, rimanendo legate alla membrana plasmatica del gamete
fino al momento della fecondazione, in parte presentano un’azione decapacitante in
quanto impediscono che la reazione acrosomiale si scateni troppo precocemente mentre
altre permettono il riconoscimento con la zone pellucida o la membrana plasmatica
dell’oocita.
31
Infine, le ghiandole sessuali accessorie (vescichette seminali, prostata e ghiandole
bulbouretrali) secernono il liquido seminale che garantisce nutrimento e protezione agli
spermatozoi assicurando così le condizioni ottimali per la loro sopravvivenza e
facilitandone il trasferimento fino al fondo della vagina al momento dell’eiaculazione.
Durante un rapporto sessuale circa 200 milioni di spermatozoi vengono depositati in
vagina a contatto con il muco cervicale, una secrezione glicoproteica viscosa prodotta
dal collo dell’utero che favorisce il movimento degli spermatozoi verso l’utero [3]. Fin
da questo primo momento viene attuata una selezione dei gameti più mobili, quindi più
idonei, mentre gli spermatozoi che non riescono a penetrare nell’utero sono rapidamente
degradati dal pH acido dell’ambiente vaginale.
Il movimento degli spermatozoi verso l’utero e da qui verso l’ampolla della tuba
uterina, sede della fecondazione, è fortemente agevolato dalle contrazioni della parete
muscolare delle vie genitali femminili e da diversi fattori presenti nel liquido seminale,
quali [3]:
Vescicolasi, prodotta dalle vescichette seminali, coagula una parte dell’eiaculato
formando così un tappo che impedisce il reflusso degli spermatozoi in vagina.
Prostaglandine stimolano la motilità uterina.
Fruttosio rappresenta la fonte di energia degli spermatozoi.
Durante la risalita lungo le vie genitali femminili gli spermatozoi, non ancora
fecondanti, subiscono il processo di capacitazione. Questo importante evento comporta
una serie di reazioni a carico delle strutture presenti nella membrana degli spermatozoi
che non modificano l’aspetto morfologico dei gameti ma li rendono adatti a fecondare
l’oocita.
In realtà, gli eventi molecolari alla base della capacitazione non sono ancora stati
chiariti completamente (Saling, 1989; Storey e Kopf, 1991), tuttavia si ritiene che tre
azioni molecolari siano importanti:
1. Alterazione della fluidità della membrana plasmatica mediante variazioni nella
composizione lipidica
durante la capacitazione la concentrazione di
colesterolo nella membrana plasmatica dello spermatozoo diminuisce (Davis,
1981), inoltre è stato scoperto che proprio l’albumina e la proteina 1 di trasporto
dei lipidi, contenute nel siero delle vie genitali femminili, sono responsabili di
questa rimozione (Langlais et al., 1988; Ravnik et al., 1992).
32
2. Eliminazione di particolari proteine o carboidrati dalla superficie spermatica
ad essere rimosse sono le proteine che bloccano l’interazione dello spermatozoo
con le componenti glicoproteiche della zona pellucida (Poirier e Jackson, 1981;
Lopez et al., 1985; Wilson e Oliphant, 1987).
3. Fosforilazione delle proteine coinvolte nel legame con la zona pellucida e nella
reazione acrosomiale
questa reazione consente l’attivazione di queste
proteine (Leyton e Saling, 1989).
In ogni caso, non è ancora certo in quale misura ognuno di questi meccanismi
contribuisca al processo di capacitazione, è certo però che gli spermatozoi che non sono
stati capacitati vengono fagocitati dalle cellule della corona radiata e perciò non possono
raggiungere l’oocita.
La reazione di capacitazione consente anche l’esposizione sulla membrana cellulare
dello spermatozoo di molecole capaci di interagire con sostanze, secrete dalle mucose
delle vie genitali femminili, che operano un fenomeno di iperattivazione aumentando
enormemente la motilità del gamete maschile verso la sede di fecondazione. Oltre ad
aumentare la velocità degli spermatozoi è possibile anche che, quando sono pronte per
la fecondazione, le componenti follicolari o l’oocita stesso siano in grado di secernere
sostanze chemiotattiche capaci di conferire direzionalità al movimento del gamete
maschile e di attrarlo verso l’uovo (Hunter, 1989).
È chiaro comunque che il percorso degli spermatozoi dall’ingresso dell’apparato
genitale femminile, cioè dalla vagina, fino alla sede della fecondazione, nell’ampolla
tubarica, è lungo e difficile anche perché consente già di effettuare una prima selezione
dei gameti più adatti; infatti solo 200 spermatozoi circa raggiungono il luogo della
fecondazione mentre la maggior parte degenera e viene assorbita dalla mucosa delle vie
genitali femminili [3].
Sebbene la fecondazione avvenga solitamente nell’ampolla tubarica, possono verificarsi
dei casi in cui i due gameti si incontrino in altre regioni della tuba tuttavia ciò non ha
mai luogo nel corpo dell’utero; infatti, se l’oocita non viene fecondato nella tuba passa
lentamente fino all’utero, dove degenera e viene riassorbito.
Solamente gli spermatozoi capacitati possono andare incontro a reazione acrosomiale, il
processo attraverso il quale l’acrosoma rilascia gli enzimi responsabili della
33
degradazione di piccole porzioni degli involucri ovulari al fine di permettere l’ingresso
dello spermatozoo fecondante nel citoplasma ovulare.
È interessante notare che nell’uomo pare che lo spermatozoo che penetra nell’oocita sia
quello che sviluppa la reazione acrosomiale proprio a contatto con la zona pellucida,
molti spermatozoi infatti possono andare incontro a questo processo già in prossimità
degli involucri ovulari cellularizzati, il cumulo ooforo e la corona radiata, ed è in
particolare questo evento a permettere allo spermatozoo fecondante l’avvicinamento e il
legame alla zona pellucida. Difatti il rilascio di ialuronidasi consente la degradazione
dell’acido ialuronico che mantiene adese tra loro le cellule del cumulo ooforo mentre
altri componenti, definiti enzimi della corona radiata, disperdono le cellule del secondo
involucro ovulare. Sembra che anche gli enzimi secreti dalla mucosa tubarica
favoriscano tale dispersione e che i movimenti della coda dello spermatozoo risultino
pure importanti per la penetrazione della corona radiata.
Il legame tra la membrana plasmatica dello spermatozoo e le glicoproteine costituenti la
zona pellucida rappresenta il momento più importante per l’avvio della fecondazione in
quanto il riconoscimento tra queste due strutture innesca la reazione acrosomiale e
permette di conseguenza l’ingresso del gamete maschile all’interno dell’oocita;
spermatozoi che hanno già rilasciato gli enzimi acrosomiali non sono capaci di
penetrare la zona pellucida.
L’importanza dell’interazione tra lo spermatozoo e la zona pellucida è provata dalla
presenza di due livelli di riconoscimento operati da due componenti diverse della zona
pellucida e precedenti il legame finale con la membrana plasmatica dell’oocita,
l’oolemma. La specificità di questo riconoscimento è dovuto anche alla struttura
fibrillare della zona pellucida: i filamenti principali sono composti da unità ripetute di
ZP2 e ZP3 e sono legati tra loro da monomeri di ZP1, formando così una struttura
reticolare.
34
Figura 7. Disegno della struttura fibrillare della zona pellucida. Immagine della
zona pellucida al MES.
Gli spermatozoi si avvicinano parallelamente alla superficie ovulare e vengono poi
trattenuti a livello della zona pellucida dal legame di una serie di proteine dello
spermatozoo capaci di riconoscere la regione oligosaccaridica della glicoproteina ZP3
(Florman e Wassarman, 1985). Sembra che i carboidrati della glicoproteina ZP3 si
leghino ad almeno tre proteine specifiche presenti sulla membrana cellulare dello
spermatozoo, infatti se anche una sola di queste proteine viene sperimentalmente
inattivata, lo spermatozoo non può aderire alla zona pellucida.
La prima di queste proteine lega specificamente i residui di galattosio di ZP3, tanto che
Bleil e Wassarman (1980) hanno dimostrato che se questo residuo viene alterato, la
capacità di legare lo spermatozoo viene persa.
L’enzima N-acetilglucosamina-galattosiltransferasi, esposto subito al di sopra
dell’acrosoma, riconosce poi lo zucchero N-acetilglucosamina su ZP3 e catalizza su
esso l’aggiunta di un residuo di galattosio da una molecola di UDP-galattosio. Agendo
proprio su questo meccanismo il legame tra gli spermatozoi e la zona pellucida può
essere bloccato da:
35
1. Aggiunta di UDP-galattosio;
2. Rimozione dei residui di N-acetilglucosamina da ZP3;
3. Aggiunta di anticorpi che bloccano l’attività della glicosiltransferasi;
4. Aggiunta di un eccesso di glicosiltranferasi nel terreno di coltura.
Una terza proteina dello spermatozoo che si lega alla zona pellucida è una proteina
transmembrana con un residuo extracellulare specifico per ZP3 ed un sito intracellulare
ad attività tirosinchinasica che viene attivato in seguito all’interazione con ZP3. Infine,
altre proteine dello spermatozoo che potrebbero legare la ZP3 sono le zonadesine
(Herlyn e Zischelr, 2008).
Il legame dello spermatozoo con la ZP3 innesca la reazione acrosomiale attivando una
proteina G che, mediante una via di trasduzione dipendente da una fosfolipasi C,
stimola in minima parte la liberazione di Ca2+ dall’acrosoma; questo lieve aumento di
Ca2+ citoplasmatico agisce attivando i canali al Ca2+ Ca2+-dipendenti presenti sulla
membrana plasmatica dello spermatozoo che portano ad un enorme aumento di Ca2+
nella cellula. È proprio questa abbondante presenza di ioni Ca2+ a garantire il corretto
adempimento della reazione acrosomiale; tuttavia, è stato dimostrato che essa può
dipendere anche dalla presenza di prostaglandine e di differenti molecole che si trovano
nelle tube, come il progesterone [10].
Nei Mammiferi la reazione acrosomiale avviene per deiscenza: la membrana
acrosomiale esterna si fonde in più punti con la membrana plasmatica contenente i siti
di legame per ZP3 e nei punti di fusione si formano dei pori attraverso cui gli enzimi
acrosomiali possono essere rilasciati, contemporaneamente la membrana acrosomiale
esterna e la membrana plasmatica, formando delle vescicole ibride, si staccano e nella
regione posteriore dell’acrosoma la membrana esterna rimasta si fonde con la
membrana plasmatica dello speramatozoo [10].
Gli enzimi acrosomiali rilasciati, in parte ancora sconosciuti, sono diversi e agiscono a
optimum di pH differenti. Oltre alla ialuronidasi e agli enzimi della corona radiata, si
distinguono:
Acrosina. È Ca2+-dipendente e deriva dalla forma inattiva proacrosina, svolge la
sua azione proteolitica sulla zona pellucida.
Spermina. È la forma attiva dello sperminogeno ed ha azione simile all’acrosina.
Fosfatasi acida e fosfatasi alcalina.
36
Fosfolipasi A2 e fosfolipasi C.
Collagenasi.
Figura 13. Reazione acrosomiale.
Figura 8. Contatto tra lo spermatozoo e la zona pellucida nell’uomo.
Al termine della reazione acrosomiale la parte anteriore della membrana plasmatica
dello spermatozoo, contenente la glicoproteina ZP3, si è distaccata attraverso il
meccanismo di deiscenza quindi lo spermatozoo rimane adeso alla zona pellucida
instaurando un legame secondario tra le proteine della membrana acrosomiale interna e
la glicoproteina ZP2 della zona pellucida; questo legame risulta più specifico del
precedente tanto che spermatozoi che non hanno sviluppato la reazione acrosomiale, e
quindi presentano ancora l’acrosoma intatto, non possono legarsi alla ZP2. È necessario
37
precisare che non sono del tutto note le proteine dello spermatozoo che legano ZP2, nel
maiale il legame secondario è mediato dall’acrosina mentre nelle cavie si pensa che
questo legame dipenda dalla proteina PH-20; nell’uomo l’analogo della proteina PH-20
non è stato ancora individuato anche se è stato notato che alcuni antigeni dello
spermatozoo mostrano una distribuzione simile.
Il riconoscimento dello spermatozoo da parte della ZP2 è seguito dalla lisi della regione
della zona pellucida in cui si trova la testa dello spermatozoo e permette alla fine il
contatto tra le membrane cellulari dei due gameti. La fusione è un processo attivo
mediato da proteine specifiche presenti in una regione precisa della membrana dello
spermatozoo, detta segmento equatoriale, posto ai lati della membrana posteriore
dell’acrosoma; il contatto tra i recettori presenti nel segmento equatoriale ed i recettori
presenti a livello dei microvilli dell’oolemma, tra cui è stato identificata la proteina
CD9, è perciò tangenziale e determina l’estroflessione di un braccio citoplasmatico da
parte dell’oocita che avvolge lo spermatozoo e lo trascina al suo interno.
L’ingresso dello spermatozoo nel citoplasma ovulare provoca la liberazione degli ioni
Ca2+ immagazzinati all’interno del reticolo endoplasmatico liscio dell’oocita. Questo
evento è responsabile dell’attivazione dell’uovo che si realizza in meno di un’ora
dall’ingresso dello spermatozoo mediante differenti processi.
Il primo meccanismo ad essere portato a termine è definito reazione della zona pellucida
e consiste nell’esocitosi di differenti molecole da parte dei granuli corticali, delle
vescicole localizzate proprio nella regione corticale dell’oocita. Il meccanismo alla base
di questa reazione è Ca2+-dipendente ed è simile a quello che porta alla reazione
acrosomiale: l’attivazione di una fosfolipasi C induce la liberazione di Ca2+ dalle riserve
citoplasmatiche e l’ingente aumento di questo ione all’interno della cellula innesca la
fusione dei granuli corticali con la membrana plasmatica dell’uovo portando alla
liberazione del loro contenuto. La liberazione di Ca2+ dai siti di immagazzinamento e la
conseguente esocitosi dei granuli corticali comincia nel punto di penetrazione dello
spermatozoo e si propaga poi come un’onda per tutta la superficie ovulare fino al polo
opposto [10].
Lo scopo principale di questa reazione è quello di impedire l’ingresso di altri
spermatozoi nell’oocita, cioè di prevenire la polispermia attraverso la modificazione e la
38
scissione dei legami tra i componenti glicoproteici della zona pellucida e i microvilli
dell’oolemma, in particolare:
L’enzima N-acetilglucosaminidasi rimuove i residui glicidici terminali di ZP3
portando così al distacco degli spermatozoi ancora legati ad essi e impedendo il
legame di altri.
Una proteasi elimina ZP2 dalla zona pellucida garantendone l’impossibilità a
legare altri spermatozoi.
L’aumento di Ca2+ intracellulare porta in un secondo momento all’attivazione
dell’enzima NAD+ chinasi il quale innesca tutta una serie di reazioni tardive, quali:
Biosintesi dei fosfolipidi necessari alla sintesi delle membrane cellulari.
Aumento del metabolismo cellulare.
Immediata attivazione del genoma per la produzione degli mRNA necessari alla
sintesi proteica dell’embrione.
La penetrazione dello spermatozoo nell’oocita induce il completamento della meiosi di
quest’ultimo con l’espulsione del secondo corpuscolo polare, infatti al momento
dell’ovulazione il gamete femminile è bloccato allo stadio di oocita secondario perché
fermo alla metafase II; ciò consente all’uovo di dimezzare il suo corredo cromosomico e
di ottenere quindi un nucleo aploide, mantenendo però il suo contenuto citoplasmatico.
Al termine del processo meiotico i cromosomi ovulari vanno incontro a
decondensazione originando così il pronucleo femminile.
Anche lo spermatozoo subisce delle modificazioni, infatti nel citoplasma ovulare esso
stacca la testa liberando il centriolo prossimale che poi servirà per la prima divisione
mitotica dello zigote. Mentre la coda permane nella regione corticale della cellula-uovo
ed è in seguito degradata, il nucleo viene invece trasportato verso il centro della cellulauovo e la cromatina al suo interno viene decondensata in quanto le protamine, che
legano fortemente il DNA spermatico, vengono sostituite nuovamente dagli istoni; si
forma così il pronucleo maschile.
Successivamente i pronuclei si avvicinano e ognuno di loro replica il proprio DNA
prima di entrare nella profase della prima divisione mitotica. Tuttavia, quando entrano
in contatto i due involucri nucleari non si fondono per formare un unico nucleo diploide
bensì si frammentano mentre i cromosomi di entrambi i pronuclei si condensano e si
39
dispongono nella regione equatoriale sulla piastra metafasica; avviene così il
mescolamento dei cromosomi materni e paterni e la segregazione casuale di questi nelle
prime due cellule del nuovo organismo. Nell’uomo, infatti il primo nucleo diploide
dell’embrione si individua non nello zigote ma allo stadio di due cellule.
Figura 16. Fecondazione. Eventi che portano alla fusione del materiale genetico
paterno e materno nella prima metafase mitotica del nuovo organismo.
Per molto tempo si è pensato che i due pronuclei, maschile e femminile, fossero
equivalenti, in realtà però si è scoperto che i genomi derivanti dallo spermatozoo e dalla
cellula-uovo sono funzionalmente differenti e ricoprono ruoli complementari durante
alcune fasi dello sviluppo. Tali differenze funzionali dipendono dalla diversa
metilazione degli alleli sui residui di citosina che comporta l’attivazione e/o
l’inattivazione di alleli diversi nei due genomi durante il differenziamento delle cellule
germinali. Questo processo prende il nome di imprinting e permane fino all’inizio dello
40
sviluppo embrionale, si interrompe nel corso dello sviluppo e viene riattivato
nuovamente durante il differenziamento dei nuovi gameti, alla pubertà. Poiché in
seguito al processo di imprinting alcuni geni importanti per lo sviluppo sono attivi solo
se provengono dallo spermatozoo mentre altri geni simili sono attivi soltanto se
provengono dalla cellula-uovo, si può concludere che per un corretto sviluppo
dell’embrione e degli annessi embrionali sono necessari entrambi i pronuclei in quanto
ognuno dei due presenta uno specifico ruolo durante la fecondazione che non può essere
sostituito dall’altro pronucleo [10].
A questo punto ha inizio la prima fase dello sviluppo embrionale, la segmentazione, che
dà origine all’organismo pluricellulare e precede l’organogenesi. La segmentazione
continua lungo la tuba, l’embrione raggiunge la mucosa uterina, allo stadio di
blastocisti, e qui si libera della zona pellucida. A partire dal settimo giorno di sviluppo
comincia ad annidarsi nello spessore della mucosa uterina.
41
Infertilità
L’infertilità è definita dall’Organizzazione Mondiale della Sanità (OMS) come
l’incapacità di concepire dopo 12/24 mesi di rapporti mirati e non protetti. Si distingue
un’infertilità primaria quando la coppia non ha mai avuto gravidanze ed un’infertilità
secondaria se già sono presenti dei figli; con il termine subfertilità ci si riferisce invece
ad un indice di fecondità ridotta di 3 o 4 volte rispetto alla norma, in questo caso le
coppie dovranno attendere più tempo prima di concepire.
È necessario inoltre definire con precisione i termini di infertilità e sterilità anche se essi
vengono comunemente utilizzati come sinonimi. Si parla di infertilità quando la
gravidanza non viene portata a termine, in questo caso si può intervenire con diagnosi
precoce, cure farmacologiche e terapie adeguate oppure può essere necessario ricorrere
alla procreazione medicalmente assistita (PMA). La sterilità invece, è una condizione
fisica permanente dovuta, ad una patologia irreversibile; in questo caso l’unica terapia
possibile è l’applicazione di tecniche di PMA più sofisticate [11].
L’infertilità è una condizione che coinvolge il 15-20% delle coppie in Europa; a livello
mondiale si stima la presenza di 60-80 milioni di coppie sterili. In Italia, l’Istituto
Superiore di Sanità (ISS) stima che circa il 30% delle coppie ha problemi di infertilità.
Valutando questi dati bisogna però tenere presente che il tasso di infertilità di una
popolazione può essere calcolato in modo diretto o indiretto. Il tasso indiretto di
infertilità tiene conto di tutte le coppie in età fertile che non hanno avuto figli, in questo
caso tuttavia si rischia di sovrastimare i dati perché l’assenza di un figlio può derivare
dalla scelta di una coppia e non necessariamente da un problema di infertilità. Il tasso
diretto di infertilità è certamente più affidabile in quanto si riferisce ai dati raccolti
durante indagini demografiche specifiche condotte sull’intera popolazione o più spesso,
sulle coppie che si rivolgono ai centri per la cura della sterilità [12].
L’infertilità può riguardare sia l’uomo sia la donna sia la coppia. I dati forniti dal
Registro Nazionale sulla Procreazione Medicalmente Assistita suggeriscono che, negli
ultimi anni, le percentuali di infertilità maschile e femminile sono quasi sovrapponibili,
infatti l’infertilità maschile si attesta al 35,4%, l’infertilità femminile raggiunge il 35,5%
e l’infertilità di coppia è pari al 15%. Bisogna comunque ricordare che il 13,2% dei casi
di infertilità è definita idiopatica, cioè inspiegabile.
42
Vari fattori influenzano la condizione di fertilità sia nell’uomo sia nella donna:
Frequenza coitale. Avere dei rapporti due/tre volte la settimana con
un’astinenza di due/quattro giorni tra i due rapporti può garantire una migliore
qualità del liquido seminale e consente di coprire il periodo fertile della donna,
infatti l’oocita può essere fecondato solamente nelle 24 ore successive
all’ovulazione anche se lo spermatozoo riesce a sopravvivere nella vie genitali
femminili fino a sei giorni circa [11].
Età. La fertilità diminuisce con l’età in entrambi i sessi e tale riduzione è più
significativa dopo i 35 anni; soprattutto per la donna l’età può essere
considerata un marker indipendente della riserva ovarica e della qualità degli
ovociti [11].
Uso di farmaci e droghe. Alcuni farmaci possono influenzare il numero degli
spermatozoi mentre altri possono presentare azione teratogena [12].
Alcol. L’assunzione di alcol (da uno a cinque drink a settimana) può ridurre la
percentuale di concepimento agendo attraverso il blocco dell’ovulazione e la
diminuzione del numero e della motilità degli spermatozoi [12].
Peso. Il sovrappeso e il sottopeso possono influire negativamente sulla fertilità
di entrambi i sessi, infatti dati epidemiologici suggeriscono che l’obesità e
l’eccessiva magrezza sono causa entrambe di circa il 6% dell’infertilità primaria
e del 12% dell’infertilità totale [12]. Ciò indica che nella maggior parte dei casi
(il 70%) è sufficiente recuperare il proprio peso-forma per risolvere i problemi
di infertilità. La scorretta alimentazione può comportare un’ovulazione
insufficiente ad assicurare una gravidanza e può influenzare anche la
gestazione, contribuendo all’insorgenza di gestosi e diabete gestazionale.
Inoltre, le donne in sovrappeso incorrono anche in un maggiore rischio di aborti
spontanei o malformazioni. D’altra parte, l’obesità maschile causa l’aumento
della produzione di estrogeni e di conseguenza, una riduzione della produzione
e della motilità degli spermatozoi.
Fumo. Il fumo, sia attivo che passivo, riduce fortemente la fertilità perché
induce nel sangue l’aumento di cadmio, metallo che ostacola l’assorbimento
dello zinco, necessario per la corretta produzione del liquido seminale [12].
43
Infertilità maschile
Circa il 35,4% dei casi di infertilità è dovuta a cause maschili [12]. L’infertilità maschile
è una condizione multifattoriale che, in base all’origine eziologica, può essere suddivisa
in due categorie principali [11]:
1.
Sterilità secretoria. Dipende da alterazioni nella produzione degli spermatozoi;
può presentare differenti cause:
Anomalie cromosomiche/geniche. I difetti genetici che possono causare
infertilità comprendono sia le aneuploidie, cioè le alterazioni del numero dei
cromosomi, sia i difetti strutturali, come traslocazioni, inversioni, duplicazioni e
delezioni; esempi molto significativi sono la mutazione a carico del gene
regolatore della fibrosi cistica (Cystic Fibrosis Transmembrane Conductance,
CFTR) e le microdelezioni nel locus DAZ del cromosoma Y che possono
provocare un’agenesia congenita bilaterale dei dotti deferenti e della vescicole
seminali [1]. Tra le aneuploidie la sindrome di Klinefelter rappresenta la causa
più frequente di ipogonadismo maschile, infatti si presenta in una percentuale di
0,15-0,2% di soggetti, equivalente a circa uno su 700 nati vivi. Si tratta della
trisomia XXY dovuta, nella maggior parte dei casi, alla non disgiunzione di uno
dei cromosomi X dell’oocita e comporta, come principali conseguenze, la
riduzione della produzione di testosterone e l’azoospermia. La patologia può
presentarsi, comunque, in diverse forme mosaicistiche, perciò le sue
manifestazioni variano proporzionalmente al danno testicolare; i sintomi più
comuni sono rappresentati da disarmonie scheletriche, riduzione di peli pubici e
corporei, rallentamento della crescita della barba e della forza muscolare,
ginecomastia e riduzione della libido e della potenza sessuale. La sindrome di
Klinefelter è una disgenesia, cioè rappresenta una condizione di intersessualità
in cui esiste sempre un conflitto tra sesso cromosomico, gonadico e fenotipico, a
livello dell’apparato genitale interno o esterno o di ambedue. Si distinguono,
infine, anomalie minori che emergono solitamente quando i sistemi di
riparazione del DNA delle cellule germinali non sono in grado di correggere le
alterazioni [14] e ciò può verificarsi in seguito a danni ossidativi, dovuti a loro
44
volta a diversi fattori legati al testicolo, al tratto genitale o alle condizioni
ambientali.
Criptorchidismo. Rappresenta una delle anomalie più frequenti dell’apparato
urogenitale maschile e viene definito come la mancata discesa di uno
(criptorchidismo monolaterale, lievemente più frequente sul lato destro) o di
entrambi i testicoli (criptorchidismo bilaterale) nella borsa scrotale. Il testicolo
colpito dalla disfunzione è trattenuto in un punto qualsiasi del tragitto che
normalmente esso compie durante lo sviluppo embrionale, attraverso il canale
inguinale, dalla parte inferiore del rene allo scroto ma in circa la metà dei
bambini criptorchidi esso discende spontaneamente nello scroto entro il primo
anno di vita. I testicoli colpiti da criptorchidismo si distinguono in base alla loro
posizione nella via inguinale (addominale alta e bassa, inguinale, soprascrotale e
scrotale alta), perciò si riconoscono testicoli retrattili, ritenuti ed ectopici. La
presenza di criptorchidismo aumenta il rischio di sviluppare un tumore del
testicolo di circa 10-20 volte. Ciò dipende principalmente dall’aumento della
temperatura del testicolo, la quale causa la differenziazione di cellule germinali
anomale e l’alterazione della sintesi endocrina [15].
Il criptorchidismo è presente nella manifestazione clinica di numerose patologie
con anomalie cromosomiche ma anche in altre con eziologia non cromosomica.
In genere si tratta di sindromi rare e piuttosto gravi tra le quali si ascrivono le
uropatie malformative, le sindromi malformative complesse conseguenti a
deficit ormonali per alterazioni dell’asse ipotalamo-ipofisi-gonade e l’alterata
sintesi di androgeni [16]; frequente è infine l’associazione tra il criptorchidismo
e le anomalie dei cromosomi sessuali come le sindromi di Klinefelter, di Noonan
e di Kallmann, oppure degli autosomi come la sindrome di Prader-Willy e le
trisomie dei cromosomi 13, 18 e 21 [17].
Varicocele. Tra le principali cause di infertilità maschile, colpisce circa il 1720% degli italiani soprattutto nella fascia d’età tra i 25 e i 35 anni [18], il
varicocele è la dilatazione varicosa delle vene testicolari e si presenta
prevalentemente a sinistra a causa del percorso delle vene stesse. La
fisiopatologia del processo è ancora incerta, infatti è difficile identificare il
45
fattore dominante e si pensa che molte cause diverse contribuiscano a causare il
fenotipo infertile tipico di questa patologia:
Ipertermia. La temperatura scrotale è solitamente mantenuta pochi gradi
al di sotto della temperatura corporea in modo tale da ottimizzare
l’ambiente idoneo alle normali funzioni testicolari. L’aumento della
pressione venosa testicolare potrebbe comportare l’inefficienza del
sistema e alterare la funzione del testicolo controlaterale poiché esiste un
drenaggio collaterale fra i due testicoli [19];
Pressione venosa. L’aumento della pressione venosa influenza i capillari
testicolari provocando lo squilibrio della pressione intracapillare e, di
conseguenza, il danneggiamento del metabolismo testicolare [20];
Squilibrio ormonale. Studi di laboratorio effettuati dall’O.M.S. nel 1992
hanno dimostrato che soggetti di età superiore ai trent’anni con
varicocele presentano livelli di testosterone serico più bassi rispetto ai
soggetti under trenta [21]; questa differenza non è stata però riscontrata
nei soggetti non affetti da varicocele. Tali osservazioni hanno permesso
all’O.M.S. di concludere che la presenza di varicocele comporta la
progressiva alterazione della funzione delle cellule di Leydig. Ulteriori
studi si stanno ora concentrando sulle conseguenze che potrebbe avere la
presenza di varicocele sulla funzione delle cellule del Sertoli; sembra,
infatti che l’attività di queste componenti subisca una riduzione a causa
delle variazioni dei livelli di inibina B serica [22].
Sostanze tossiche. Parecchi studi hanno rivelato che diverse sostanze
endogene ed esogene sono responsabili della fisiopatologia del
varicocele. L’accumulo di metaboliti endogeni nella circolazione renale
e surrenale, provocato dall’aumento del reflusso venoso in uomini affetti
da varicocele, può compromettere la qualità del seme [23]; a questo
riguardo alcuni ricercatori hanno postulato che l’aumento della
concentrazione di catecolamine nel circolo surrenale potrebbe causare la
vasocostrizione testicolare e danneggiare il flusso testicolare di sangue
[24]. Tra le sostanze esogene il fumo di sigaretta influenza
negativamente i parametri seminali [25] mentre l’esposizione e
46
l’accumulo di cadmio nell’organismo compromette la spermatogenesi,
la funzione spermatica e di conseguenza, il potenziale riproduttivo. È
stata riscontrata tuttavia una suscettibilità genetica al danno testicolare
derivante dall’esposizione al cadmio, infatti alcuni esperimenti
suggeriscono che la differente espressione della proteina trasportatrice
del zinco ZIP 8 nel topo potrebbe fornire la spiegazione biologica del
perché il varicocele colpisce gli uomini differentemente [26].
Specie reattive dell’ ossigeno (ROS). Sono necessarie per la normale
funzione spermatica in quanto rappresentano un segnale di trasduzione
intracellulare per facilitare la capacitazione degli spermatozoi [27]. In
condizioni fisiologiche esiste un equilibrio fra la produzione e
l’eliminazione
di
queste
molecole,
tuttavia
alcune
condizioni
patologiche possono produrre un eccesso di ROS, i quali causano la
perossidazione dei lipidi di membrana alterando la morfologia e la
vitalità degli spermatozoi. Prove sperimentali mostrano, però, che la
somministrazione di antiossidanti, come il glutatione e la carnitina,
riesce a migliorare i parametri seminali in soggetti che presentano
varicocele suggerendo così l’importanza dei ROS nella fisiopatologia di
questo disturbo [28].
Infezioni genito-urinarie e malattie virali che possono provocare l’orchite. Il 1015% dei casi di infertilità è dovuto a diversi agenti infettivi, batteri
principalmente ma anche virus e miceti, e alle infezioni delle ghiandole
accessorie maschili, le cosiddette M.A.G.I. (Male Accessory Gland Infections).
Gli agenti infettivi riescono a raggiungere gli organi riproduttivi attraverso il
sangue o le lesioni che possono essere presenti nell’uretra e alterano le funzioni
riproduttive in diversi modi: ad esempio essi possono portare ad una attività
anomala delle cellule germinali, delle cellule del Sertoli, delle cellule di Leydig
oppure stimolare l’infiltrazione di leucociti nell’apparato riproduttivo, portando
così ad un’infertilità di tipo autoimmune, nei casi più gravi, inoltre, possono
causare l’ostruzione parziale o totale dei dotti escretori. In base alla sede
dell’infezione, alla porzione di tessuto che viene distrutto e all’alterazione di
funzione subita dall’organo si distinguono infezioni asintomatiche e
47
sintomatiche. Tra le infezioni sintomatiche sono molto diffuse le uretriti e le
epididimiti; le prime provocano i sintomi caratteristici dell’infiammazione ma
anche perdite e disuria, cioè difficoltà nell’emissione delle urine mentre nel
secondo caso si può avere dolore, arrossamento della cute e tumefazione
dell’epididimo e del testicolo.
Tra i batteri gram-negativi maggiormente responsabili delle infezioni genitourinarie maschili si annoverano Escherichia coli, che causa epididimiti acute e
prostato-vesciculiti croniche, ma anche Ureaplasma Urealiticum e Chlamydia
Trachomatis, responsabili maggiormente di infezioni croniche. Oltre ai batteri
anche i virus possono causare infertilità attraverso diversi meccanismi. Il virus
dell’immunodeficienza umana (HIV) induce fibrosi interstiziale, infiltrazione
linfocitaria che porta a infertilità autoimmune, alterazione del numero delle
cellule di Leydig, diminuzione del numero delle cellule germinali, alterazioni
della spermatogenesi che portano alla produzione di un liquido seminale con
azoospermia e oligozoospermia, cioè di un liquido seminale con una
concentrazione di spermatozoi scarsa o nulla [1]. Anche il virus herpes simplex
di tipo 2 (HSV 2) induce infertilità perché può determinare azoospermia e
oligozoospermia.
Alcune malattie infettive sono causa di infertilità se contratte in età riproduttiva.
In particolare, fonti dell’Istituto Superiore di Sanità (I.S.S.) attestano che nel 2030% dei maschi che contraggono la parotite dopo la pubertà si assiste all’
insorgenza di orchite, una malattia infiammatoria molto dolorosa caratterizzata
dal gonfiore di uno o di entrambi i testicoli. In alcuni casi l’orchite può
evolversi in complicazioni quali la sclerosi dei tubuli seminiferi e l’atrofia del
testicolo. L’orchite rappresenta una complicazione anche di infezioni quali
l’HIV, l’Adenovirus, il virus coxsackie, il virus Epstein-Barr (EBV);
la
varicella, invece, evolve in orchite solo raramente e anche quando si verifica
ciò, l’infezione si risolve in un breve periodo di tempo [29].
Le M.A.G.I sono dovute maggiormente alla diffusione di agenti patogeni, quali
Neisseria gonorrhoeae e Chlamydia trachomatis, nella prostata e nelle
vescichette seminali e possono comportare prostatiti croniche che, causando
modificazioni biochimiche del secreto prostatico come l’aumento del pH e la
48
riduzione di componenti importanti quali zinco, magnesio, acido citrico e
fosfatasi acida, influenzano negativamente la fluidificazione e la viscosità del
plasma seminale, e la motilità degli spermatozoi; un’ulteriore conseguenza di
queste infezioni è
l’aumento dei leucociti nel liquido prostatico, definito
leucocitospermia, e la successiva riduzione della motilità e, quindi, della
capacità fecondante del liquido seminale.
Ipogonadismo endocrino. L’alterazione della precisa coordinazione tra gli
elementi
costituenti
dell’asse
ipotalamo-ipofisi-testicolare
può
portare
all’infertilità a causa della ridotta produzione di spermatozoi, soprattutto nel
caso in cui l’ipofisi non possa secernere le gonadotropine in quantità sufficiente.
Questo deficit ormonale viene identificato con il termine ipogonadismo ed è
distinto in tre tipologie:
Nell’ipogonadismo primitivo, o ipergonadotropo, la funzionalità delle
cellule di Leydig è compromessa e ciò può danneggiare la produzione
di testosterone o alterare i tubuli seminiferi provocando oligospermia o
azoospermia e aumento delle gonadotropine.
Nell’ipogonadismo
secondario,
o
ipogonadotropo,
e
terziario,
rispettivamente i danni all’ipofisi e all’ipotalamo causano una minore
secrezione di gonadotropine che non è sufficiente a stimolare
adeguatamente i testicoli, di conseguenza la produzione di spermatozoi
sarà scadente provocando così impotenza e sterilità.
Nel caso in cui ci sia resistenza agli androgeni, la risposta alla
stimolazione ormonale risulta inadeguata.
L’indagine clinica si svolge a tre livelli: innanzitutto si deve considerare se i
livelli di testosterone del paziente risultano alterati, poi bisogna ricercare
l’eziologia dell’anormalità eventualmente presente e infine è necessario definire
una terapia ormonale che possa modificare lo stato di infertilità [30]. Il dosaggio
plasmatico di FSH (ormone follicolo-stimolante) è il parametro più importante e
significativo per valutare la funzione tubulare, poiché proprio il rilascio di
quest’ormone da parte dell’ipofisi stimola nell’ uomo la produzione di
spermatozoi; tuttavia anche i dosaggi di altri ormoni, come LH (ormone
luteinizzante), testosterone e prolattina possono essere utili nella diagnosi di
49
ipogonadismo, in particolare i livelli plasmatici di FSH e LH consentono di
distinguere l’ipogonadismo ipergonadotropo da quello ipogonadotropo.
Cancro testicolare. Secondo l’AIRC (Associazione Italiana per la Ricerca sul
Cancro) i tumori al testicolo rappresentano circa l’1% di tutti i tumori maschili e
il 30% dei tumori dell’uomo giovane [31]. Questo, come altri tumori, può
compromettere la qualità del liquido seminale anche prima dell’inizio di
qualsiasi trattamento, ad esempio si stima che il 40% degli uomini con linfoma
di Hodgkin e il 50% dei soggetti colpiti da cancro testicolare producono una
quantità molto bassa di spermatozoi.
I trattamenti, come la chemioterapia e la radioterapia, alterano la funzione
riproduttiva direttamente causando dei danni ai testicoli oppure indirettamente
danneggiando l’attività dell’asse ipotalamo-pituitario [32], infatti si stima che
soggetti sottoposti a trattamenti per la cura del cancro presentino una probabilità
dimezzata rispetto ai loro fratelli di ottenere una gravidanza e che meno del
20% di essi osservi un miglioramento a livello della spermatogenesi da 37 a 48
mesi dopo il trattamento [33]. L’infertilità permanente, dopo una terapia per il
cancro, è dovuta alla perdita delle cellule staminali: l’epitelio germinale è molto
sensibile alle radiazioni e alle sostanze chemioterapiche, soprattutto agli agenti
alchilanti, come la procarbazina e la vinblastina, che causano un danno diretto
al DNA e all’RNA inducendo l’apoptosi [34]. Anche le cellule di Leydig
sembrano essere abbastanza sensibili alla maggior parte dei regimi
chemioterapici [35].
In caso di radioterapia l’area del corpo sottoposta alle radiazioni viene stabilita
in base alla tipologia e alla dimensione del cancro: il danno primario ai testicoli
si ha quando la radioterapia è mirata ai testicoli o ad aree vicine poiché gli
spermatogoni risultano essere molto sensibili agli effetti delle radiazioni e anche
dosaggi bassi possono causare danni irreversibili, il danno secondario, detto
fallimento testicolare, invece può sopraggiungere quando il bersaglio della
radioterapia è il cervello, dato che ciò può determinare delle lesioni a livello
ipofisario e, di conseguenza, compromettere il rilascio degli ormoni per la
funzione riproduttiva.
50
Anomalie morfologiche degli spermatozoi. Nella maggior parte degli individui
la spermatogenesi dà origine ad una certa percentuale di spermatozoi
caratterizzati da diversi tipi di anomalie. Il range di percentuale di spermatozoi
normali sia in uomini fertili sia in uomini infertili infatti, è probabilmente
compreso tra 0 e 30% e solamente in pochi questa percentuale supera il 25%
(Menkveld et al., 2001).
Le anomalie dei gameti maschili possono essere complessivamente suddivise in
tre principali categorie:
Anomalie della testa. Tra queste sono importanti la sindrome dello
spermatozoo decapitato, che ha origine genetica e provoca il distacco
della testa dal collo ad un certo punto della maturazione spermatica, le
patologie del nucleo, dovute ad anomalie chimiche che alterano il
legame tra DNA spermatico e protamine causando l’incompleta
condensazione della cromatina ma anche le alterazioni della membrana
plasmatica, che portano alla frammentazione degli organuli cellulari
originando un fenomeno conosciuto come “reazione acrosomiale falsa o
degenerativa”. Infine, tra le anomalie della testa un posto di rilievo è
occupato dalle patologie acrosomiali le quali comportano la mancanza
della fase di capacitazione nelle vie genitali femminili e quindi rendono
gli spermatozoi incapaci di fecondare l’oocita: ad esempio, l’ipoplasia
dell’acrosoma causa lo sviluppo difettoso della vescicola, l’agenesia
dell’acrosoma ne impedisce del tutto lo sviluppo mentre in altri casi
l’acrosoma può presentare delle inclusioni polimorfe che lo rendono
disomogeneo.
Anomalie del collo. Coinvolgono tutte le alterazioni che colpiscono il
tratto intermedio del flagello. Tra queste, la sindrome di Kartagen è una
patologia genetica indotta da una mutazione a livello del gene
codificante per la dineina che la rende non funzionante. La dineina è la
proteina fondamentale per l’attività delle ciglia e dei flagelli in quanto,
metabolizzando l’ATP, fornisce l’energia necessaria al movimento;
negli uomini affetti da tale patologia gli spermatozoi risultano, perciò
immobili e incapaci di raggiungere il gamete femmine. Altri difetti
51
possono riguardare i mitocondri organizzati a formare la spira
mitocondriale dell’assonema e/o l’assenza dell’intero tratto intermedio.
Anomalie della coda. Si possono osservare spermatozoi in cui la coda è
spezzata o avvolta attorno alla testa, altri invece possono presentare più
code.
2. Sterilità escretoria. È secondaria ad ostruzioni delle vie d’escrezione e non è
associata ad anomalie testicolari o anomalie ormonali. Può avere origine
differente e viene generalmente indicata con il termine disfunzione. La
disfunzione comprende una serie di problemi fisici o psicologici che comportano
alterazioni dell’erezione o della frequenza dei rapporti sessuali sufficiente a
impedire il deposito del liquido seminale all’ interno della vagina e
rappresentano circa l’1% delle cause di infertilità maschile (Fertility Problems
clinics, Western General Hospital, Edimburgh). Essi dipendono dalla presenza di
anomalie congenite, quali il micropene, l’ipospadia e l’epispadia; questi ultimi
sono caratterizzati dallo sbocco dell’uretra rispettivamente sulla faccia inferiore
e superiore del pene anziché all’estremità come di norma e comportano
difficoltà nell’emissione degli spermatozoi. Le disfunzioni di emissione degli
spermatozoi sono anche acquisite, come nel caso della cicatrizzazione del
frenulo, di traumi o della fimosi, la quale comporta un’eccessiva ristrettezza
dello sbocco del prepuzio.
Inoltre, la presenza di disfunzioni può influenzare l’eiaculazione o l’erezione. Le
anomalie legate all’eiaculazione comprendono l’aneiaculazione, l’eiaculazione
retrograda e altri disturbi psicologici o fisici che possono portare alla liberazione
degli spermatozoi fuori dalla vagina. L’aneiaculazione è un disturbo raro
caratterizzato dall’impossibilità patologica di eiaculare talvolta associata a
problemi a livello del midollo spinale. Più frequente è l’eiaculazione retrograda
che può essere congenita oppure acquisita in seguito a una frattura del bacino o a
un intervento di chirurgia urologica. I difetti erettivi possono dipendere, invece,
da fattori anatomo-fisiologici, come un’insufficienza nello sviluppo del pene o
nella rigidità di erezione oppure una deformità dell’erezione che potrebbe
52
impedire la penetrazione; in molti altri casi le disfunzioni erettili sono
secondarie a problemi psicogeni, a patologie o a stili di vita errati [1,36].
Come l’infertilità femminile anche quella maschile è fortemente influenzata dallo stile
di vita dell’individuo.
Innanzitutto, l’alimentazione eccessiva aumenta il rischio di patologie infiammatorie
prostatiche croniche, molto frequenti negli uomini infertili, inoltre l’obesità o il
sovrappeso riducono notevolmente il numero di spermatozoi che giungono a
maturazione e mostrano un effetto indiretto sulla funzione erettile di uomini con diabete
o ipertensione (American Society for Reproductive Medicine).
Il fumo di sigaretta (più di 10 sigarette al giorno, Mahmoud et al., 1998) induce un
danno diretto e progressivo alla spermatogenesi, quindi riduce la concentrazione di
gameti maschili nel liquido seminale, ma anche la loro motilità, vitalità e morfologia;
tali alterazioni risultano direttamente proporzionali al numero di sigarette fumate fino a
raggiungere il 22% nei forti fumatori [12]. In aggiunta il benzopirene contenuto nel
fumo di sigaretta può provocare alterazioni a livello del genoma spermatico impedendo
così il corretto sviluppo dello zigote; è stato dimostrato ampiamente infatti, che anche
nelle coppie in cui solo il partner maschile è un fumatore, si osserva una forte riduzione
del numero dei concepimenti ed un aumento degli aborti spontanei. Tuttavia, smettere di
fumare può aiutare a recuperare la concentrazione e la motilità degli spermatozoi.
Pure l’alcol (più di sei unità al giorno) può agire direttamente sulla qualità della
spermatogenesi e/o sulla elevata produzione di specie reattive dell’ossigeno (ROS) ad
azione mutagena [1].
L’assunzione di steroidi androgeni anabolizzanti (AAS), derivati del testosterone, può
interagire con il processo di regolazione dell’asse ipotalamo-ipofisi-testicolo inducendo
l’inibizione della sintesi di testosterone che manifesta i suoi effetti sulla spermatogenesi,
provocando azoospermia e sui caratteri sessuali secondari, causando crescita del seno,
voce “bianca”, atrofia testicolare, ecc. Gli steroidi anabolizzanti sono pericolosi per la
salute in generale, infatti possono determinare patologie a carico del fegato,
dell’apparato cardiovascolare e di tipo psichiatrico tuttavia, sebbene i loro effetti siano
persistenti, l’interruzione della loro assunzione può condurre in parte al recupero della
fertilità.
53
Un altro fattore di rischio per l’infertilità maschile, negli ultimi anni in aumento, è
l’esposizione a sostanze tossiche come i metalli pesanti, il disolfuro di carbonio o i
benzeni ma anche l’esposizione a un ambiente ad alta temperatura e l’assunzione
involontaria di sostanze ambientali in grado di influenzare l’equilibrio ormonale, come
gli xeno-estrogeni e gli anti-androgeni, possono agire negativamente sulla
spermatogenesi [1].
Infine, l’abitudine a fare bagni caldi, i vestiti stretti, lo stress elevato e l’uso di droghe
illegali possono essere causa di infertilità maschile. In particolare, tra gli stupefacenti è
molto pericolosa soprattutto l’assunzione di marijuana, oppioidi narcotici, cocaina e
metamfetamine perché provoca effetti avversi sull’asse ipotalamo-pituitaria-testicolare,
sull’attività spermatica e sulla struttura testicolare. In letteratura le prove che
confermano un potenziale impatto negativo delle droghe illegali sulla fertilità maschile
sono limitate, tuttavia diversi studi ben progettati sono tuttora in corso per chiarire
meglio la relazione tra l’assunzione di queste sostanze e il loro effetto sulla fertilità
maschile [37].
Negli uomini l’infertilità idiopatica, o inspiegata, si riscontra nel 25-30% dei casi e
sembra essere in aumento.
54
Ipogonadismo ipo-normogonadotropo
L’ipogonadismo è una condizione patologica caratterizzata dalla riduzione della
funzionalità della gonade in seguito ad un’inadeguata stimolazione ipotalamo-ipofisaria
oppure ad una alterazione della funzionalità dell’apparato genitale. Può colpire individui
di qualsiasi età e induce sintomatologia differente in base all’alterazione patologica e al
momento dell’insorgenza.
L’ipogonadismo secondario, o ipo-normogonadotropo, può dipendere da una carenza
delle gonadotropine ipofisarie, LH e FSH, in seguito ad alterazioni a carico della
ghiandola pituitaria; di conseguenza esso è definito anche ipogonadotropo perché è
caratterizzato da:
Bassi livelli serici di FSH;
Bassi livelli di LH;
Bassi livelli serici di testosterone.
L’ipogonadismo secondario è detto isolato se dipende da un deficit ipotalamico
congenito del fattore di rilascio per le gonadotropine (GnRH) che coincide con la
sindrome di Kallmann. In realtà la patogenesi di questa malattia risulta in gran parte
ancora sconosciuta benché sia stato scoperto il gene responabile; si tratta di KAL-1,
codificante per una proteina di adesione neuronale denominata anosmina. La funzione
dell’anosmina è di consentire ai neuroni ipotalamici secernenti GnRH di aderire ai
neuroni olfattivi a livello della loro comune origine embrionale e di migrare lungo di
essi fino a raggiungere la loro sede definitiva; in presenza di una mutazione a carico del
gene KAL-1, la migrazione dei neuroni neurosecernenti ed olfattivi non avviene e ciò
provoca il duplice difetto di ipogonadismo centrale e di anosmia, cioè di un senso
dell’olfatto assente. La trasmissione della sindrome di Kallmann può essere X-linked o
autosomica, dominante o recessiva, per cui essa viene considerata una patologia
genetica complessa e multifattoriale perché la sua espressione può risentire anche
dell’espressione di altri geni e dell’influenza di fattori ambientali.
Come l’ipogonadismo primario, anche l’ipogonadismo secondario può dipendere da
disordini congeniti oppure da alterazioni acquisite.
55
Le forme congenite si differenziano complessivamente in sindromi eredo-familiari con
ipogonadismo ipogonadotropo costante e in sindromi eredo-familiari con ipogonadismo
ipogonadotropo non costante. Nel primo caso i livelli di FSH e LH risultano
costantemente ridotti; fanno parte di questo gruppo il deficit isolato di LH, o sindrome
dell’eunuco fertile, caratterizzato dallo sviluppo sessuale imperfetto e anche da una
modesta riduzione di FSH, e il panipopituarismo congenito in cui l’intera funzione
adenoipofisaria risulta compromessa e ciò comporta un quadro clinico che, oltre alla
mancata maturità sessuale, causa anche insufficienza surrenalica, ipotiroidismo e
nanismo ipofisario. Anche mutazioni a carico del gene codificante per il recettore del
GnRH o associate alla carenza degli ormoni ipofisari, ad esempio la mutazione a carico
del gene PROP-1 la cui espressione porta alla genesi delle cellule
gonadotrope
dell'ipofisi così come le somatotrope, lattotrope e tireotrope, costituiscono cause
importanti di ipogonadismo primario costante.
Le sindromi eredo-familiari non costanti invece, sono meno gravi perché presentano una
produzione di gonadotropine a momenti normale; tra queste le sindromi di Rud,
Laurence-Moon-Biendl, caratterizzata da ritardo mentale, polidattilia e retinite
pigmentosa, la sindrome di Prader-Willi, caratterizzata da bassa statura, ritardo mentale,
ipotonia alla nascita e obesità e le sindromi di Mobius, Lowe, Leopard, Carpenter.
Infine, tra le forme congenite di ipogonadismo secondario è compreso anche
l’ipogonadismo ipogonadotropo con atassia cerebellare familiare che in genere
esordisce tra la prima infanzia e la quarta decade di vita e si manifesta sia con sintomi
cerebellari (alterazioni cortico-spinali, demenza, neuropatia assonale periferica, sordità)
sia con i sintomi legati all’ipogonadismo.
Le forme acquisite sono legate allo stile di vita e/o a patologie differenti che
intervengono inibendo la produzione di gonadotropine o alterandone la struttura oppure
arrecando danni all’apparato genitale:
Farmaci. La somministrazione per lunghi periodi di farmaci, come oppioidi o
corticosteroidi, può causare ipogonadismo secondario, come anche l’assunzione
di analoghi di GnRH (Lupron), utilizzati per il trattamento del cancro alla
prostata allo stadio avanzato; in questi casi l’ipogonadismo è temporaneo e la
fertilità viene ripristinata al termine della terapia farmacologica.
56
Obesità e condizioni correlate. Il peso eccessivo, l’insulino-resistenza e il
diabete mellito di tipo 2 sono associati a ipogonadismo secondario, infatti è
sufficiente anche soltanto la modifica dello stile di vita, come la perdita di peso e
l’esercizio fisico costante, al fine di ridimensionare questi disturbi e/o prevenirne
l’insorgenza.
In caso di obesità il livello totale di testosterone, la cui sintesi insieme alla
spermatogenesi è l’obiettivo principale dell’azione di FSH e LH, può essere
ridotto anche se il livello di ormone libero, quindi biodisponibile, può risultare
nella norma. Ciò è dovuto principalmente all’effetto dell’iperinsulinemia sul
fegato, che induce la riduzione nella sintesi delle globuline di trasporto degli
ormoni sessuali.
Inoltre, è stato osservato che i livelli serici di testosterone risultano
maggiormente ridotti in individui obesi ed affetti da diabete mellito di tipo 2
piuttosto che in individui solamente obesi.
Dati recenti (Dandona P, Dhindsa S, Chandel A, Chaudhuri A, 2009) mostrano
che l’ipogonadismo ipogonadotropo non è associato con il diabete mellito di tipo
1 e che la bassa concentrazione di testosterone nei pazienti con diabete di tipo 2
è correlata spesso ad alte concentrazioni della proteina C-reattiva, ematocrito
basso, aumento dell’adiposità regionale e totale, bassa densità ossea e
disfunzione erettile.
Età. Molti studi hanno mostrato una riduzione correlata all’età sia nei livelli di
testosterone serico sia nei livelli di testosterone totale; ciò è generalmente
definita andropausa ed risulta più frequente negli uomini over 60.
Ematocromatosi. È una condizione legata all’eccesso di ferro e può comportare
sia ipogonadismo primario sia ipogonadismo secondario, sebbene quest’ultimo
sia molto più comune a causa proprio dell’accumulo di ferro a livello
dell’ipotalamo, dell’ipofisi o dei testicoli.
Iperprolattinemia. In genere cause comuni di iperprolattinemia negli uomini
comprendono
farmaci
(antagonisti
dopaminergici,
antipsicotici,
metoclopramide), adenomi ipofisari, ipotiroidismo, stress, insufficienza renale
cronica, cirrosi epatica, traumi del torace e infezione attiva da Herpes zoster. In
questo caso l’ipogonadismo è dovuto all’effetto diretto che l’eccesso di
57
prolattina svolge sulla secrezione pulsatile di GnRH ipotalamico necessaria per
la corretta secrezione di FSH e LH. Anche altre endocrinopatie, come
acromegalia, la sindrome di Addison (ipocorticosurrenalismo) e la sindrome di
Cushing (ipercoticosurrenalismo), si trovano spesso all’origine di alterazioni a
livello sessuale.
Eccesso di estrogeni. Può essere sia di origine esogena, in seguito all’utilizzo di
contraccettivi e creme contenenti estrogeni, sia di origine endogena, per la
presenza di tumori testicolari.
Abuso di steroidi anabolizzanti. Può provocare ipogonadismo secondario e
atrofia testicolare che possono permanere per anni anche dopo l’interruzione
dell’assunzione di steroidi.
Anoressia nervosa. In questo caso risultano ridotte le concentrazioni seriche di
testosterone e la risposta delle gonadotropine al GnRH, mentre i livelli di sex
hormone binding protein (SHBG) aumentano perché la sua produzione viene
modulata negativamente dall’insulina, ridotta in condizione di malnutrizione. È
stato osservato che la soppressione della sintesi di GnRH è strettamente
dipendente dall’ipoleptinemia, originata dall’anoressia nervosa; la leptina infatti,
stimola la liberazione di GnRH dall’ipotalamo e di LH dall’ipofisi mediante un
meccanismo mediato dall’ossido nitrico (NO). Infine, una recente indagine
suggerisce che anche l’ipergrelinemia possa essere coinvolta nell’ipogonadismo
ad opera dell’anoressia nervosa.
HIV. L’infezione da virus dell’immunodeficienza umana causa ipogonadismo
primario e secondario. Quest’ultimo è presente in pazienti con infezione attiva,
in pazienti con terapia antiretrovirale in corso e persino nei pazienti che
possiedono quantità di linfociti CD 4+ normale.
L’ipogonadismo nei soggetti HIV-positivi è multifattoriale e può essere
correlato a perdita di peso, infezioni opportunistiche dell’ipotalamo, dell’ipofisi
o dei testicoli e farmaci.
Malattie croniche. Patologie croniche, come cirrosi epatica, insufficienza renale
e artrite reumatoide provocano comunemente ipogonadismo in seguito a
disfunzioni a tutti i livelli dell’asse ipotalamo-ipofisi-testicolo. Anche in questo
caso l’eziologia è multifattoriale perché dipende non solo dai disturbi metabolici
58
caratterizzanti queste patologie, ma pure le ricorrenti manifestazioni acute e
l’ospedalizzazione necessaria per le infezioni frequenti di questi pazienti
immunocompromessi.
Alcol. L’alcol può avere effetti avversi a tutti i livelli dell’asse ipotalamo-ipofisitesticolo, risultando in bassi livelli di testosterone serico e spermatogenesi
ridotta.
Ipotiroidismo primario cronico. La condizione di ipogodismo primario può, a
lungo termine, danneggiare l’ipotalamo e l’ipofisi e di conseguenza, alterarne la
funzionalità.
Radiazioni. Tra le cause iatrogene molto importante è l’irradiazione del cranio,
della faringe o della regione oculare e cervicale alta; sembra infatti che
irradiazioni superiori a 8 000-10 000 rad possano provocare danni permanenti
all’ipofisi.
In base all’epoca di comparsa l’ipogonadismo può essere distinto inoltre in
ipogonadismo puberale, se si sviluppa prima della pubertà, e in ipogonadismo postpuberale, se le manifestazioni andrologiche si verificano in età matura; questa
distinzione è dovuta alla presenza di quadri clinici molto diversi.
Quando l’ipogonadismo compare prima della pubertà, le manifestazioni cliniche
coincidono fondamentalmente con uno sviluppo sessuale incompleto o assente che si
evidenziano con:
Organi genitali infantili;
Distribuzione pilifera non corrispondente a quella di un adulto;
Proporzioni scheletriche eunucoidi;
Mancato sviluppo muscolare;
Debole o assente interesse sessuale;
Assenza del cambio del tono di voce.
In questo caso l’infertilità è di norma causata soprattutto dalla mancanza della
spermatogenesi.
59
Figura 17. Manifestazioni cliniche di ipogonadismo ad insorgenza prepuberale.
Se il deficit androgenico avviene in età post puberale, le manifestazioni cliniche sono
più attenuate e consistono in particolare in:
Progressiva riduzione della massa muscolare con astenia;
Riduzione della libido;
Disfunzione erettile;
Riduzione della spermatogenesi;
Difficoltà di concentrazione;
Dimensioni testicolari e prostatiche ridotte;
Aumentato rischio di osteoporosi.
60
Terapia per l’ipogonadismo
È possibile trattare l’ipogonadismo farmacologicamente mediante l’utilizzo di diverse
preparazioni. Nel caso di ipogonadismo primario, o ipergonadotropo la terapia
sostitutiva a base di ormoni non è indicata e non ottiene una risposta adeguata da parte
dell’organismo perché questa condizione dipende da un danno testicolare; tuttavia in
alcuni casi si può ricorrere alla somministrazione di testosterone che permette di
ripristinare i caratteri sessuali secondari e mantenerli, conservare il desiderio e
migliorare l’attività sessuale, prevenire l’atrofia muscolare e l’osteoporosi, così come
migliorare l’umore.
Invece, in caso di ipogonadismo secondario, o ipo-normogonadotropo le cellule del
Sertoli non ricevono lo stimolo necessario al mantenimento della spermatogenesi e la
concentrazione di testosterone intratesticolare non è sufficiente alla conservazione dei
caratteri sessuali. In questo caso il tipo di terapia applicato dipende dal desiderio del
paziente di recuperare un discreto livello di fertilità.
La terapia sostitutiva con testosterone rappresenta il trattamento classico per i maschi
adulti affetti da ipogonadismo ipogonadotropo, soprattutto essa è indicata per gli uomini
che sono già genitori e viene utilizzata principalmente per eliminare i sintomi ed i segni
caratteristici di ipogonadismo ipogonadotropo; infatti, l’assunzione di testosterone,
disponibile in diverse preparazioni farmacologiche (iniezioni per via intramuscolare,
compresse, cerotti e gel), comporta l’aumento della massa e della forza muscolare
nonché della densità ossea, il miglioramento della risposta agli stimoli di natura
sessuale, la diminuzione della massa grassa e conferisce inoltre, un senso di benessere al
paziente.
Nonostante la terapia sostitutiva con testosterone influenzi positivamente gli stimoli di
natura sessuale, essa non è sufficiente da sola a indurre un recupero soddisfacente della
fertilità nell’uomo affetto da ipogonadismo secondario, o ipogonadotropo. Difatti, sono
noti dei pazienti in cui il testosterone è controindicato, come nei soggetti affetti da
cancro alla prostata, disturbi del tratto urinario inferiore o alti livelli di PSA, cancro alla
mammella, sindrome da apnea ostruttiva del sonno (OSAS), insufficienza cardiaca
congestizia e patologia coronarica. Inoltre la terapia continuata con testosterone può
indurre differenti effetti collaterali; tra i disturbi più comuni si individuano l’eritrocitosi,
61
il peggioramento del carcinoma prostatico e delle metastasi, la ginecomastia,
l’induzione o il peggioramento di OSAS, il peggioramento della spermatogenesi ed
edema agli arti inferiori nei pazienti con insufficienza cardiaca.
D’altro canto, per gli uomini che desiderano procreare è necessario ricorrere al
trattamento con gonadotropine o GnRH. In questi casi, il recupero della spermatogenesi
si può ottenere attraverso due percorsi:
1. Nei soggetti con alterazioni a livello ipotalamico è possibile effettuare una
terapia con GnRH pulsatile mediante iniezione sottocutanea a livello della parete
addominale ogni 2 ore, utilizzando una dose di 100-400 ng/Kg. La terapia con
GnRH risulta tuttavia poco diffusa anche a causa dei costi elevati e della scarsa
praticità.
2. In tutti gli altri casi di ipogonadismo secondario e obbligatoriamente nei casi in
cui l’ipogonadismo dipende da lesioni a carico dell’ipofisi od a difetti strutturali
dei recettori per GnRH, si ricorre invece alla somministrazione con
gonadotropine sia urinarie sia ricombinanti. In genere il trattamento inizialmente
prevede l’utilizzo di 1000-2500 Unita Internazionali (UI) di hCG (Human
Chorionic Gonadotropin) sottocutaneo o intramuscolare 2-3 volte a settimana
per 8-12 settimane. Questa fase iniziale è detta fase di induzione ed è
fondamentale perché induce un primo aumento del livello di testosterone. Negli
individui in cui la concentrazione di FSH endogeno è insufficiente è necessario
proseguire la terapia combinando l’hCG con 75-150 UI di FSH tre volte alla
settimana per lo stesso periodo di tempo.
La possibilità di ricorrere alla somministrazione di gonadotropine al fine di recuperare
la fertilità sia maschile sia femminile risale al 1910 quando è stato scoperto che l’ipofisi
possedeva un ruolo fondamentale nella regolazione dello sviluppo gonadico,
successivamente Zondek e Ascheim (1927) hanno dimostrato che le gonadotropine
estratte dal sangue di cavalle gravide (PMSG) e di donne (post mortem dalla ghiandola
pituitaria) induceva una risposta ovarica.
Negli anni ’40 i ricercatori hanno iniziato ad estrarre le gonadotropine dall’urina.
Gonadotropine estratte dall’ipofisi umana e PMSG sono state utilizzate in Europa e
negli USA fino ai primi anni ’60, quando si è scoperto che tali sostanze inducevano la
sintesi di anticorpi anti-ormone capaci di impedire la risposta ovarica con stimolazioni
62
ripetute. Negli anni ’80, in seguito alla comparsa in differenti Paesi di casi di demenza e
morte dovute alla malattia di Creutzfeldt-Jacob iatrogena e legati all’uso di
gonadotropine ipofisarie umane, esse sono state ritirate dal mercato.
I progressi nella tecnologia del DNA hanno poi permesso lo sviluppo di FSH umano
ricombinante, che è stato reso disponibile in commercio a partire dal 1995. Ciò ha
consentito nei decenni successivi un enorme diffusione dei farmaci a base di
gonadotropine: nel 2000 è stato commercializzato l’LH ricombinante e l’anno seguente
anche hCG ricombinante era disponibile. I più recenti sviluppi includono FSH a lunga
azione nel 2010 ed iniettori a penna che consentono di somministrare dosi precise di
FSH, LH e hCG nel 2011.
Figura 18. Tappe fondamentali nella produzione di farmaci contenenti
gonadotropine.
Per comprendere al meglio il meccanismo d’azione delle preparazioni a base di
gonadotropine disponibili in commercio è indispensabile riassumere brevemente le
caratteristiche strutturali e funzionali delle gonadotropine naturali.
FSH, LH e hCG sono delle glicoproteine costituite da due subunità: α, uguale per tutte e
β, specifica per ognuna della tre; a quest’ultima è legata la componente glucidica che
riveste un ruolo molto importante per l’azione dei tre ormoni:
La catena oligosaccaridica di FSH è associata a residui di N-asparagina sia sulla
subunità α sia sulla subunità β. La quantità di oligosaccaridi legati alla
63
molecola, cioè il grado di glicosilazione dell’FSH, è il maggior determinante
per le differenze nelle attività chimico-fisiche e biologiche di questa
gonadotropina e influenza la sua emivita ed acidità. In particolare l’FSH
maschile si presenta iperglicosilato e di conseguenza, possiede un’emivita
significativamente lunga (da 3 a 4 ore) dovuta al ridotto catabolismo epatico,
infatti l’acido sialico impedisce il legame dell’FSH con i recettori degli epatociti
e quindi ne ritarda la degradazione.
LH presenta un singolo sito di N-glicosilazione sulla subunità β e pochissimi
residui di acido sialico, difatti ha una emivita breve (20-30 minuti).
La subunità β di hCG è costituita da una sequenza aminoacidica del tutto simile
a quella di LH ad eccezione della sua estremità C-terminale che contiene quattro
siti di O-glicosilazione e due siti di N-glicosilazione. Proprio grazie all’elevato
grado di glicosilazione e all’abbondanza di acido sialico, l’emivita di hCG è
molto più lunga rispetto a LH (24 ore).
Inoltre, poiché la struttura di LH e hCG è del tutto simile, essi interagiscono con
lo stesso recettore.
I recettori per FSH ed LH sono accoppiati a proteine G e si compongono di sette domini
transmembrana. L’attivazione recettoriale si ha in seguito al legame dell’ormone con la
regione N-terminale esposta sul versante extracellulare e permette la trasmissione del
segnale di trasduzione dal complesso ligando-recettore ai domini trans membrana.
I farmaci contenenti gonadotropine disponibili in commercio sono composti allosterici
che presumibilmente interagiscono con i domini transmembrana anziché con la regione
N-terminale; di conseguenza, il percorso di trasduzione del segnale potrebbe essere
differente da quello indotto dai ligandi nativi.
Le preparazioni utilizzate per il trattamento dell’ipogonadismo ipogonadotropo
maschile oggi presenti sul mercato comprendono:
Menotropina (hMG – human menopausal gonadotropin). La Menotropina è
estratta dall’urina delle donne in menopausa e può essere impiegata sia in caso
di infertilità maschile sia in caso di infertilità femminile. È un farmaco costituito
da FSH ed LH in uguale concentrazione e per questo motivo viene utilizzato
nell’uomo per il trattamento dell’oligozoospermia, cioè la scarsa quantità di
spermatozoi nel liquido seminale, dovuto a ipogonadismo ipogonadotropo.
64
Urofollitropina (FSH urinario). Le preparazioni a base di FSH urinario vengono
prodotte mediante rimozione della molecola di LH ad opera di anticorpi
monoclonali in modo tale da ottenere delle molecole di FSH biologicamente
pure alla fine del processo. Sebbene le prime preparazioni contenevano ancora
elevate concentrazioni di altre proteine urinarie oltre a FSH, gli ultimi progressi
tecnologici hanno favorito l’utilizzo di anticorpi monoclonali altamente specifici
per estrarre e produrre FSH altamente purificato (HP-hFSH). Quest’ultimo è
disponibile in commercio dal 1993 e contiene < 0,1 UI di LH e < 5% di proteine
urinarie. La somministrazione sottocutanea di gonadotropine ha rappresentato un
notevole vantaggio per i pazienti rispetto alla somministrazione intramuscolare
convenzionale grazie alla migliore tollerabilità e alla possibilità di effettuare
l’autosomministrazione.
FSH ricombinante. Viene ottenuto mediante l’utilizzo di un plasmide costituito
da tratti di DNA batterico e dal segmento di DNA contenente i geni che
codificano per le subunità α e β dell’FSH. Sfruttando la replicazione di una
cellula ospite è possibile poi ricavare grandi quantità di FSH: inizialmente la
tecnologia ricombinante si serviva soprattutto di Escherichia coli ma
successivamente, vista la complessa struttura delle gonadotropine umane e la
necessità di glicosilazioni post-traduzionali, che definiscono l’emivita e la
bioattività della molecola, si è preferito produrre tutte le gonadotropine
ricombinanti mediante l’utilizzo di colture cellulari ovariche di criceto cinese
(chinese hamster ovary -CHO-) . Queste cellule sono geneticamente stabili,
totalmente caratterizzate e facilmente transfettabili con DNA esogeno. Tuttavia,
le cellule CHO posseggono un pool di enzimi che differiscono da quelli di tipo
umano in termini di efficienza nella capacità di glicosilazione proteica, pertanto
rec-hFSH derivato da esse presenta un grado di ramificazioni oligosaccaridiche
minore ed un ridotto contenuto di acido sialico.
Sono disponibili due tipi di FSH ricombinante (rec-hFSH) per uso clinico:
1. Follitropina alfa. Viene ottenuta utilizzando due vettori separati, uno per
ogni subunità.
2. Follitropina beta. Si ricava sfruttando un singolo vettore che contiene le
sequenze codificanti per entrambe le subunità.
65
Poiché i processi di produzione e purificazione dei due farmaci sono diversi, essi
differiscono per la quantità di acido sialico contenuto nella componente
oligisaccaridica della molecola e per il coefficiente isoelettrico. Comunque la
follitropina alfa e la follitropina beta possiedono una struttura intrinseca simile
che rende la loro efficacia clinica del tutto uguale, entrambe infatti sono
applicate, in caso di ipogonadismo ipogonadotropo maschile, per stimolare la
sintesi di spermatozoi.
Gonadotropine con attività luteinica. Oltre alla Menotropina, descritta
precedentemente, sono disponibili in commercio due farmaci differenti a base di
LH:
1. Lutropina alfa (rec-hLH). Si compone di LH puro ottenuto mediante
tecnologia ricombinante.
2. Una combinazione di FSH ed LH in un rapporto fisso di 2:1 prodotto
sempre con tecnologia ricombinante.
Coriogonadotropina alfa (rec-hCG). È la gonadotropina corionica umana
prodotta mediante tecnologia ricombinante e presenta struttura e attività
biologica simili a quelle di rec-hLH, infatti si lega allo stesso recettore. Tuttavia,
l’azione di rec-hCG è marcatamente maggiore rispetto a quella di rec-hLH
perché esso ha un’emivita più lunga e una maggiore affinità con il recettore.
Nell’uomo rec-hCG viene somministrato per il trattamento di oligozoospermia e
azoospermia anche in associazione con rec-hFSH.
Prodotto
Origine
Nome
Produttore
commerciale
HMG
Urinaria
Menomo;
Ferring
Repronex
Urinaria
HP-hMG
Urinaria
HP-hFSH
Menopur
Ferring
Merional
IBSA
Fostimon
IBSA
Bravelle
Ferring
66
U-hCG
Urinaria
Choragon
Ferring
Brevactid
Ferring
Choriomon,
IBSA
Gonasi HP
Wyeth-Ayarst
APL
Biomed-Lublin
Biogonadyl
Schering-Plough
Primogonyl
Win-Medicare
Endocorion
Wyeth-Ayerst
Corion
Rec-hFSH
Follitropina beta
Ricombinante Puregon;Follistim Merck Sharp & Dohme
Follitropina alfa
Ricombinante Gonal-f
MerckSerono
Ricombinante Luveris
MerckSerono
Ricombinante Pergoveris
MerckSerono
Rec-hLH
Lutropina alfa
Rec-hFSH + rec-hLH 2:1
Follitropina + lutropina alfa
Rec-hCG
Ricombinante Ovidrel;Ovitrelle; MerckSerono
Ovidrelle
Tabella 1. Le più comuni gonadotropine disponibili per uso clinico.
Le gonadotropine urinarie vengono prodotte in forma liofilizzata e poi ricostituite
utilizzando acqua sterile prima dell’iniezione; ciò consente di ottenere farmaci
caratterizzati da una maggiore attività specifica che quindi riescono a raggiungere
l’effetto desiderato anche essendo somministrati a dosi minori. Tuttavia, anche se
ottenute con tecniche di purificazione estremamente sofisticate, esse possono contenere
più del 30% di proteine urinarie. Tra queste impurità è possibile scoprire anche la
presenza di prioni, associati all’encefalopatia spongiforme trasmissibile (TSE), la cui
inattivazione causa però la denaturazione delle altre proteine presenti, incluso FSH.
Per tale motivo, l’utilizzo di farmaci di origine urinaria è stato ultimamente fortemente
limitato anche perché i farmaci a base di gonadotropine ricombinanti invece sono
continuamente caratterizzati e controllati.
Per quanto riguarda le gonadotropine ricombinanti, anch’esse sono dotate di alta attività
specifica e di conseguenza, vengono iniettate per via sottocutanea in volumi minimi
67
mediante delle siringhe appositamente sviluppate: si tratta di penne pronte all’uso,
compatte e monouso, contenenti dosi di farmaco prefissate che possono essere
somministrate in frazioni per parecchi giorni consentendo così una distribuzione del
farmaco più precisa e dotata di maggiore tollerabilità.
Figura 9. Esempio di iniettore a penna per follitropina beta.
È stato dimostrato che una terapia della durata media di 64 giorni (Misell et al., 2006)
con gonadotropine risulta efficace negli uomini affetti da ipogonadismo iponormogonadotropo, tuttavia il risultato finale del trattamento ormonale varia fortemente
nei diversi pazienti.
In più del 10% dei casi, il paziente sviluppa una risposta spermatica e livelli di
testosterone serici soddisfacenti alla fine del periodo di trattamento tanto che si può
ottenere il concepimento spontaneo entro 6-9 mesi dall’inizio della terapia ma in alcuni
casi ciò avviene anche dopo più di due anni.
In genere, la mancanza di gravidanza spontanea dopo 20 mesi di terapia induce la scelta
di una tecnica di PMA adeguata al caso.
L’inseminazione intrauterina (IUI) può rappresentare una buona opzione per uomini che
dopo la terapia presentano una concentrazione di spermatozoi maggiore di 5 mln/ml ma
non riescono comunque ad ottenere la gravidanza mediante fecondazione naturale.
L’iniezione intracitoplasmatica dello spermatozoo (ICSI) è invece la tecnica di PMA
maggiormente raccomandata per i pazienti che, pur avendo effettuato fino ad un anno di
terapia, esibiscono una concentrazione di spermatozoi inferiore a 1 mln/ml o per
pazienti che, avendo raggiunto una concentrazione di spermatozoi maggiore di 5
68
mln/ml, non hanno ottenuto la gravidanza per via naturale dopo 20 mesi. Nei pazienti
con ipogonadismo ipogonadotropo che presentano azoospermia persistente, nonostante
lunghi periodi di terapia ormonale, l’estrazione testicolare di spermatozoi (TESE)
potrebbe essere un eccellente alternativa per poter ricorrere ad una tecnica di PMA.
Le tecniche di riproduzione assistita sono un importante strumento per ottenere una
gravidanza in coppie in cui il partner maschile presenta ipogonadismo iponormogonadotropo.
Recentemente, un nuovo agonista recettoriale di FSH (e LH), assunto per os, ha
mostrato una certa bioattività in studi animali. Ciò può rivelarsi di grande importanza
per la sintesi dei futuri farmaci a base di gonadotropine che potrebbero essere assunti
per via orale, rimpiazzando così le forme iniettabili oggi disponibili.
69
Gonal-f
Il Gonal-f è un farmaco costituito dall’ormone follicolo stimolante ricombinante umano,
o follitropina α, prodotto da colture ovariche di criceto cinese (CHO) mediante tecniche
di DNA ricombinante. Il gene codificante per l’ormone viene inserito in CHO
geneticamente modificate, successivamente il prodotto di sintesi di queste cellule viene
estratto e purificato mediante immunocromatografia, infine viene quantificata l’attività
biologica del farmaco.
Il trattamento farmacologico con follitropina α viene prescritto in caso di infertilità sia
maschile sia femminile e in particolare:
Nella donna con anovulazione, cioè mancata maturazione del gamete, che non
risponde adeguatamente alla terapia con clomifene citrato, un altro farmaco che
stimola l’ovulazione;
Nella donna in attesa di sottoporsi ad una tecnica di PMA per indurre la
maturazione di più follicoli ovarici;
Nella donna con ipogonadismo ipogonadotropo;
Nell’uomo con ipogonadismo ipogonadotropo congenito o acquisito e
nell’infertilità maschile, anche in associazione con hCG, per l’induzione della
spermatogenesi.
Il Gonal-f è presente in commercio in due diverse preparazioni:
1. Soluzioni iniettabili in formulazioni da 75, 300, 450, 1050 UI;
2. Soluzioni iniettabili in penna preriempita per autosomministrazione da 300, 450
e 900 UI.
Dose (UI)
Volume da iniettare (ml)
75
0,13
150
0,25
225
0,38
300
0,50
375
0,63
450
0,75
Tabella 2. Corrispondenza tra volume di Gonal-f da iniettare e dose di rec-hFSH.
70
Il Gonal-f viene assunto alle dosi raccomandate anche per l’FSH urinario ma per una
durata di tempo minore. Sebbene possa essere somministrato anche per via
intramuscolare, il Gonal-f è più frequentemente assunto per via sottocutanea con
l’utilizzo di penne preriempite che consentono di iniettare sempre la dose corretta di
farmaco e di raggiungere la concentrazione plasmatica idonea in tempi più brevi. Negli
uomini con ipogonadismo ipogonadotropo la dose somministrata è di 150 UI tre volte la
settimana per almeno tre mesi. È fortemente raccomandata l’analisi del liquido
seminale, o spermiogramma, dopo circa 4-6 mesi dall’inizio della terapia ma se il
paziente non risponde è possibile continuare il trattamento fino a 18 mesi.
Figura 20. Penna per l’autosomministrazione di Gonal-f
La somministrazione sottocutanea consente alla follitropina α di raggiungere una
biodisponibilità assoluta del 74%. La biodisponibilità rappresenta una caratteristica
fondamentale per l’azione farmacologica, infatti il suo valore rappresenta la quantità di
farmaco che sarà distribuito mediante la circolazione sanguigna; in genere, si distingue:
1. Biodisponibilità assoluta. Si riferisce alla concentrazione attiva di farmaco in
circolo in seguito ad una modalità di somministrazione diversa da quella di tipo
endovenoso e viene calcolata dal rapporto tra la biodisponibilità di un farmaco
con somministrazione diversa da quella endovenosa, in questo caso la via
sottocutanea, e la biodisponibilità dello stesso farmaco quando somministrato
per via endovenosa; quest’ultimo parametro è per definizione, pari al 100%
perché l’intera dose di farmaco viene immessa direttamente nel circolo
sanguigno.
71
2. Biodisponibilità relativa. In questo caso la misura della biodisponibilità è data
dal rapporto tra la via di somministrazione del farmaco utilizzata e un’altra via
di somministrazione, differente da quella endovenosa.
Trasportata a livello del sito d’azione, il testicolo, la follitropina α interagisce con lo
stesso recettore per l’FSH fisiologico inducendo gli stessi meccanismi molecolari
intracellulari.
Il recettore per l’FSH si trova sulla membrana plasmatica delle cellule del Sertoli e delle
cellule di Leydig ed è costituito da un esteso dominio extracellulare caratterizzato da
una regione ricca in leucina e numerosi siti di glicosilazione.
Il legame con la follitropina α induce un cambiamento nella conformazione recettoriale
che può innescare l’attivazione di due proteine G differenti, Gs e Gq. Le proteine G sono
degli eterotrimeri formate dalla subunità α, ad attività GTPasica e dal complesso β-γ; la
formazione del complesso farmaco-recettore comporta la sostituzione del GDP legato
alla subunità α con il GTP, la dissociazione della subunità α-GTP dal complesso β-γ ed
infine l’interazione di questa con enzimi citoplasmatici responsabili di due possibili vie
di trasduzione:
1. Via della proteinchinasi A (PKA). La subunità α-GTP della proteina Gs attiva
l’enzima adenilato ciclasi in grado di sintetizzare l’adenosinmonofosfato ciclico
(AMPc) a partire da molecole di adenosina trifosfato (ATP); ciò comporta
l’aumento della concentrazione di AMPc all’interno della cellula, responsabile
dell’attivazione della proteinchinasi A (PKA) che regola la funzionalità di
differenti proteine citoplasmatiche mediante la fosforilazione di specifici residui
di serina e treonina.
2. Via della proteinchinasi C (PKC). L’attivazione della proteina Gq induce la
scissione dei fosfolipidi di membrana per produrre inositolo 1,4,5-trifosfato (IP3)
e 1,2-diacilglicerolo (DAG) da parte di una fosfolipasi C. IP3 stimola il rilascio
di Ca2+ dai depositi intracellulari aumentando così la concentrazione citosolica
del catione mentre DAG attiva la proteinchinasi C che, attraverso la
fosforilazione di diversi residui aminoacidici, media l’azione delle componenti
citoplasmatiche.
72
Figura 10. Possibili vie di trasduzione correlate al recettore per FSH.
Entrambe le vie di trasduzione agiscono nella regolazione della gametogenesi e della
steroidogenesi e sono indotte dalla follitropina α.
Come la maggior parte dei farmaci, il Gonal-f viene eliminato principalmente dal
fegato e dal rene.
Una singola somministrazione sottocutanea da 150 UI di follitropina α presenta
un’emivita, cioè il tempo necessario per dimezzare la concentrazione plasmatica di
farmaco, di circa 37 ore, la concentrazione plasmatica massima è di 3 UI/l e viene
raggiunta dopo 16 ore dalla somministrazione.
In seguito a somministrazioni ripetute di follitropina α la fase di equilibrio, o steady
state, in cui la concentrazione di farmaco che raggiunge il sito d’azione è pari alla
concentrazione di farmaco eliminato, viene raggiunta dopo circa 3-4 giorni.
Il Gonal-f non presenta interazioni significative con altri farmaci anche se l’uso
concomitante con farmaci agonisti od antagonisti di GnRH potrebbe causare la
desensibilizzazione ipofisaria portando alla necessità di dosi maggiori di follitropina α
per stimolare una sufficiente risposta testicolare.
73
Il Gonal-f è controindicato nei casi di pubertà precoce, patologie neoplastiche
ipotalamiche e ipofisarie, alterazioni prostatiche e testicolari; è importante considerare
anche che il farmaco non può essere utilizzato in presenza di ipersensibilità al principio
attivo e/o a qualcuno degli eccipienti e nei casi di insufficienza testicolare primaria che
non consente di sviluppare una risposta adeguata alla terapia.
Come tutti i farmaci, anche il Gonal-f può provocare nell’uomo reazioni avverse che in
genere, vengono suddivise in:
Molto comuni (più di 1 persona su 10)
dolore, arrossamento, lividi, gonfiore
e/o irritazione nella sede di iniezione.
Comuni (circa 1 persona su 10)
varicocele, ginecomastia, acne o aumento
di peso.
Molto rare (circa 1 persona su 10 000)
gravi reazioni allergiche, come
eruzioni cutanee, arrossamento della pelle, orticaria, gonfiore del viso e asma.
74
Scopo del lavoro
Visto il ruolo sempre maggiore del fattore maschile nell’infertilità di coppia, il mondo
scientifico, endocrinologi ed andrologi, si sta orientando sempre più allo studio di
terapie farmacologiche associato ad un regime di vita più salubre.
Durante lo stage, svolto nel laboratorio di Seminologia e Andrologia presso la Clinica
del Mediterraneo di Ragusa, la mia attenzione è stata rivolta sullo studio di 18 pazienti
di età compresa tra i 29 e i 45 anni affetti da ipogonadismo ipo-normogonadotropo in
trattamento con terapie ormonali applicate ad un regime di vita più salubre allo scopo di
migliorare lo stato di fertilità.
Le terapie disponibili devono essere progettate in funzione del quadro clinico del
paziente. I pazienti inclusi nello studio hanno adottato un protocollo di stimolazione
ormonale con gonadotropine e precisamente follitropina alfa (Gonal-f). Lo schema
terapeutico prevede tre somministrazioni settimanali (a giorni alterni) di 150 UI.
La somministrazione di follitropina alfa rappresenta la terapia d’elezione per uomini
affetti da ipogonadismo ipo-normogonadotropo. Infatti, numerosi studi riportano che la
terapia per lunghi periodi con FSH ricombinante risulta più efficace e meglio tollerata
rispetto alla terapia con FSH urinario ed in particolare in un recente studio, condotto
dalla European Medicines Agency (EMA), la terapia con follitropina alfa è risultata
efficace nella stimolazione della spermatogenesi nel 63% dei uomini che hanno assunto
il farmaco.
Abbiamo escluso dallo studio i pazienti che:
hanno assunto nel trimestre precedente farmaci per terapie croniche;
presentavano alterazioni tiroidee;
presentavano iperprolattinemia;
sono stati esposti a sostanze tossiche (vernici, anticrittogamici) e radiazioni;
erano dediti al consumo di alcolici;
affetti da criptorchidismo;
presentavano MAGI in atto;
dediti all’uso di stupefacenti ed anabolizzanti.
75
I pazienti inclusi nello studio hanno modificato il loro stile di vita nell’arco dei sei mesi
precedenti l’inizio della terapia farmacologica:
i fumatori hanno smesso di fumare o ridotto il consumo di sigarette giornaliero;
i pazienti obesi e in sovrappeso sono stati inseriti in un programma alimentare
controllato;
è stata tollerata l’assunzione di mezzo bicchiere di vino a pasto;
è stata consigliata attività fisica moderata per almeno 30 minuti al giorno.
Ho iniziato il mio lavoro con la raccolta dei dati inerenti i parametri interessanti lo
studio e la creazione di una tabella di lavoro. In laboratorio mi sono dedicata all’esame
del liquido seminale soffermandomi sui seguenti parametri inerenti gli spermatozoi:
motilità, concentrazione, morfologia degli spermatozoi e frammentazione del DNA
spermatico prima del trattamento farmacologico e la successiva rivalutazione di tali
parametri dopo tre mesi di terapia.
È importante precisare che l’integrità del genoma spermatico ricopre un ruolo molto
importante per ottenere il successo riproduttivo. L’oocita pur possedendo all’interno del
suo citoplasma un pool enzimatico in grado di riparare eventuali danni al DNA
spermatozoario, non riesce a ripristinare la corretta funzionalità se l’entità della
frammentazione è superiore al 30%.
76
Materiali e metodi
Inizialmente sono stati raccolti i dati anamnestici dei pazienti arruolati nello studio,
quali l’età, il peso e l’altezza, l’abitudine al fumo ma anche la presenza di eventuali altre
patologie e terapie con farmaci differenti. Questa prima fase dello studio ha
rappresentato una fase decisiva del lavoro perché i fattori esaminati influenzano, da soli,
i parametri seminali.
Per ciascun paziente è stato eseguito il dosaggio di FSH, LH e testosterone libero,
l'esame del liquido seminale ed il test di frammentazione del DNA spermatico.
La concentrazione ematica di FSH, LH e testosterone è determinata mediante tecniche
immunoenzimatiche.
Per l'analisi del liquido seminale il campione viene ottenuto per masturbazione dopo
aver avuto dai tre ai cinque giorni di astinenza e raccolto in un contenitore sterile con
tappo a vite che riporta il nome del paziente e l’ora di raccolta; prima di cominciare
l’esame è però necessario mantenerlo a 37 °C per circa 20 minuti così da permettere la
fluidificazione dell’eiaculato. Completata la liquefazione, si può procedere con la
valutazione dei parametri chimico-fisici:
La viscosità e il volume vengono valutati mediante una pipetta monouso in
plastica che consente di prelevare per intero il campione dal contenitore e di
lasciarlo gocciolare per gravità in modo da verificare la lunghezza del filamento
ottenuto: un liquido seminale normale fluisce goccia a goccia dalla pipetta ed ha
un volume pari o maggiore a 1,5 ml mentre un seme anomalo forma un
filamento lungo più di 2 cm.
Il colore è avorio ma un liquido seminale alterato può apparire diversamente, ad
esempio è rossastro se è presente emospermia, cioè se contiene emazie e
giallastro in pazienti affetti da ittero o che assumono alcuni tipi di vitamine e
farmaci.
Il pH viene valutato tramite un indicatore con range da 7 a 8,4 tenendo presente
che un pH pari a 7,2 è considerato come valore minimo soglia.
A questo punto è utile effettuare una prima valutazione microscopica a fresco, su
microscopio invertito ad ingrandimento 10x, che permette di valutare la presenza di
spermioagglutinazione e di aggregazione nemaspermica, vale a dire la presenza di
77
adesione degli spermatozoi mobili o immobili tra di loro ma anche ai filamenti di muco,
alle altre cellule o ai detriti, inoltre questa prima osservazione consente di stimare il
numero di altre cellule presenti nel liquido seminale, cellule epiteliali del tratto
genitourinario e cellule rotonde (leucociti e cellule germinali).
Figura 11. Osservazione a fresco su vetrino
La motilità spermatica è stata valutata con un’osservazione microscopica a fresco entro
la prima ora dall’eiaculazione per limitare le alterazioni dovute alla disidratazione, al
pH, ai cambiamenti di temperatura; collocando su un vetrino porta-oggetto 10 µl di
campione, coprendo con vetrino copri-oggetto 22x22 mm ed effettuando l’osservazione
su un microscopio invertito ad ingrandimento 40x si distinguono gli spermatozoi in
quattro categorie in base al tipo di motilità:
1. Spermatozoi con motilità di tipo a (progressiva veloce), quelli che si muovono
attivamente in modo lineare (> 25 µm/s a 37 °C);
2. Spermatozoi con motilità di tipo b (progressiva lenta o irregolare);
3. Spermatozoi con motilità di tipo c (non progressiva);
4. Spermatozoi con motilità di tipo d (immobili);
78
Gli spermatozoi con motilità di tipo a e quelli di tipo b, nel complesso, costituiscono la
popolazione di spermatozoi progressivi (PR).
Quando la percentuale totale di spermatozoi con motilità di tipo a, b e c è inferiore al
58% è necessario effettuare il test di vitalità per riuscire a distinguere quanti, tra gli
spermatozoi immobili, sono comunque vitali. Il test di vitalità (eosin test) consente
l’identificazione a fresco degli spermatozoi con membrana cellulare intatta, quindi
vitali, mediante esclusione del colorante; infatti, le membrane cellulari danneggiate
delle cellule morte permettono la penetrazione del colorante che normalmente non
riesce a permeare la membrana. Per evitare effetti negativi dovuti alla disidratazione o al
cambiamento di temperatura il test Eosina/Nigrosina deve essere effettuato entro la
prima ora dalla fluidificazione del campione.
Il test Eosina/Nigrosina si esegue utilizzando una soluzione contenente 0,1 g di eosina
in 10 ml di soluzione allo 0,9% di NaCl e una contenente 1g di nigrosina in 10 ml di
acqua distillata che, rendendo il fondo scuro, consente di distinguere più facilmente
anche gli spermatozoi scarsamente colorati. La preparazione del vetrino prevede
l’aggiunta di 50 µl di campione a 100 µl di soluzione contenente eosina, aggiungendo
infine 150 µl di soluzione contenente nigrosina dopo aver atteso circa 30 secondi; sul
vetrino porta-oggetto verranno infine collocati e strisciati con un vetrino copri-oggetto
10 µl della sospensione ottenuta.
Il vetrino viene osservato su un microscopio ottico in campo chiaro ad ingrandimento
1000x ad immersione contando 100 spermatozoi e distinguendoli in vitali e non vitali.
La vitalità degli spermatozoi viene determinata tenendo conto che le membrane
plasmatiche delle cellule morte permettono la penetrazione di coloranti i quali invece
non permeano le membrane delle cellule vitali.
79
Figura 12. Immagine al microspio ottico di un vetrino per il test Eosina/Nigrosina.
Per determinare la conta spermatica, cioè il calcolo della concentrazione nemaspermica
nel liquido seminale è necessario diluire un’aliquota del campione in acqua con rapporto
1:1 e utilizzare la camera di conta di Makler, costituita da due parti: una base metallica
porta-oggetto su cui vengono posti 10 µl di campione e una parte superiore coprioggetto su cui è disegnata al laser una griglia quadrettata (100 quadretti di 0,1 x 0,1 mm
ciascuno). Osservando la camera di conta al microscopio invertito ad ingrandimento 10x
risulta che il numero di spermatozoi contati su ogni riga della griglia equivale alla
concentrazione in milioni/ml.
Figura 24. Griglia di conta.
Camera di Makler.
80
Infine, per completare l’analisi del liquido seminale, è necessario effettuare la
valutazione della morfologia spermatica. Dopo aver strisciato 10 µl di seme su un
vetrino porta-oggetto, il campione viene fatto essiccare e successivamente si procede
alla colorazione.
Il processo prevede due diverse fasi:
1. Il primo colorante utilizzato è il May-Grunwald, costituito da eosinato di blu di
metilene, che ci permette di evidenziare i nuclei in rosso-violaceo ed il
citoplasma basofilo in blu. Il vetrino rimane a contatto con il colorante per
quattro minuti e poi viene sciacquato con acqua distillata.
2. In un secondo momento viene applicato il colorante Giemsa, una miscela
costituita da blu di metilene cloruro, blu di metilene eosinato, azurro II eosinato,
che aumenta l’intensità della colorazione nucleare e la capacità di evidenziare
selettivamente gli elementi cellulari. Tale colorante viene diluito 1:10 in acqua
distillata, agisce per 18 minuti ed è poi rimosso tramite lavaggio del vetrino in
abbondante acqua.
Una volta asciugato il vetrino a temperatura ambiente, la valutazione della morfologia
spermatica viene effettuata mediante l’osservazione di 200 spermatozoi in un
microscopio ottico in campo chiaro con obiettivo 100x ad immersione ad olio. Viene
osservato ogni spermatozoo esaminando la testa, il collo e la coda al fine di identificare
se esso è normale o se presenta anomalie nelle sue diverse strutture; per considerare uno
spermatozoo normale sia la testa che la coda devono essere normali e rispettare criteri
precisi:
La testa dovrebbe essere liscia, con contorni regolari e generalmente di forma
ovale. La regione acrosomale al suo interno deve apparire ben definita e
occupare il 40-70% dell’area della testa (Menkveld et al., 2001), deve essere
priva di vacuoli, o comunque non dovrebbe contenere più di due piccoli vacuoli.
Invece, la regione postaccrosomiale non deve contenere nessun vacuolo.
Il tratto intermedio dovrebbe essere sottile, regolare e lungo come la testa, con
l’asse maggiore allineato con l’asse maggiore della testa dello spermatozoo. Il
residuo citoplasmatico rappresenta un’atipia solo quando eccede di un terzo la
dimensione della testa dello spermatozoo (Mortimer, Menkveld, 2001).
81
La coda deve essere lunga circa 45 µm, con un calibro man mano più ridotto.
In genere nel liquido seminale si possono individuare spermatozoi con differenti tipi di
alterazioni che riflettono un basso potenziale di fecondazione e difetti del DNA.
Figura 25. Alcune forme atipiche di spermatozoi.
82
1
2
Figura 26. Osservazione della marfologia dopo colorazione con May-Grunwald e
Giemsa. 1: spermatozoo normoconformato. 2: spermatozoo con anomalia della
testa.
Infine, è stato eseguito un esame più approfondito che consente di analizzare l’integrità
del DNA; infatti numerosi studi hanno dimostrato che, nonostante i parametri seminali
siano nella norma, alcuni pazienti possono presentare il DNA spermatico altamente
frammentato.
La frammentazione del DNA spermatico viene valutata mediante il kit Halosperm il cui
protocollo si basa sul test della dispersione della cromatina. Questo test induce la
denaturazione del genoma e la rimozione della maggior parte delle proteine nucleari
producendo così dei “nucleoidi” nei quali i loop di DNA si espandono formando degli
aloni di cromatina dispersa; se il DNA risulta frammentato, gli aloni di dispersione non
si formano o presentano dimensione ridotta.
La metodica si esegue su campioni precedentemente congelati a - 20°C e portati a
temperatura ambiente prima del test:
1. Dopo aver diluito il seme in terreno PBS ad una concentrazione di 5-10 mln/ml,
si aggiungono 25μl di campione alla provetta di agarosio, precedentemente
sciolto, fornita dal kit.
83
2. La sospensione della provetta è depositata su un vetrino pre-trattato, coperta con
un vetrino copri-oggetto di 22x22 mm e lasciata solidificare per 5 minuti a +
4°C.
3. Si immerge il vetrino, privato del vetrino copri-oggetto, in una soluzione di
denaturazione, preparata aggiungendo 80 μl della soluzione contenuta nel kit a
10 ml di acqua distillata, per 7 minuti a temperatura ambiente.
4. Si lascia il vetrino in incubazione in 10 ml di soluzione di lisi per 25 minuti a
temperatura ambiente, poi si elimina questa soluzione lasciando il vetrino per 5
miuti in acqua distillata.
5. Il vetrino viene esposto ad una soluzione di etanolo al 70% per 2 minuti, seguito
da etanolo al 90% per 2 minuti e alla fine, etanolo al 100% per altri 2 minuti.
6. Una volta asciugato a temperatura ambiente, il vetrino può essere colorato. La
tecnica utilizzata è la colorazione di Wright nella quale il campione è posto a
contatto con una soluzione di colorante di Wright e tampone fosfato 1:1 per 1015 minuti. Il vetrino viene infine lavato in acqua corrente ed asciugato a
temperatura ambiente.
A questo punto è possibile l’osservazione del vetrino in microscopio ottico in campo
chiaro con obiettivo 100x ad immersione ad olio che permette la classificazione degli
spermatozoi. Vengono analizzati 500 spermatozoi e suddivisi in:
Spermatozoi privi di DNA frammentato. Possono essere osservati
spermatozoi con alone molto marcato, in cui lo spessore dell’alone è
simile o maggiore del diametro del corpo del nucleo (core) e spermatozoi
con alone di media dimensione.
Spermatozoi con DNA frammentato.
In questo caso si possono
distinguere spermatozoi con alone simile o minore di 1/3 del diametro
del core, spermatozoi senza alone e spermatozoi che presentano un core
irregolare o una colorazione molto debole.
84
1
4
2
3
Figura 27. Osservazione del grado di integrità del DNA con la metodica
Halosperm. 1: spermatozoo con alone molto marcato. 2: spermatozoo con alone di
media dimensione. 3: spermatozoo con alone minore di 1/3 del diametro del core.
4: spermatozoo senza alone.
85
Risultati
Nei 18 pazienti esaminati sono stati valutati i seguenti parametri:
FSH.
Valori di riferimento:
1,5 UI/l - 8 UI/l
Testosterone.
Valori normali
T libero
> 72 pg/dl
Intermedi
Patologici
52 - 72 pg/dl
< 52 pg/dl
LH.
Valori di riferimento:
4 UI/l - 20 UI/l
Spermiogramma.
Volume
< 1,5 ml: ipoposia
≥ 1,5 ml: parametro nella norma
in mln/ml
osservati solo su centrifugato: criptozoospermia
0 - 5: severa oligozoospermia
6 - 10: moderata oligozoospermia
11 - 15: lieve oligozoospermia
Conta
≥ 15: parametro nella norma
in mil. sul totale dell'aiaculato
0 - 13: severa oligozospermia
14 - 26: moderata oligozoospermia
27 - 39: lieve oligozoospermia
≥ 39: parametro nella norma
in % di PR
Motilità
0 - 10: severa astenozoospermia
11 - 20: moderata astenozoospermia
21 - 32: lieve astenozoospermia
86
≥ 32: parametro nella norma
Morfologia
< 4% di forme normali: teratozoospermia
Lunghezza: 3,7 - 4,7 μm
Testa
Larghezza: 2,5 - 3,2 μm
Lunghezza/larghezza: 1,30 - 1,80
Acrosoma
40 - 70% della testa
Lunghezza: 1,5 volte la testa
Tratto intermedio
Larghezza: 1 μm
Posizione assiale
Residui citoplasmatici: < 33% della testa
Lunghezza: 45 μm
Coda
Larghezza: inferiore al tratto intermedio
Dritta, uniforme, non arrotolata
Vitalità:
< 58%: necrozoospermia
si effettua solo se Mpr + Mnpr < 58%
≥ 58%: parametro nella norma
Frammentazione del DNA.
≥ 30%
non compatibile con uno stato di buona fertilità
≤ 15%
compatibile con uno stato di buona fertilità
15% - 30%
compatibile con uno stato di fertilità ridotta
Al termine dei tre mesi di terapia sono stati ottenuti i seguenti dati:
87
Dati pre-terapia
Chimico-fisiche
N°
Età
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
32
34
43
41
38
45
41
36
38
34
34
45
36
37
40
30
29
41
colore
Volume
(ml)
pH
viscosità
Conta
(mln/ml)
Avo
Avo
Avo
Giall
Avo
Avo
Giall
Avo
Avo
Avo
Bianc
Avo
Avo
Avo
Bianc
Giall
Avo
Avo
1,5
3
2,6
2,3
5,4
5
4
2,2
3
4,4
4
4
2,4
3
1,7
2,5
4
4
8,4
7,4
7,6
8
8,2
8,2
8
8
7,8
8
8
7,8
8,2
8
7,8
8
8
8,4
Aum-8cm
Norm
Norm
Norm
Aum-4cm
Norm
Aum-4cm
Norm
Norm
Norm
Aum-8cm
Norm
Norm
Norm
Norm
Norm
Norm
Aum
2
4,5
2,3
2,5
2,5
6,4
10
10
1,5
1,3
2
1,8
51
70
20
15
49
14
Motilità
Mpr
(%)
Mnpr
(%)
I
(%)
0
7
10
13
2
45
44
73
0
2
0
0
42
7
48
48
61
11
20
4
7
18
30
20
8
7
40
26
15
24
16
4
13
10
10
24
80
89
83
69
68
35
48
20
60
72
85
76
42
89
39
42
29
65
Vit
(%)
54
41
72
60
45
76
59
38
N.E.
N.E.
43
77
Morfologia
N
(%)
A
(%)
T
(%)
Col
(%)
Cod
(%)
2
98
100
46
18
0
100 100
46
34
2
98
99
33
3
3
97
100
47
8
1
99
100
29
9
1
99
99
14
12
2
98
100
38
7
8
92
98
21
10
2
98
98
35
19
1
99
99
24
49
Non eseguita- campione esiguo
Non eseguita- campione esiguo
2
98
99
33
3
2
98
99
57
16
2
98
96
36
16
6
94
93
25
20
2
98
99
30
25
0
100 100
52
16
Tabella 3. Dati inerenti l’analisi del liquido seminale prima della terapia.
88
N°
Età
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
32
34
43
41
38
45
41
36
38
34
34
45
36
37
40
30
29
41
Fumo
(sig/die)
30
30
7
20
BMI
(kg/m2)
23,0
32,5
28,6
23,0
29,7
21,9
22,3
26,8
27,6
21,3
21,6
27,7
31,9
35,3
25,9
24,0
22,8
25,5
Pat.
Var
Var
Var
Motilità
FSH
(UI/l)
LH
(UI/l)
T
(pg/dl)
Conta
(mln/ml)
Mpr (%)
3,5
4,2
5,1
3,3
6,0
4,1
7,8
7,1
3,4
3,5
3,9
2,8
5,6
7,9
1,4
2,9
5,7
4,6
2,5
4,2
4,4
3,1
4,3
2,6
2,9
3,7
3,5
2,9
3,1
4,1
4,5
5,2
3,4
4,0
3,5
2,6
18
51
45
40
45
38
65
72
30
47
16
22
62
55
42
50
65
48
2
4,5
2,3
2,5
2,5
6,4
10
10
1,5
1,3
2
1,8
51
70
20
15
49
14
0
7
10
13
2
45
44
73
0
2
0
0
42
7
48
48
61
11
Morf.
Vit.
N
(%)
54
41
72
60
45
2
0
2
3
1
1
2
8
2
1
N.E.
N.E.
2
2
2
6
2
0
76
59
38
43
77
Framm.
(%)
32
81
67
52
72
11
51
12
26
12
33
41
71
72
49
20
23
50
Tabella 4. Dati inerenti i parametri considerati nello studio prima della terapia.
89
Dati post-terapia.
Chimico-fisiche
N°
Età
1
32
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
34
43
41
38
45
41
36
38
34
34
45
36
37
40
30
29
41
pH
viscosità
Avo
Volume
(ml)
3
Conta
(mln/ml)
7,8
Aum-6cm
Avo
Avo
Avo
Avo
Avo
Avo
Avo
Avo
Avo
Avo
Giall
Avo
Avo
Bianc
Giall
Avo
Avo
1,8
3
3
4
4,6
4,6
2,5
1,9
4,5
5,2
4
2
2,7
2,1
2,5
3,2
2,5
7,8
7,8
8
8,2
8
8
7,8
7,8
8,2
8,4
7,8
7,8
8
7,8
8,2
7,8
8,2
Norm
Norm
Norm
Aum-4cm
Norm
Norm
Norm
Norm
Norm
Norm
Norm
Norm
Norm
Aum-4cm
Norm
Norm
Norm
colore
Motilità
2,8
Mpr
(%)
5
Mnpr
(%)
30
I
(%)
65
4,5
3
60
4
12,5
8
105,6
2,5
6
4
6
40
16,2
19
17
31
17
13
7
52
12
79
43
59
12
16
6
10
60
6
46
83
70
29
16
15
20
40
11
20
11
48
40
24
30
20
5
18
4
7
11
71
78
28
48
10
37
30
40
44
70
60
20
89
36
13
22
60
Vit
(%)
42
63
90
59
78
70
62
58
55
50
75
Morfologia
N
(%)
2
A
(%)
98
T
(%)
97
Col
(%)
29
Cod
(%)
20
0
1
5
1
2
6
7
2
1
1
0
2
4
5
6
3
0
100
99
95
99
98
94
93
98
99
99
100
98
96
95
94
97
100
100
100
99
100
96
97
98
98
98
98
100
100
98
99
94
99
100
55
34
20
25
16
32
15
41
26
21
20
33
19
32
29
36
49
25
8
10
10
10
6
20
20
47
13
12
8
8
11
28
29
20
Tabella 5. Dati inerenti l’analisi del liquido seminale al termine della terapia.
90
N°
Età
1
32
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
34
43
41
38
45
41
36
38
34
34
45
36
37
40
30
29
41
Fumo
(sig/die)
15
0
5
15
BMI
(kg/m2)
Motilità
FSH
(UI/l)
LH
(UI/l)
T
(pg/dl)
Conta
(mln/ml)
Mpr (%)
Vit
(%)
24,0
3,9
3,8
70
2,8
5
42
30,1
30,0
23,8
24,7
22,1
22,8
24,7
24,4
21,8
22,2
24,6
27,1
31,7
23,5
24,3
21,9
23,7
4,0
4,8
3,9
6,5
3,9
7,6
7,5
3,0
3,8
3,7
2,4
5,0
7,3
2,0
2,2
5,4
5,0
5,2
4,7
6,8
9,7
7,4
9,2
5,8
7,0
3,5
6,7
9,7
6,6
4,8
8,1
6,3
7,7
4,9
91
50
100
48
90
68
95
55
66
86
77
84
70
45
47
66
72
4,5
3
60
4
12,5
8
105,6
2,5
6
4
6
40
16,2
19
17
31
17
13
7
52
12
79
43
59
12
16
6
10
60
6
46
83
70
29
63
90
Pat.
Var
Var
Var
59
78
70
62
58
55
50
75
Morf.
N
(%)
2
0
1
5
1
2
6
7
2
1
1
0
2
4
5
6
3
0
Framm
(%)
25
59
60
13
48
13
38
10
27
11
27
36
32
68
45
24
18
30
Tabella 6. Dati inerenti i parametri considerati nello studio al termine della terapia.
91
Dalla loro analisi i risultati osservati sono i seguenti:
Pz. Conta Motilità
1
+
+
2
=
+
3
+
=
4
+
+
5
+
+
6
+
+
7
=
8
+
9
+
+
10
+
+
11
+
+
12
+
+
13
+
14
=
15
=
=
16
+
+
17
+
18
+
+
Framm
=
=
=
=
=
=
=
+
-
Testost
Note
+
parametri migliorati
+
parametri migliorati-BMI diminuito-fumo ridotto
=
parametri non migliorati-BMI aumentato
+
parametri migliorati
=
parametri migliorati-BMI diminuito
+
parametri migliorati
=
parametri non migliorati
+
parametri migliorati-BMI diminuito
+
parametri migliorati-BMI diminuito
+
parametri migliorati
+
parametri migliorati
+
parametri migliorati-BMI diminuito
+
parametri migliorati-BMI diminuito-fumo ridotto
+
parametri non migliorati-BMI diminuito
=
parametri non migliorati-BMI diminuito
=
parametri migliorati
=
parametri migliorati
+
parametri migliorati-BMI diminuito
Tabella 7 riassuntiva. Legenda: (+) parametro aumentato; (-) parametro
diminuito; (=) parametro costante.
Dei 18 pazienti presi in esame:
12 hanno avuto un miglioramento di tutti i parametri indagati.
1 ha avuto un miglioramento soltanto della conta spermatozoaria e del
testosterone; la frammentazione è rimasta invariata poichè già nei limiti della
norma. La motilità contrariamente alle aspettative si è ridotta, probabilmente a
causa del notevole aumento di spermatozoi ritrovatisi in un volume di eiaculato
rimasto costante, il che provoca un aumento della concentrazione dei cataboliti
con effetto tossico.
1 ha avuto un miglioramento nei parametri di frammentazione, motilità e
testosterone, invece la concentrazione di spermatozoi si è ridotta, ciò potrebbe
essere imputabile alle normali fluttuazioni della produzione testicolare durante
l'anno.
4 pazienti non hanno migliorato i parametri indagati:
92
uno non ha seguito il regime alimentare prescritto ed è passato dal la
condizione di sovrappeso all'obesità;
uno ha ridotto soltanto la frammentazione, motilità e testosterone si sono
mantenuti costanti e la conta è diminuita, probabilmente a seguito delle
normali fluttuazioni annuali della produzione testicolare;
uno ha avuto soltanto
aumento del testosterone, frammentazione e
motilità si sono mantenute costanti, la conta è diminuita, ciò potrebbe
essere imputabile alle normali fluttuazioni della produzione testicolare
durante l'anno;
un paziente non ha avuto nessun miglioramento.
Dei 10 pazienti che presentavano un BMI fuori dal range di normalità, 3 erano obesi e
di questi:
uno è passato al sovrappeso;
uno non ha cambiato la sua condizione;
uno ha ridotto il suo BMI, da obesità di grado II ad obesità di grado I.
Dei pazienti in sovrappeso:
uno ha raggiunto l'obesità;
sei sono rientrati nel peso forma.
Per quanto riguarda la frammentazione, dei 12 pazienti che prima della terapia avevano
una percentuale di frammentazione superiore al 30%:
in uno si è ridotta a meno del 15%, quindi è tornato nella norma;
in tre è diminuita fino a valori compresi tra 15 e 30%;
negli altri 8, pur essendoci stata una notevole riduzione della frammentazione, il
valore è rimasto superiore al 30%.
Dei tre pazienti che inizialmente presentavano un livello di frammentazione compreso
tra 15 e 30%:
due hanno mantenuto il valore all'interno di questo range;
in uno è aumentata, il paziente riferisce di aver intensificato l'attività fisica, ed in
particolare di essersi dedicato al ciclismo.
93
Dei tre pazienti che presentavano un livello di frammentazione nella norma, questo si è
mantenuto costante.
Percentuali di miglioramento dei parametri seminali (conta e motilità), della
frammentazione del DNA e dei livelli di testosterone.
Conta.
Range di riferimento (mln/ml) Pz. pre
Pz. post
I
0<x<5
9
6
II
6 < x < 10
3
3
III
11 < x < 15
1
1
IV
X > 15
5
8
50%
45%
40%
35%
30%
0 <x<5
6 < x < 10
25%
11 < x < 15
20%
x > 15
15%
10%
5%
0%
pre
post
pre
post
pre
post
pre
post
Come da rappresentazione grafica possiamo notare che si è ottenuto un miglioramento
del numero di spermatozoi nei gruppi I e IV, pressochè invariati i gruppi II e III.
94
Motilità.
Range di riferimento (%)
Pz. pre
Pz. post
I
0 < x < 10
9
5
II
11 < x < 20
2
4
III
21 < x < 32
0
1
IV
x> 32
7
8
50%
45%
40%
35%
30%
0 < x < 10
11 < x < 20
25%
21 < x < 32
20%
x > 32
15%
10%
5%
0%
pre
post
pre
post
pre
post
pre
post
Come da rappresentazione grafica possiamo notare che si è ottenuto un miglioramento
della motilità in tutti i gruppi, con maggiore variazione nel gruppo I.
95
Frammentazione.
Range di riferimento (%)
Pz. pre
Pz. post
x > 30
12
9
15 < x < 30
3
5
x < 15
3
4
70%
60%
50%
40%
x > 30
15 < x < 30
30%
x < 15
20%
10%
0%
pre
post
pre
post
pre
post
Come da rappresentazione grafica possiamo notare che si è ottenuto un miglioramento
dell'integrità spermatica in tutti i gruppi, con maggiore variazione nel gruppo I.
96
Testosterone.
Range di riferimento (pg/dl)
Pz. pre
Pz. post
I
x < 52
13
3
II
52 < x < 72
5
8
III
x > 72
0
7
80%
70%
60%
50%
x < 52
40%
52 < x < 72
x > 72
30%
20%
10%
0%
pre
post
pre
post
pre
post
Come da rappresentazione grafica possiamo notare che si è ottenuto un miglioramento
del valore di testosterone.
97
Grafico riassuntivo
80%
70%
60%
50%
Testostrone
Frammentazione
40%
30%
Motilità
Conta
20%
10%
0%
Nell’istogramma è chiaramente visibile che la terapia con Gonal-f e la modifica dello
stile di vita sembra aver influito positivamente nel diminuire il livello di
frammentazione del DNA, infatti il 56% dei pazienti ha ottenuto un miglioramento.
Per quanto riguarda la concentrazione, si è ottenuto un miglioramento di tale parametro
nel 66 % dei pazienti.
Per quanto riguarda la motilità, si è ottenuto un miglioramento di tale parametro nel 72
% dei pazienti
Per quanto riguarda il testosterone libero, si è ottenuto un miglioramento di tale
parametro nel 66 % dei pazienti
98
Conclusioni
Le condizioni iniziali dei pazienti inseriti nello studio erano tali da collocarli in uno
status di ipogonadismo ipo-normogonadotropo tale da rendere molto improbabile la
possibilità di fecondare. Al termine del ciclo di terapie farmacologiche e modifica dello
stile di vita, nei 2/3 dei pazienti si è avuto un netto miglioramento di tutti i parametri
indagati.
Il trattamento con follitropina alfa garantisce il miglioramento dei parametri considerati
nei pazienti trattati. Tuttavia l’associazione della terapia alla riduzione del consumo
giornaliero di sigarette e alla perdita di peso, ha portato miglioramenti più marcati della
qualità del liquido seminale, della frammentazione del DNA e del livello di testosterone.
Ciò può essere riconducibile principalmente al fatto che la riduzione di peso induce
l’aumento di testosterone libero e questo può intensificare l’azione della follitropina alfa
a livello gonadico.
In tal senso risulta importante la raccomandazione di un corretto regime alimentare in
associazione alla terapia farmacologica convenzionale.
In 4 coppie si è ottenuta la gravidanza con tecniche di Procreazione Medicalmente
Assistita. Due gravidanze sono state ottenute a seguito di tecniche di PMA di I livello
(IUI), le altre due tramite tecniche di PMA di II livello (ICSI). Ciò implica che pazienti
con liquido seminale gravemente alterato, candidati all’accesso a tecniche di II livello,
grazie alla terapia, hanno potuto accedere a tecniche di I livello, quindi meno invasive.
Questo, a sua volta, si riflette sia sull’aspetto psicologico della coppia che affronta un
percorso più "soft" (minore dosaggio di farmaco, tecnica ambulatoriale e non
chirurgica) sia sull'aspetto economico, con differenze notevoli che danno alla coppia, in
caso di fallimento, la possibilità di riprovare più volte la tecnica.
Bisogna tener presente che, poiché la dimensione campionaria esaminata è stata esigua
per gli studi clinici, è stato imprudente applicare test di significatività statistica. Lo
studio condotto, tuttavia, visto i risultati positivi ottenuti anche se limitati, invita alla
prosecuzione dell’impiego del metodo di stimolazione ormonale associato ad un regime
di vita più salubre.
99
Bibliografia
[1]
Wolf-Bernhard Schill, Frank H. Comhaire, Timothy B. Hargreave. Andrologia
clinica. Springer. 2009; 3(I): 33-56; 1(II): 259-266, 272-280.
[2] Sara Pinto Provenzano. Liquido seminale ed attività antiossidante. Narcissus. 2012;
1: 2-14.
[3] Moore Keith L, TVN Persuaud, Mark G Torchia. Lo sviluppo prenatale dell’uomo.
Nona edizione. EDRA LSWR Spa. 2014; 2: 30-39.
[4] Schwanzel-Fukuda M, Bick D, Pfaff DW. Mol Brain Res. 1989; 6: 311-326.
Cariboni A, Maggi R, Parnavelas JG. Trends Neurosci. 2007; 30: 638-44. Cariboni
A, Maggi R. Cell Life Sci. 2006; 63: 2512-2526. Cariboni A, Pimpinelli F,
Colamarino S, Zaninetti R, Piccolella M, Rumio C, Piva F, Rugarli E, Maggi
R. Hum Mol Gen. 2004; 13: 2781-2791. Maggi R, Pimpinelli F, Molteni L,
Milani M, Martini L, Piva F. Endocrinology. 2000; 141: 2105-2112.
Maggi R, Pimpinelli F, Martini L, Piva F. Endocrinology. 1995; 136: 5177-5181.
[5]
Fraietta R, Zylberstejn DS, Esteves SC. Hypogonadotropic Hypogonadism
Revisited. Clinics. 2013; 68(S1): 81-88.
[6] Tsutsui K,Bentley GE,Kriegsfield LJ: Discovery and evolutionary of GnIH and
Kisspeptin. Oxford Journals : GPR54 and kisspeptin in reproduction.
[7] Leão RB, Esteves SC. Gonadotropin therapy in assisted reproduction: an
evolutionary perspective from biologics to biotech. Clinics. 2014; 69(4): 279293.
[8] Sriaman V et al. Hormonal regulation of Leydig Cell proliferation and
differentiation in rodens testis: a dynamic interplay between gonadotrophins
and testicular factors. Reprod Biomed Online. 2005; 11(4): 507-18.
[9] Pantalone KM, Faiman C. Male hypogonadism: More than just a low testosterone.
(Cleveland) Clin J Med. 2012; 10: 718, 720-723.
[10] Scott F. Gilbert. Biologia dello sviluppo. Seconda edizione italiana condotta sulla
quarta americana. Zanichelli Editore Spa. 1996; 4: 144-172.
[11] Visigalli R. Sterilità e infertilità di coppia. Counseling e terapia psicologica.
FrancoAngeli. 2011; 5: 97-107.
100
[12] www.iss.it.
[13] Monaco F. Linee guida per la diagnosi, la terapia e il controllo delle malattie
endocrine e metaboliche. Volume III. SEE Firenze. 2000; 1: 21-58, 2: 59-64,
10: 133-140.
[14] McMurray e Kortun 2003; Karagiannis et El Osta 2004; Rockett et al. 2004.
[15] Swerdan AJ, Higgins CD, Pike MC. Risk of testicular cancer in a cohort of a boys
with cryptorchidism. BMJ. 1997; 314: 1507-1511.
[16] Spinelli C, Migliore E, Miccoli P. Ritenzione testicolare ed anomalie urogenitali
associate. Rass It Chir Ped. 1989;31-148.
[17] Opitz JM, Simpson JL. Pseudovaginal perinescrotal hypospadias. Clin Genet.
1972; 3: 1026.
McPhaul MJ, Marcelli M. Genetic basis of endocrine disease. J Clin Endpcrin
Metab. 1993; 76: 17.
[18] www.epicentro.iss.it.
www.societaitalianaendocrinologia.it.
[19] Schoor RA, Elhanbly SM, Niederberger C. The phatophysiology of varicoceleassociated male infertility. Curr Urol Rep. 2001; 2: 432-436.
Turner TT, Caplis LA, Brown KJ. Vascular anatomy of experimentally induced
left varicocele in the rat. Lab Anim Sci. 1996; 46: 206-210.
[20] Sweeney TE, Rozum JS, Gore RW. Alteration of testicular microvascular pressures
during venous pressure elevation. Am J Physiol. 1995; 269: 37-45.
Sweeney TE, Rozum JS, Desjardins C, Gore RW. Microvascular pressure
distribution in the hamster testis. Am J Physiol. 1991; 260: 1581-1589.
[21] The influence of varicocele on parameters of fertility in a large group of men
presenting to infertility clinics. World Health Organization. Fertil Steril. 1992;
57: 1289-1293.
[22] Pierik FH, Abdessalam SA, Vreeburg JT, Dohle GR, De Jong FH, Weber RF.
Increased seruminhibin B levels after varicocele treatment. Clin Endocrinol
(Oxf). 2001; 54: 775-780.
101
Mormandi E, Levalle O, Ballerini MG, Hermes R, Calandra RS, Campo S. Serum
levels of dimeric and monomeric inhibins and the degree of seminal alteration in
infertile men wioth varicocele. Andrologia. 2003; 35: 106-111.
[23] Comhaire F, Kunnen M. Selective retrograde venography of the internal spermatic
vein: a
conclusive approach to the diagnosis of varicocele. Andrologia.
1976; 8: 11-14.
Comhaire F, Kunnen M, Nahoum C. Radiological anatomy of the internal
spermatic vein(s) in 200 retrograde venograms. Int J Androl. 1981; 4: 379-387.
[24] Comhaire F, Vrmeulen A. Varicocele sterility: cortisol and catecholamines. Fertil
Steril. 1977; 25: 88-95.
Steeno O, Koumans J, De Moor P. Adrenal cortical hormones in the spermatic
vein of 95 patients with left varicocele. Andrologia. 1976; 8: 101-104.
[25] Marmar JL. The patophysiology of varicoceles in the light of current molecular and
genetic information. Hum Reprod Update. 2001; 7: 461-472.
[26] Dalton TP, He L, Wang B, Miller ML, Jin L, Stringer KF, et al. Identification of
mouse SLC39A8 as the transporter responsible for cadmium-induced toxicity
in the testis. Proc Natl Acad Sci USA. 2005; 102: 3401-3406.
[27] De Lamirande E, Lamothe G. Reactive oxygen-induced reactive oxygen formation
during human sperm capacitation. Free Radic Biol Med. 2009; 46: 502-510.
De Lamirande Em Cagnon C. Capacitation-associated production of superoxide
anion by human spermatozoa. Free Radic Biol Med. 1995; 18: 487-495.
[28] Lenzi A, Culasso F, Gandini L, Lombardo F, Dondero F. Placebo-controlled,
double-blind, cross-over trial of glutathione theraphy in male infertility. Hum
Reprod. 1993; 8: 1657-1662.
Cavallini G, Ferraretti AP, Giomaroli L, Biagiotti G, Vitali G. Cinnoxicam and Lcarnitine/acetyl-L-carnitine treatment for idiopatic and varicocele-associated
oligoasthenospermia. J Androl. 2004; 25: 761-770.
[29] Sebrazes J. L’ orchite de la varicelle. Bull Acad Natl Med (Paris) 1927; 98: 122127. Wesselhoeft C, Pearson CM. Orchitis in the course of severe chicken pox
with pneumonitis, followed by testicular atrophy. N Engl J Med. 1950; 242: 651652.
102
Ormiston G. Orchitis as a complication of a chicken-pox. Br Med J. 1953; 1: 12031204.
Turner RB. Orchitis as a complication of chicken-pox. Pediatric Infect Dis. 1987;
6: 489.
Riggs S, Samford JP. Viral orchitis. N Engl J Med. 1962; 266: 990-993.
[30] Sokol RZ. Endrocrinology of male infertility: evalutation and treatment. Semin
Reprod Med. 2009; 27(2): 149-158.
[31] www.airc.it/tumori/tumore-ai-testicoli.asp
[32] Sklar C. Reproductive physiology and treatment-related lass of sex hormone
production. Med Pediatric Oncol. 1999; 33: 2-8.
Sklar CA, Constine LS. Chronic neuroendocrinological sequelae of radiation
theraphy. Int J Radiat Oncol Biol Phys. 1995; 31: 1113-1121.
[33] Byrne J, Mulvihill JJ, Myers MH, et al. Effects of treatment on fertility in longterm survivors of childhood or adolescent cancer. N Engl J Med. 1987; 317: 13151321.
Chapman RM, Sutcliffe SB, Rees LH, et al. Cyclical combination chemotherapy
and gonadal function: Retrospective study in males. Lancet. 1979; 1: 285-289.
[34] Clark ST, Radford JA, Crowter D, et al. Gonadal function following chemotherapy
for Hodgkin’s disease: A comparative study of MVPP and a seven-drug hybrid
regimen. J Clin Oncol. 1995; 13: 134-139.
Shaffold EA, Kingston JE, Malpas JS, et al. Testicular function following the
treatment of Hodgkin’ s disease in childhood. Br J Cancer. 1993; 68: 1199-1204.
Mackie EJ, Radford M, Shalet SM. Gonadal function following chemotherapy for
childhood Hodgkin’ s disease. Med Pediatr Oncol. 1996; 27: 74-78.
Cunha MF, Meistrich ML, Fuller LM, et al. Recovery of spermatogenesis after
treatment for Hodgkin’ s disease: Limiting dose of MOPP chemotherapy. J Clin
Oncol. 1984; 2: 571-577.
[35] Hsiao W, Stahl PJ, Osterberg EC, Nejat E, Palermo GD, Rosenwaks Z, et al.
Successful
treatment of postchemotherapy azoospermia with microsurgical
testicular sperm extraction: the Weill Cornell experience. J Clin Oncol. 2011; 29:
1607-1611.
103
Jahnukainen K, Ehmcke J, Hou M, Schlatt S. Testicular function and fertility
preservation in male cancer patients. Best Pract Res Clin Endocrinol Metab. 2011;
25: 287-302.
[36] Loeb C. Neurologia diagnostica. Springer. 2000; 1: 153-154.
[37] Carolyn M, Fronczak MD, MSPH, Edward D, Kim MD, Al B, Barqami MD. The
insults of illicit drug use of male fertility. 2001 Journal of Andrology.
[38] www.iss.it/rpma/glos/cont.php?id=108&lang=1&tipo=17
[39] Foresta C. Tassonomia e eziopatogenesi delle patologie andrologiche. Quaderni del
Ministero della Salute. 2012.
[40] Franco B, Guioli S, Pragliola A et al. A gene deleted in Kallmann’s syndrome
shares homology with neural cell adhesion and axonal path-finding molecules.
Nature 1991; 353(6344):529-536.
Legouis R, Hardelin JP, Levilliers J et al. The candidate gene for the X-linked
Kallmann syndrome encodes a protein related to adhesion molecules. Cell 1991;
67(2):423-435.
Hardelin JP, Levilliers J, del C, I et al. X chromosome-linked Kallmann syndrome:
stop mutations validate the candidate gene. Proc Natl Acad Sci U S A 1992;
89(17):8190-8194.
[41] Santeusanio F. Quanto è rilevante l’associazione fra ipogonadismo maschile e
sindrome metabolica? G It Diabetol Metab. 2008; 28:1-4.
[42] Ricciardi W, Capri S, Kheiraoui F, de Waure C, Specchia ML, Cadedddu C,
Gualano MR, Sferrazza A, Nicolotti N, Capizzi S, di Nardo F, Mancuso A, La
Torre G, Lenzi A, Lombardo F. L’impiego dell’ormone follicolo stimolante (FSH)
urinario umano nella riproduzione assistita: una valutazione di HTA. QIJPH. 2012;
2: S11.
[43] Baer G, Loumage E. Comparison of recombinant human luteinising hormone (rhLH) and human menopausal gonadotropin (hMG) in assisted reproductive
technology. Curr Med Res Opin. 2003; 19(2):83-88.
104
Siebold B. Physicochemical characterization of recombinant human follicle
stimulating hormone. Hum Reprod. 1996; 11 Suppl: 1109-1115; discussion 117119.
[44] www.agenziafarmaco.gov.it/bancadatifarmaco/
[45] Gemmarelli G. Ormone stimolante il follicolo: dalla fisiologia alle applicazioni
terapeutiche. Accademia Nazionale di Medicina. Forum Service Editore. 2009; 1:
3-10.
[46] le Cotonnec JY, Loumage E, Porchet HC, Beltrami V, Munafo A.
Pharmacokinetics and pharmacodynamic interactions between recombinant
human luteinizing hormone and recombinant human follicle-stimulating hormone.
Fertil Steril. 1998; 69(2): 201-209.
Karlsson
MO,m
Wade JR, Loumaye
E, Munafo A. The population
pharmacokinetics of recombinant- and urinary-human follicle-stimulating
hormone in women. Br J Clin Pharmacol. 1998; 45(1): 13-20.
[47] le Cotonnec JY, Porchet HC, Beltrami V, Khan A, Toon S, Rowland M. Clinical
pharmacology of recombinant human follicle-stimulating hormone (FSH). I.
Comparative pharmacokinetics with urinary human FSH. Fertil Steril.
1994;61(4):669–678.
[48] www.ema.europa.eu
[49] Alvin M. Matsumoto, Peter J. Snyder, Shalender Bhasin, Kathryn Martin, Thomas
Weber, Stephen Winters, Daniel Spratt, Jim Brentzel, Louis O’Dea. Stimulation
of spermatogenesis with recombinant human follicle-stimulating hormone
(follitropin alfa; GONAL-f): long-term treatment in azoospermic men with
hypogonadotropic hypogonadism. Fertility and Sterility Vol. 92, No. 3. 2009;
979-990.
[48] Manuale di laboratorio WHO per l’esame del liquido seminale, quinta edizione.
Società Italiana di Andrologia e Medicina della Sessualità. 2010; 2: 7-25, 59-64,
70-71.
105
Ringraziamenti
Ringrazio innanzitutto la professoressa Renata Viscuso per la grande disponibilità e i
preziosi consigli.
Ringrazio il dott. Giovanni Bracchitta per aver seguito costantemente il mio lavoro e
per essere stato la giusta guida nella redazione della mia tesi di laurea. Farò tesoro dei
suggerimenti ricevuti per il mio futuro.
Ringrazio la mia famiglia e soprattutto i miei genitori senza i quali non avrei potuto
raggiungere questo importante traguardo, per cui questa laurea è in gran parte anche
vostra!!
Ringrazio il mio ragazzo Sebastiano che ha creduto e continua a credere nelle mie
capacità. Insieme a lui ho superato gli ostacoli più difficili lungo tutto il mio percorso.
Ringrazio infine, tutti i miei amici e le persone che anche semplicemente con una parola
mi hanno dimostrato il loro affetto.
106