Vol. 99, N. 1, Gennaio 2008
Pagg. 1-9
Oggi
Nuove strategie terapeutiche
nel carcinoma polmonare non a piccole cellule metastatico
Javier Rosada, Massimo Bindi, Massimiliano Pinelli, Maido Castiglioni
Riassunto. Il carcinoma polmonare costituisce una patologia gravata ancora da elevata
mortalità, nonostante la terapia convenzionale. Oggi è possibile identificare molecole, come il recettore per il fattore di crescita epidermico, coinvolte nelle più precoci alterazioni
molecolari della cancerogenesi. Viene illustrato il ruolo che molecole capaci di bloccare
questi recettori possono avere nel trattamento.
Parole chiave. Chemioterapia, erlotinib, gefitinib, recettore per il fattore di crescita epidermico, tumore polmonare non microcitoma.
Summary. New therapeutic strategies to the advanced non small cell lung cancer.
Lung cancer is an elevated mortality disease in spite of conventional therapy. Today
it is possible to identify some molecules, as the epidermal growth factor receptor, involved
in the earliest molecular alterations of cancerogenesis. Here we show the inhibitors of the
epidermal growth factor receptor as a therapeutic mean.
Key words. Chemotherapy, epidermal growth factor receptor, erlotinib, gefitinib, non
small cell lung cancer.
Introduzione
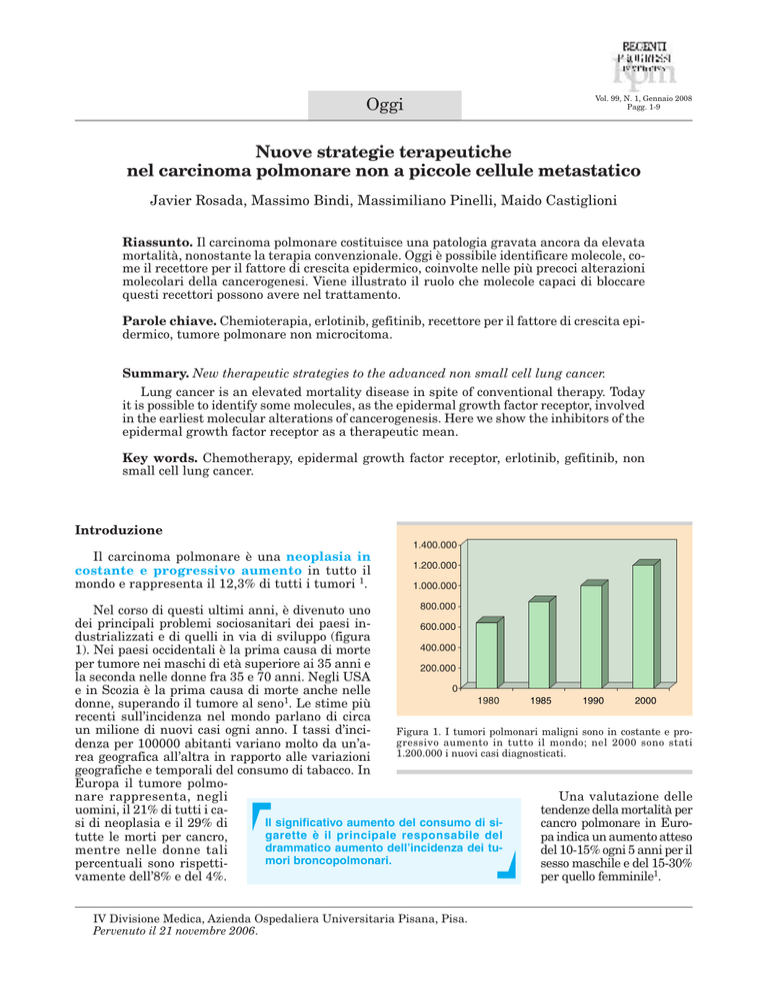
1.400.000
Il carcinoma polmonare è una neoplasia in
costante e progressivo aumento in tutto il
mondo e rappresenta il 12,3% di tutti i tumori 1.
1.200.000
1.000.000
800.000
Nel corso di questi ultimi anni, è divenuto uno
dei principali problemi sociosanitari dei paesi in600.000
dustrializzati e di quelli in via di sviluppo (figura
400.000
1). Nei paesi occidentali è la prima causa di morte
per tumore nei maschi di età superiore ai 35 anni e
200.000
la seconda nelle donne fra 35 e 70 anni. Negli USA
0
e in Scozia è la prima causa di morte anche nelle
1985
1990
2000
1980
donne, superando il tumore al seno1. Le stime più
recenti sull’incidenza nel mondo parlano di circa
un milione di nuovi casi ogni anno. I tassi d’inciFigura 1. I tumori polmonari maligni sono in costante e progressivo aumento in tutto il mondo; nel 2000 sono stati
denza per 100000 abitanti variano molto da un’a1.200.000 i nuovi casi diagnosticati.
rea geografica all’altra in rapporto alle variazioni
geografiche e temporali del consumo di tabacco. In
Europa il tumore polmonare rappresenta, negli
Una valutazione delle
uomini, il 21% di tutti i catendenze della mortalità per
Il significativo aumento del consumo di sisi di neoplasia e il 29% di
cancro polmonare in Eurogarette è il principale responsabile del
tutte le morti per cancro,
pa indica un aumento atteso
drammatico aumento dell’incidenza dei tumentre nelle donne tali
del 10-15% ogni 5 anni per il
mori broncopolmonari.
percentuali sono rispettisesso maschile e del 15-30%
vamente dell’8% e del 4%.
per quello femminile1.
IV Divisione Medica, Azienda Ospedaliera Universitaria Pisana, Pisa.
Pervenuto il 21 novembre 2006.
2
Recenti Progressi in Medicina, 99, 1, 2008
Il fumo di sigaretta è, infatti, responsabile del
90% dei nuovi casi, essendo diagnosticato nel 50%
in fumatori attivi e nel 40% in ex-fumatori con un
rapporto dose-effetto: il rischio di ammalarsi aumenta progressivamente con il numero di sigarette fumate e con la durata dell’abitudine al fumo.
Negli ultimi anni si è rilevato che anche il fumo
passivo, con una stima che va da un 30% ad un
50% rispetto ad una popolazione non a rischio, è
associato ad un aumento d’incidenza 2,3.
Terapia medica del carcinoma polmonare
I tumori maligni del polmone possono essere
raggruppati in due grandi categorie istopatologiche che differiscono per prognosi e atteggiamento
terapeutico: i carcinomi anaplastici a piccole
cellule, o microcitomi, che rappresentano il 2025% dei carcinomi polmonari, e i carcinomi non
a piccole cellule (NSCLC), che costituiscono il
restante 75-80%.
Quest’ultima categoria, a sua volta, viene divisa in tre sottogruppi: a) carcinoma squamoso o epidermoide, che costituisce il 30-35%; b) adenocarcinoma, con la sua variante bronchioloalveolare, che
costituisce il 30%; c) carcinoma anaplastico a grandi cellule con le varianti a cellule giganti e cellule
chiare, che rappresenta il 10%. In questi ultimi anni si è avuto un incremento percentuale dell’adenocarcinoma a discapito del carcinoma a cellule
squamose.
Nella maggior parte dei casi, al momento della diagnosi la patologia è in stadio avanzato, inoperabile e spesso è poco praticabile anche un
approccio chemioterapico “aggressivo” per
la frequente comorbilità. È infatti riportato che
il numero medio di malattie croniche nei soggetti tra i 65 ed i 74 anni d’età è almeno di 6 e, tra
le patologie prevalenti, riscontriamo le malattie
cardiovascolari e le broncopneumopatie croniche. Non vanno inoltre sottovalutati gli effetti
tossici a livello d’organo, quali quelli dovuti alla
ridotta riserva midollare, epatica e renale che
inducono una minore tollerabilità a regimi chemioterapeutici aggressivi, soprattutto a quelli
contenenti cisplatino 3,5. Soltanto il 20% dei pazienti con NSCLC (tabella 1 nella pagina seguente) si presenta alla diagnosi di malattia in
stadio I e II ed è candidato ad un trattamento
chirurgico radicale curativo: in questi casi le
percentuali di sopravvivenza a 5 anni variano
dal 40 al 70% circa. Circa il 40% dei pazienti
presenta alla diagnosi una malattia localmente
avanzata (stadio III) e le percentuali di sopravvivenza a 5 anni, con solo trattamento locale,
variano dal 5 al 25%. Il rimanente 40% dei pazienti presenta alla diagnosi una malattia disseminata (stadio IV).
Inoltre, circa il 75% dei pazienti che vengono
sottoposti a trattamento chirurgico radicale sviluppa una malattia metastatica in una fase più o
meno precoce della propria storia clinica. Per tutti questi pazienti l’unica scelta terapeutica è rappresentata dalla chemioterapia (CT).
Storia della chemioterapia
nel NSCLC metastatico
Per molti anni il ruolo svolto dalla chemioterapia (CT)
nel trattamento dei pazienti con NSCLC metastatico è
stato controverso (figura 2).
Negli anni ottanta sono stati condotti alcuni studi
randomizzati che hanno confrontato la CT con la sola terapia di supporto (Best Supportive Care = BSC) in pazienti con NSCLC in stadio IV 6-10. I risultati di tali studi, pubblicati tra la fine degli anni ’80 e l’inizio degli anni ’90, sono stati contraddittori e non hanno chiarito
quale delle due alternative terapeutiche potesse offrire
un beneficio in termini di sopravvivenza.
Nel 1995 il Non Small Cell Lung Cancer Collaborative Group ha condotto una metanalisi con l’obiettivo di valutare l’impatto della CT sulla sopravvivenza in pazienti
con NSCLC in vari stadi di malattia. Per quanto riguarda
lo stadio IV, sono stati considerati tutti gli studi, pubblicati
e non, che confrontavano la CT con l’aggiunta della BSC alla sola BSC11. La metanalisi dimostra che una CT contenente cisplatino determina un aumento del 10% della sopravvivenza ad un anno, che si traduce in un incremento
mediano della sopravvivenza di circa 6 settimane.
I risultati della metanalisi sono stati poi confermati da
studi prospettici randomizzati12 e sulla base di questi dati, nel 1997, un gruppo d’esperti dell’American Society of
Clinical Oncology (ASCO) ha elaborato le linee guida cui
attenersi nella pratica clinica quotidiana (al di fuori di studi clinici) nel trattare i pazienti con carcinoma a piccole
cellule metastatico. Queste linee guida stabiliscono che la
chemioterapia è il trattamento indicato in pazienti selezionati (con buon performance status) con NSCLC in stadio IV; la CT dovrebbe comprendere un derivato del platino e non dovrebbe essere protratta per più di 8 cicli13.
Questi dati sono stati aggiornati nella revisione delle linee
guida ASCO del 2003 in cui è stato confermata l’utilità di
un regime a due farmaci comprendente platino in prima linea nel NSCLC stadio IV, da non proseguire per più di sei
cicli totali14.
Storia Chemioterapia
1980
1990
St. randomizzati
CT vs BSC
1995
METANALISI
NSCLC collaborative Group
?
1997
2003
St. randomizzati
CT vs BSC
ma
er
nf
co
ASCO
REVISIONE
ASCO
CISPLATINO
(h 10% sopravv. 1 anno)
= 6 sett.
Linee Guida
Figura 2. Schema che riassume i progressi terapeutici in tema
di CT nel NSCLC metastatico.
Se all’inizio degli anni ottanta solo cinque farmaci
antitumorali dimostravano attività superiore al 15%
nel trattamento del carcinoma polmonare (cisplatino,
mitomicina, vinblastina, ifosfamide e vindesina), negli
anni novanta si sono aggiunti nuovi farmaci singolarmente attivi nel NSCLC e con un buon profilo di tossicità fra cui taxani, vinorelbina, gemcitabina e inibitori
della topoisomerasi (irinotecano) [figura 3].
3
J. Rosada et al.: Nuove strategie terapeutiche nel carcinoma polmonare non a piccole cellule metastatico
Tabella 1. Stadiazione del carcinoma polmonare non a piccole cellule secondo il sistema TNM.
Stadio/alla diagnosi
SpravRate
vivenza
5 anni
1 anno
T*
N**
M***
Descrizione
IA
T1
N0
M0
T1 t ≤3 cm, circolando da polmone o PV, non
segni d’invasione più prossimale bronco lobare alla broncoscopia
94
67
IB
T2
N0
M0
T2 t >3 cm, INT BP 2 cm o più distalmente alla carena, INT PV, ass. atelectasia o PmO che
non INT polmone in toto
87
57
IIA
T1
N1
M0
N1 INT linfonodale omolaterale peribronchiali e/o ilari e intrapolmonari
89
55
T2
N1
M0
73
39
T3
N0
M0
T3 INTA: PT, diaframma, PM, PeP, bronco
principale a <2 cm distalmente alla carena,
ass. atelectasia o PmO del polmone in toto.
T1
N2
M0
N2 Linfonodi mediastinici omolaterali
e/o sottocarenale
64
25
T2
N2
M0
T3
N1-2
M0
Tutti
T
N3
M0
Linfonodi controlaterali, sovraclaveari, ecc.
32
5
T4
Tutti
N
M0
INTA: mediastino, cuore, grossi vasi, trachea,
esofago, carena, VPM, più noduli stesso lobo.
37
7
Tutti
T
Tutti
N
M1
Metastasi a distanza
20
1
NSCLC/
Local
Localmente
avanzato
80%
20%
40%
IIB
IIIA
IIIB
Disseminato
IIIB
IV
40%
*Tumore; **Linfonodi; ***Metastasi. PV: pleura viscerale, INT: interessa/interessamento, BP: bronco principale, ass: associato,
PmO: polmonite ostruttiva, INTA: interessa alcune delle seguente strutture; PT: parete toracica, PM: pleura mediastinica, PeP: pericardio parietale, VPM: versamento pleurico maligno.
Negli studi di fase II i nuovi farmaci hanno indotto
circa il 20% di risposte obiettive come agenti singoli, e
fino al 40% in associazione con derivati del platino quali il cisplatino e il carboplatino.
La vinorelbina, la gemcitabina e i taxani sono stati
confrontati in studi randomizzati con la BSC, rivelandosi superiori in termini di sopravvivenza e di qualità
di vita15,16.
I regimi cosiddetti d’ultima generazione hanno fornito al medico la possibilità di ampliare la scelta terapeutica; tali regimi hanno dato percentuali di risposta
maggiori di quelle ottenute con i regimi di prima generazione (ad esempio mitomicina, ifosfamide e cisplatino), anche se i dati d’efficacia non sono significativamente mutati17.
Sono invece diversi i profili di tossicità derivanti dall’uso dei “vecchi” farmaci e dei “nuovi”: questi ultimi
hanno migliorato la compliance dei pazienti al trattamento e hanno fornito al medico la possibilità di scegliere un trattamento sulla base delle problematiche del
singolo paziente.
Regimi terapeutici
1980
1990
Cisplatino
Mitomicina
Vinblastina
Ifosfamide
Vindesina
Taxani
Vinorelbina
Gemcitabina
Inibitori
topoisomerasi
Figura 3. Principali farmaci dell’arsenale medico, degli ultimi
2 decenni, nella terapia del NSCLC metastatico.
4
Recenti Progressi in Medicina, 99, 1, 2008
Fattore di crescita epidermico
meccanismi d’inattivazione (fosfatasi o degradazione ed endocitosi del recettore) o ad una cross- attivazione da parte di recettori omologhi o eterologhi.
Nonostante i rapidi progressi realizzati nell’ulIn ogni caso, la via delle MAP chinasi rappresenta
timo decennio in tema di CT del tumore polmonauna delle vie più importanti per la trasmissione del
re non a piccole cellule, solo una piccola percensegnale di proliferazione; la cascata enzimatica di
tuale di pazienti trae un reale beneficio dal trattaRAS, Raf, MAP/Erk (MEK1) aumenta l’attività di
mento antiproliferativo e i dati di sopravvivenza
fattori di trascrizione cosembrano aver raggiunto
me Elk1 e c-fos, che portaun plateau. L’interesse
no alla proliferazione e atdei ricercatori si è quindi
Biopsie eseguite sull’epitelio bronchiale di
tivano la progressione del
spostato verso nuove
forti fumatori e sui pezzi operatori di carcistrategie terapeutiche.
ciclo cellulare. EGFR,
noma polmonare non a piccole cellule hanGrazie all’affinarsi
inoltre, induce l’angiogeno dimostrato la presenza del recettore per
delle tecniche d’indagine
nesi, aumentando l’el’epidermal growth factor (EGFR), glicopromolecolare è oggi possibispressione di VEGF nelle
teina transmembrana considerata una delle
le identificare alcune mocellule tumorali, interagipiù precoci alterazioni molecolari della canlecole biologiche coinvolte
sce con componenti della
cerogenesi polmonare.
nell’iniziazione e nella
via delle integrine coinvolprogressione del carcinote nell’adesione fra cellula
ma polmonare.
e cellula, controllando l’inGli EGF (Epidermal Growth Factor) sono una
vasione delle cellule tumorali, e incrementa l’attifamiglia di recettori composta di quattro glicoprovazione delle metalloproteinasi della matrice, stiteine di 170 kda con attività tirosino-chinasica, limolando la motilità delle cellule tumorali che congando dipendente, e struttura simile: ErB-1 (EGtribuisce ulteriormente alla metastatizzazione.
FR), ErB-2 (HER2/neu), ErB-3 e ErB-4. Queste
EGFR inibisce indirettamente l’apoptosi attravermolecole recettoriali sono composte da tre domini:
so PI3K che attiva Akt, un’importante molecola
una regione extracellulare o ectodomain, dove si
coinvolta nel segnale antiapoptotico attraverso la
trova il sito di legame dell’EGF e di numerosi altri
trascrizione del fattore nucleare kB e indirettamente anche nel controllo della via delle MAP chifattori di crescita polipeptidici fra cui TGFα
amphiregulina, β-cellulina ed altri; una regione
nasi18.
idrofobica transmembrana e una parte intracellulare o endodomain, sede dell’attività tirosino-chiL’aumentata espressione d’EGFR è presente in
nasica. Quando il ligando si unisce al dominio exvarie neoplasie fra cui NSCLC (40-80%), testa
tracellulare dell’EGFR, si ha il reclutamento di
collo (80-100%), colon (25-77%) e molte altre fra
un’altra molecola della stessa famiglia di recettori
cui ovaio, mammella, stomaco, pancreas, vescidell’EGF e la formazione di dimeri (omo o eterodica, rene e gliomi19. Nel NSCLC l’espressione delmeri). A questa dimerizzazione, grazie ad una chil’EGFR compare fin dalle prime tappe della cannasi annessa all’EGFR, segue il trasferimento di
cerogenesi: nella metaplasia squamosa e nel
una molecola di ATP ad un residuo di tirosina delcarcinoma in situ. Un 40-60% dei carcinomi
la porzione intracellulare del recettore. L’autofosquamosi esprime EGFR, mentre lo esprime il
sforilazione coincide, di fatto, con l’inizio della tra60-90%
dei carcinomi non squamosi.
duzione del segnale a valle che ha come finalità ultima la proliferazione della cellula, l’angiogenesi,
la differenziazione, la migrazione, l’adesione, la
trasformazione e l’inibizione dell’apoptosi. Infatti,
Vari studi sembrano suggerire una correlazione
i residui di tirosina una volta fosforilati agiscono
fra espressione elevata di EGFR ed una ridotta socome siti di legame per effettori di varie vie enzipravvivenza nel NSCLC, anche se il ruolo di EGmatiche. Alcuni di questi effettori sono molecole di
FR come fattore prognostico sembra essere magconnessione o adattatori come Grb2 e Shc che sergiore se considerato in associazione ai recettori con
vono come complessi base cui possono assemblarcui dimerizza, fra cui HER2/neu. Questo problema
si gli elementi che traducono il segnale per la prorimane ancora controverso anche per i diversi moliferazione. Altri sono enzimi attivati dalla fosforidi con cui l’espressione dell’EGFR è valutata, renlazione fra cui SOS, PI3K e Gab-1. Le vie di
dendo difficile confrontare i dati fra i diversi studi;
traduzione del segnale che comprendono RAS e le
l’immunoistochimica in ogni caso sembra essere il
MAP chinasi, Src e gli attivatori della trascrizione
più diffuso20,21.
(STAT) inducono la trascrizione dei geni e promuovono le diverse risposte cellulari. A seconda
La ricerca di molecole capaci di bloccare l’attidelle combinazioni di dimeri di recettori sulla suvazione dell’EGFR ha portato, dal punto di vista
perficie, avremo il reclutamento di diverse vie enclinico, a due principali linee di ricerca:
zimatiche all’interno della cellula.
Vari altri meccanismi cellulari possono influen1. Anticorpi monoclonali che si legano alzare l’attività d’EGFR nelle cellule tumorali, come
la regione extracellulare adibita ad accola presenza di recettori costitutivamente attivi dogliere i fattori di crescita: mirano a bloccare la
vuti a mutazioni del gene d’EGFR, ad un deficit dei
cascata sul nascere.
J. Rosada et al.: Nuove strategie terapeutiche nel carcinoma polmonare non a piccole cellule metastatico
In questo gruppo di molecole troviamo Erbitux (cetuximab) il cui ruolo si è dimostrato particolarmente interessante nel carcinoma del colon
retto22,23. Nel carcinoma del polmone risultati di
uno studio di fase II che paragonava la combinazione cisplatino/vinorelbina verso la stessa combinazione con il cetuximab nel NSCLC avanzato
hanno mostrato un maggior response rate e nessun aumento significativo in tossicità per l’associazione cetuximab e CT. Tali interessanti risultati necessitano di ulteriori conferme.
2. Inibitori dell’attività tirosino-chinasica
del recettore: queste molecole, di piccole dimensioni, pur non impedendo l’interazione ligando-recettore, non permettono che essa possa generare
una risposta biologica all’interno della cellula. Antagonizzano competitivamente il legame dell’ATP
col suo sito e impediscono l’autofosforilazione, bloccando quindi la via effettrice di propagazione del
segnale; essi comprendono gefitinib (Iressa)
ed erlotinib (Tarceva).
I nuovi farmaci
GEFITINIB, ERLOTINIB
Gefitinib (ZD1839-Iressa) è un derivato
anilinochinazolinico a basso peso molecolare (447 Da), somministrabile per via orale,
caratterizzato da una capacità selettiva e reversibile di inibire la tirosin-chinasi dell’EGFR.
Negli studi preclinici è stata dimostrata la capacità da parte di gefitinib di arrestare il ciclo cellulare in G0/G1 con un meccanismo dose e tempo dipendente, associato all’incremento dell’espressione
degli inibitori di p21 e p27, cicline chinasi-dipendenti; l’attività di gefitinib è stata evidenziata in
un’ampia varietà di tumori fra cui NSCLC, mammella, prostata, colon-retto e ovaio, sia per la molecola da sola sia in combinazione con radioterapia, citochine, endocrinoterapia, altri agenti target specifici e CT; è stato osservato un effetto sinergico con
vari agenti citotossici fra cui derivati del platino,
taxani, doxorubicina, etoposide e topotecan.
In particolare, su linee cellulari di carcinoma
mammario inibiva l’autofosforilazione di HER2
che è, infatti, preferenzialmente attivato dall’eterodimerizzazione con EGFR24; gli studi su animali hanno dimostrato una eccellente biodisponibilità orale e una bassa tossicità sistemica.
È stato inoltre dimostrato come nonostante la
rapida regressione della crescita cellulare, i tumori trattati ricrescevano non appena il farmaco veniva sospeso e che l’attività era simile anche se l’espressione di EGFR era diversa fra i modelli animali trattati; era già quindi evidente come non
solo fosse necessaria una somministrazione continua del farmaco, ma anche come molti fattori influissero sulla risposta al farmaco fra cui l’espressione di recettori mutati, la dimerizzazione e l’attivazione a valle del segnale25-27.
5
L’evidenza negli studi preclinici d’attività antitumorale e di un profilo favorevole di tossicità sono stati la premessa per iniziare gli studi di fase I
su pazienti affetti da varie neoplasie che esprimono EGFR, fra cui NSCLC, colon-retto, ovaio, testa
collo e hanno confermato i dati di biodisponibilità
e tollerabilità. I pazienti trattati sono stati più di
250 di cui 100 affetti da NSCLC, tutti già trattati
con precedenti terapie. Il dosaggio del farmaco è
stato valutato da 50 mg a 1000 mg/die con schedule sia continue sia intermittenti anche per più di
sei mesi di terapia; il trattamento è stato generalmente ben tollerato con diarrea e rash acneiforme
di grado lieve-moderato che nella maggior parte
dei casi regredivano all’interruzione del trattamento; la dose massima tollerata è stata fra 700 e
1000 mg/die e la tossicità dose limitante era la
diarrea; la valutazione farmacocinetica era a favore di una mono-somministrazione giornaliera del
farmaco alla quale si ottenevano concentrazioni
plasmatiche attive di gefitinib; lo studio farmacodinamico su biopsie cutanee mostrava che gefitinib produceva inibizione di EGFR; i pazienti valutati hanno mostrato risposte e stabilità di malattia
particolarmente interessanti nei pazienti affetti da
NSCLC per i quali era evidente anche un beneficio
sui sintomi28,29. Sulla base di questi risultati sono
stati disegnati due studi di fase II in pazienti con
NSCLC localmente avanzato o metastatico, refrattari alla CT (IDEAL = Iressa Dose Evaluation
in Advanced Lung Cancer): i pazienti dell’IDEAL 1
dovevano aver effettuato una sola linea di CT a
base di cisplatino, mentre nell’IDEAL 2 dovevano
essere stati sottoposti anche ad una seconda linea
a base di docetaxel; venivano quindi randomizzati
a ricevere gefitinib alle dosi di 250 o 500 mg al
giorno fino a progressione o tossicità inaccettabile;
gli obiettivi primari erano la valutazione delle percentuali di risposta, del miglioramento dei sintomi
secondo il questionario FACT-L e delle tossicità;
gli obiettivi secondari erano la determinazione delle percentuali del controllo dei sintomi, della sopravvivenza libera da progressione; in totale sono
stati arruolati nei due studi più di 200 pazienti.
Nell’IDEAL 1 le percentuali di risposta erano
18,4 e 19% per i due dosaggi di gefitinib; le percentuali di controllo di malattia (SD + RP) erano
54,4 e 51,4% rispettivamente e la sopravvivenza
mediana 7,6 e 8 mesi con una sopravvivenza ad un
anno di 35 e 30% nei due bracci di trattamento.
Nell’IDEAL 2 le percentuali di risposta erano
11,8 e 8,8% con un controllo di malattia del 43 e
35,8% per i due dosaggi di gefitinib, con una sopravvivenza mediana di 6,5 e 5,9 mesi e una sopravvivenza ad un anno del 29 e 24%. Le percentuali di miglioramento della sintomatologia sono state di 40%
e 37% nell’IDEAL 1 e di 43% e 35% nell’IDEAL 2 con
periodo di meno di 10 giorni per osservare questo incremento nei due studi. Le tossicità di grado 3-4 sono state poco comuni con rash acneiforme e diarrea
come effetti più comuni. Non sono stati osservati casi di polmonite interstiziale29,30.
6
Recenti Progressi in Medicina, 99, 1, 2008
Questi dati hanno portato le autorità giapponesi ad approvare l’uso di gefitinib in seconda linea
nel NSCLC a metà del 2002 e hanno indotto la
FDA ad approvarne l’uso come trattamento di III
linea in pazienti affetti da NSCLC avanzato o metastatico nel maggio 2003.
Inoltre, negli studi preclinici, gefitinib aveva
dimostrato un effetto sinergico con la CT26; anche un successivo studio di fase II aveva confermato questo dato, valutando la combinazione di
gefitinib con l’associazione carboplatino paclitaxel. Pertanto sono stati disegnati due studi di
fase III randomizzati a doppio cieco (INTACT 1 e
INTACT 2) per studiare la combinazione di gefitinib somministrato in tre dosaggi diversi
(500mg/die, 250 mg/die e placebo) con la CT standard in pazienti affetti da NSCLC localmente
avanzato o metastatico, non pretrattati. Nell’ambito dell’INTACT 1, gefitinib è stato combinato con l’associazione cisplatino e gemcitabina,
mentre nell’INTACT 2 con carboplatino e paclitaxel31,32.
Entrambi questi due studi hanno dimostrato
che gefitinib non migliora l’efficacia della CT in
termini di sopravvivenza, tempo a progressione
e risposta obiettiva; gefitinib inoltre non ha aggiunto nessuna tossicità significativa a quella
della CT, determinando principalmente diarrea
e rash cutaneo; il dosaggio di 250 mg/die, come
già nei precedenti studi è stato tollerato meglio
dei 500 mg/die; l’incidenza di polmonite interstiziale è stata intorno all’1%; questo poco frequente ma grave effetto collaterale, probabilmente correlato a gefitinib, già osservato negli
studi IDEAL, è stato particolarmente studiato
in Giappone dove il farmaco è già somministrato diffusamente e dove ha determinato numerosi decessi33. I risultati negativi degli studi INTACT, simili a quelli con erlotinib, hanno portato ad approfondire meglio il meccanismo di
funzionamento del farmaco e la sua migliore modalità di somministrazione per comprendere i
motivi di dati non in linea con quelli d’altri inibitori del recettore EGF, associati alla CT, come
trastuzumab nella mammella 34 o Erbitux nel
colon-retto27,28. Gli studi preclinici avevano dimostrato un effetto sinergico fra CT e gefitinib,
ma i dosaggi dei chemioterapici erano subottimali rispetto a quelli usati sull’uomo, dove non
vi sarebbe nessun effetto aggiuntivo dalla somministrazione contemporanea di CT e inibitori
di EGFR perché entrambi hanno lo stesso target
cellulare ed effetti simili su neoplasie, come
quelle polmonari, già di per sé chemioresistenti.
Altro motivo di fallimento degli studi INTACT
poteva essere l’assenza di una preselezione di
pazienti che potessero rispondere a gefitinib.
Tuttavia, a differenza di trastuzumab, non vi è
alcuna evidenza di correlazione fra espressione
d’EGFR e risposta al trattamento. Gli studi pubblicati con Erbitux nel colon retto hanno mostrato tassi di risposte simili in pazienti con diversa espressione d’EGFR.
Evidenze sperimentali hanno dimostrato
che la cellula neoplastica riesce a sfuggire all’inibizione della crescita attuata con gli anti-EGFR attraverso diverse vie di fuga: è stato dimostrato che le cellule tumorali A431 possono
acquisire resistenza ad anticorpi anti-EGF come
Erbitux attraverso l’overespressione costitutiva di
fattori proangiogenetici (VEGF) da parte delle cellule tumorali. VEGF, infatti, è secreto dalle cellule tumorali ed ha un ruolo chiave nella regolazione della proliferazione cellulare; per questo sono in
corso di studio molecole come ZD6474 che blocchino contemporaneamente il recettore per
VEGF(VEGFR-2) e EGFR per eliminare la via di
fuga VEGF mediata35.
Il recettore I per l’IGF può determinare attivazione costitutiva di segnali antiapoptotici, come
Akt e p70s6k, che inibiscono l’azione di inibitori di
EGFR su cellule di glioblastoma in vitro. Risultati
simili possono essere osservati anche su cellule di
carcinoma mammario somministrando contemporaneamente IGF-I e trastuzumab36.
Sono stati effettuati studi per valutare il ruolo di erlotinib come agente singolo in seconda e
terza linea nel NSCLC e in combinazione con il
trattamento standard di prima linea. Lo studio
randomizzato di fase III in cui erlotinib è stato utilizzato in pazienti pretrattati affetti da NSCLC
avanzato o metastatico ha dimostrato come il farmaco possa prolungare la sopravvivenza, migliorare il tempo a progressione, la sintomatologia e la
qualità di vita rispetto al placebo.
Nei due studi di fase III (TRIBUTE e TALENT),
disegnati come gli studi INTACT, l’associazione di
erlotinib alla CT di I linea in pazienti affetti da
NSCLC in stadio IIIB-IV non ha migliorato i risultati del trattamento standard.
È
Quindi gli studi pubblicati mostrano che i derivati anilinochinazolinici (gefitinib ed erlotinib),
inibitori tirosinochinasici dell’EGFR, rappresentano un’alternativa terapeutica per i pazienti affetti da NSCLC, con una percentuale di risposta del 10-20%, quando questi agenti vengono usati in seconda o terza linea terapeutica in
stadio avanzato 30,31,36,37.
Oggi sappiamo che la risposta a questi farmaci è caratteristica di un ben distinto sottogruppo
di pazienti (figura 4): donne, non fumatori, adenocarcinomi e asiatici38. Nella maggior parte dei
pazienti con elevata risposta e con maggiori tempi di sopravivenza in seguito al trattamento con
questi inibitori dell’attività tirosino-chinasica del
recettore, il tumore, già resistente alla CT di I e II
linea conteneva mutazioni nel gene che codifica
l’EGFR.
Queste mutazioni sono costituite da piccole delezioni in-frame o da sostituzioni aminoacidiche
(dall’aa 747 fino all’aa 750) raggruppate intorno
alla tasca di legame all’ATP del dominio della tiro-
7
J. Rosada et al.: Nuove strategie terapeutiche nel carcinoma polmonare non a piccole cellule metastatico
A
B
Figura 4. TAC torace di una paziente, non fumatrice, affetta da adenocarcinoma al IV stadio, chemioresistente (alla prima e seconda linea terapeutica) che mostra regressione di malattia. A sinistra (A) prima, e a destra (B) dopo somministrazione di inibitori della tirosinchinasi del recettore EGF. Con tecniche TC diverse.
sina chinasi (più comunemente una sostituzione
della leucina da parte di un’alginina a livello del
codone 858[L858R])37,39.
Tutte le mutazioni erano eterozigoti, e mutazioni identiche sono state osservate in più pazienti, a suggerire l’esistenza di un guadagno di funzione additivo specifico. Queste mutazioni mediano effetti oncogenici alterando la trasmissione del
segnale al di sotto della membrana e di meccanismi antiapoptotici, incrementano la sensibilità del
tumore a questi farmaci molto probabilmente attraverso un rimaneggiamento del dominio tirosinokinasico del recettore per il fattore di crescita
epidermico(EGF), che stabilizza la loro interazione
e quella con i suoi inibitori competitivi44. Inoltre in
questi meccanismi hanno un ruolo importante
l’amplificazione del gene dell’EGFR e dell’HER2
così come l’iperespressione dell’EGFR40.
In seguito alle innumerevoli mutazioni riscontrate per il gene che codifica l’EGFR e per alcune
di quelle degli enzimi che partecipano nelle sue
più importanti vie effettrici, la ricerca si è ampliata per interpretare i meccanismi intrinseci
della resistenza ai nuovi farmaci, che, anche se
tuttora rimangono non completamente chiariti,
tuttavia possono includere un elevato livello di
chinasi a valle della via di segnale dell’EGFR, come per esempio di Akt e di proteina chinasica mitogenica attivata (MAPK). In questo senso, studi pre-clinici hanno dimostrato come alte concentrazioni d’erlotinib non solo inibiscono l’EGFR ma
anche Akt e MAPK, suggerendo che dosi più alte
d’erlotinib sono in grado di superare la resistenza al farmaco in pazienti con tumori con EGFR
espressi, accompagnati da un’up-regolation della
fosfatidilinositol 3’-chinasi e/o p-AKT o da una
down-regolation della fosfatasi e tensin omologhi
(PTEN)40.
Puntare l’Akt e la MAPK in associazione all’inibizione dell’EGFR-TK rimangono validi obiettivi per future ricerche.
I mezzi per questa doppia inibizione possono includere l’uso di una dose intermedia d’erlotinib,
somministrata più frequentemente di una volta a
settimana e ad una dose più alta della dose massima tollerata in somministrazione giornaliera, per
raggiungere picchi di concentrazioni più alta e, allo stesso tempo, per evitare fluttuazioni significative della concentrazione plasmatica. In alternativa,
la simultanea inibizione di EGFR, Akt e MAPK.
Considerazioni conclusive
1. Il tumore polmonare continua a rappresentare
la prima causa di morte per tumori nell’età
adulta. Nei pazienti affetti da carcinoma polmonare non a piccole cellule la sopravvivenza
a 5 anni è complessivamente intorno al 15%. In
quelli in stadio non chirurgico solo l’11% raggiunge i 2 anni di sopravvivenza. La chemioterapia non ha modificato che di pochi mesi la sopravvivenza di questi pazienti; per cui si rendono necessarie altre strategie terapeutiche.
2. La scoperta di gefitinib, erlotinib e di altri
farmaci con simile linea d’azione può contribuire a migliorare la risposta terapeutica.
Una attenta selezione dei pazienti in base: al
sesso (femminile), al tipo istologico (adenocarcinoma), alle abitudini al fumo (non fumatori) e alla dotazione di alterazioni citogenenetiche riguardanti le mutazioni del gene
che codifica per EGFR, consente un miglior
utilizzo di questi farmaci, con maggiore probabilità di risposta e rappresenta una linea
terapeutica da esplorare nei prossimi anni.
8
Recenti Progressi in Medicina, 99, 1, 2008
Bibliografia
1. Jemal A, Tiwari RC, Murray T, et al. Cancer statistics, 2004. Ca Cancer J Clin 2004; 54: 8-29.
2. Freddari F, Berardi R, Scarrozzi M, Cascinu S, Gridelli C. Il carcinoma del polmone non microcitoma:
patologia, biologia e prognosi. Tumori 2004; 3: S3-4.
3. Alberg AJ, Samet JM. Epidemiology of lung cancer.
Chest 2003; 123:1.
4. Pastorino U, Bellomi M, Bandoni C, et al. Early lung
cancer detection with spiral CT and positron emission tomography in heavy smokers: 2-years results.
Lancet 2003; 362: 593-7.
5. Langer CJ, Manola J, Bernardo P, Kugler JW, Bonomi P, Cella D et al. Cisplatin-based therapy for elderly patients with advanced non small cell lung
cancer: implications of Eastern Cooperative Oncology Group 5592, a randomized trial. J Natl Cancer
inst 2002; 94: 173-81.
6. Woods RL, Williams CJ, Levi J, et al. A randomised
trial of cisplatin and vindesine versus supportive care only in advanced non small cell lung cancer. Br J
Cancer 1990; 61: 608-11.
7. Kaasa S, Lund E, Thorud E, et al. Symptomatic
treatment versus combination chemotherapy for patient with extensive non small cell lung cancer. Cancer 1991; 67: 2443-7.
8. Callerino R, Tumarello D, Guidi F, et al. A randomised trial of alternative chemotherapy versus BSC
in advanced non small cell lung cancer. J Clin Oncol
1991; 9: 1453-61.
9. Cartei G, Cartei F, Cantone A, et al. Cisplatin- ciclophosphamide- mytomicin combination chemotherapy with supportive care versus supportive care
alone for treatment of metastatic non small cell
lung cancer. J Natl Cancer Inst 1990 ; 85: 794-800.
10. Quoix E, Dietemenn A, Charbonnaeu J, et al. La chimiotherapie comportant du cisplatin est elle utile
dans le cancer bronchique non microcellulaire au
stade IV? Resultats d’une étude radomisée. Bull
Cancer 1991; 78: 341-6.
11. Non Small Cell Lung Cancer Cooperative Group.
Chemotherapy in non small cell lung cancer: a meta-analysis from 52 randomised clinical trials. Br
Med J 1995; 331: 899-909.
12. Cullen MH, Billingham LJ, Woodroffe CM et al. Mytomicin ifosfamide cisplatin in unresectable non
small cell lung cancer: effects on survival and quality of life. J Clin Oncol 1999; 17: 3188-94.
13. American Society of Clinical Oncology. Clinical practice guidelines for the treatment of unresectable non
small cell lung cancer . J Clin Oncol 1997; 15: 29963018.
14. Pfister DG, Johnson DH, Azzoli CG, et al. American
Society of Clinical Oncology Treatment of Unresectable Non- Small-Cell Lung Cancer Guidelines: Update 2003. J Clin Oncol 2003; 22: 330-53.
15. Fossella FV, Lee JS, Murphy WK, et al. Phase II of
docetaxel for recurrent or metastatic Non Small Cell
Lung Cancer. J Clin Oncol 1994; 12: 1238-44.
16. Akeley W. Paclitaxel in advanced Non Small Cell
Lung Cancer. Chest 2000; 117: 152s-55s.
17. Crinò L, Scagliotti CV, Ricci S, et al. Gemcitabine
and Cisplatin versus Mitomycin, Ifosfamide, Cisplatin in advanced non small cell lung cancer. A randomized phase III study of the Italian Lung Cancer
Project. J Clin Oncol 1999; 17: 3522-30.
18. Prenzel N, Fischer OM, Streit S, et al. The epidermal growth factor receptor family as a central element for cellular signal transduction and diversification. Endocr Relat Cancer 2001; 8:11-31.
19. Ritter CA, Arteaga CL. The epidermal growth factor
receptor tyrosine kinase. A promising therapeutic
target in solid tumors. Semin Oncol 2003; 30: 3-11.
20. Hirsch FR, Varella-Garcia M, Bunn PA, et al. Epidermal growth factor receptor in non small cell lung
carcinomas: correlation between gene copy number,
protein expression and impact on prognosis. J Clin
Oncol 2003; 21: 2237-46.
21. Xia W, Lau YK, Zhang HZ, et al. Combination of EGFR, Her-2/neu and HER-3 is a stronger predictor for
the outcome of oral squamous cell carcinoma than
any individual family members. Clin Cancer Res
1999; 5: 4164-74.
22. Saltz LB, Meropol NJ, Lorhrer Sr PJ, et al. Phase II
trial of Cetuximab in patients with refractory colorectal cancer that expresses the epidermal growth
factor receptor. J Clin Oncol 2004; 22: 1201-8.
23. Cunningham D, Humblet Y, Siena S, et al. Cetuximab monotherapy and Cetuximab plus Irinotecan
in Irinotecan-refractory metastatic colorectal cancer.
N Engl J Med 2004; 351: 337-45.
24. Moulder SL, Yakes FM, et al. Epidermal growth factor receptor (HER1) tyrosine kinase inhibitor
Zd1839 (Iressa) inhibits HER2/neu (erb-2)-overexpressing breast cancer cells in vitro and in vivo. Cancer Res 2001; 61: 8887-95.
25. Lichtner RB, Menrad A, Sommer A, et al. Signalling-inactive epidermal growth factor receptor/ligand complexes in intact carcinoma cells by quinazoline tyrosine kinase inhibitors. Cancer Res 2001;
61: 5790-5.
26. Sirotnak FM, Zakowski MF, Miller VA, et al. Efficacy of cytotoxic agents against human tumor xenografts is markedly enhanced by coadministration of
ZD1839 (Iressa), an inhibitor of EGFR tyrosine kinase. Clin Cancer Res 2000; 6: 4885-92.
27. Ciardiello F, Caputo R, Bianco R, et al. Inhibition of
growth factor production and angiogenesis in human cancer cells by ZD1839 (Iressa), a selective epidermal growth factor receptor tyrosine kinase inhibitor. Clin Cancer Res 2001; 7: 1459-65.
28. Ranson M, Hammod LA, Ferry D, et al. ZD1839, a
selective oral epidermal growth factor receptor tyrosine kinase inhibitor, is well tolerated and active in
patients with solid tumors. Results of a phase I trial.
J Clin Oncol 2002; 20: 2240-50.
29. Fukuoka M, Yano S, Giaccone G, et al. Multi-institutional randomized phase II trial of gefitinib for
previously treated patients with advanced non
small cell lung cancer. J Clin Oncol 2003; 21: 223746.
30. Kris MG, Natale RB, Herbst RS, et al. Efficacy of gefitinib, an inhibitor of epidermal growth factor receptor tyrosine kinase, in symptomatic patients with
non small cell lung cancer. JAMA 2003; 290: 214958.
31. Giaccone G, Herbst RS, Manegold C, et al. Gefitinib
in combination with gemcitabine and cisplatin in advanced non small cell lung cancer: a phase III trialINTACT 1. J Clin Oncol 2004; 22: 777-84.
32. Herbst RS, Giaccone G, Schiller JH, et al. Gefitinib
in combination with paclitaxel and carboplatin in
advanced non small cell lung cancer: a phase III
trial- INTACT 2. J Clin Oncol 2004; 22: 785-94.
33. Inoue A, Saijo S, Maemondo M, et al. Severe acute
interstitial pneumonia and gefitinib. Lancet 2003;
361: 137-9.
34. Slamon DJ, Leyland-Jones BH, Shak S, et al. Use of
chemotherapy plus a monoclonal antibody against
HER2 for metastatic breast cancer that overexpresses HER2. N Engl J Med 2001; 344: 783-92.
J. Rosada et al.: Nuove strategie terapeutiche nel carcinoma polmonare non a piccole cellule metastatico
35. Ciardiello F, Bianco R, Caputo R, et al. Antitumor
activity of ZD6474,a vascular endothelial growth
factor receptor tytosine kinase inhibitor in human
cancer cells with acquired resistance to antiepidermal growth factor receptor therapy. Clin Cancer Res
2004; 10: 784-93.
36. Perez-Soler R, Chachoua A, Hammond LA, et al. Determinants of tumor response and survival with erlotinib in patients with non-small-cell lung cancer. J
Clin Oncol 2004; 22:3238-47.
37. Shepherd FA, Pereira JR, Ciuleanu T, et al. Erlotinib in previously treated non-small-cell lung cancer.
N Engl J Med 2005; 353: 123-32.
Indirizzo per la corrispondenza:
Dott. Massimo Bindi
Via Don Bosco, 4
56127 Pisa
E-mail: [email protected]
9
38. Miller VA, Kris MG, Shan N, et al. Bronchioloalveolar pathologic subtype and smoking history predict
sensitivity to gefitinib in advanced non small cell
lung cancer. J Clin Oncol 2004; 22: 1103-9.
39. Lynch TJ, Daphne WB, Sordella R, et al. Activating mutations in the epidermal growth factor receptor underlying responsiveness of Non-SmallCell Cancer to Gefitinib. N Engl J Med 2004; 350:
2129-39.
40. Milton DT, et al. A phase I/II study of weekly high-dose Erlotinib in previously treated patients
with nonsmall cell lung cancer. Cancer 2006; 107:
1034-41.