TUMORI DEL POLMONE
Distinzione
1. NSCLC: tumore del polmone non a
piccole cellule (85-90% diu tutti i tumori
del polmone)
2. SCLC: tumore del polmone a piccole
cellule (10-15% diu tutti i tumori del
polmone)
NSLC: Incidenza e Mortalità
Il cancro al polmone è la neoplasia più
comune al mondo
Negli uomini è il più comune, un caso su
cinque casi di tumore.
Nelle donne è il quarto tipo di tumore più
comune, dopo quelli al seno, al colon-retto
e allo stomaco.
NSLC: Incidenza e Mortalità
In Italia una progressiva diminuzione
dell’incidenza tra gli uomini con una
diminuzione percentuale annua stimata del
1.4% e una riduzione di mortalità legata al
tumore del polmone. Questa diminuzione è
presente nei gruppi di età più giovane, in cui
l’abbandono dell’abitudine al fumo è
maggiore.
Tra le donne sia l’incidenza (+ 1.2%
all’anno) che la mortalità (+ 0.9% all’anno)
sono in aumento.
NSLC: Incidenza e Mortalità in Emilia
Romagna
www.registro-tumori.it, dati aggiornati al 2007
NSLC: Incidenza e Mortalità in Emilia
Romagna
www.registro-tumori.it, dati aggiornati al 2007
NSLC: Sopravvivenza
Sopravvivenze a cinque
differenze tra i sessi.
anni
del
10%,
senza
La sopravvivenza relativa al cancro al polmone è
fortemente dipendente dall’età alla diagnosi, essendo
maggiore nei giovani rispetto ai pazienti anziani.
Nei gruppi di giovane età (15-44 anni) la sopravvivenza
relativa a cinque anni è del 18% rispetto al solo 6% nei
pazienti con età superiore ai 75 anni.
Negli stadi avanzati sopravvivenza a 5 anni del 1-2% ,
Negli stadi localizzati sopravvivenza a cinque anni
dalla diagnosi di circa il 30%
Fattori di Rischio
Il fumo di tabacco costituisce il più importante fattore di rischio e si
ritiene sia responsabile dell'85% dei casi osservati.
Il rischio relativo è in stretta relazione con il numero di sigarette/die
fumate, con la durata (in anni) dell'abitudine e con il contenuto di
catrame. Il rischio relativo dei fumatori rispetto ai non fumatori è
pari a 14 mentre quello dei forti fumatori (oltre le 20 sigarette al di')
è di 20 volte.
Sostanze di origine lavorativa
(Asbesto, Cromo, Arsenico, Berillio, Cloruro di Vinile, Idrocarburi
Aromatici Policiclici, Clorometiletere, Radon e altri) sono
riconosciute come carcinogeni polmonari che spesso, come nel
caso dell’amianto, potenziano il loro effetto in presenza di fumo di
tabacco.
Il ruolo dell'inquinamento atmosferico è oggi riconosciuto come
un importante fattore ma è ancora oggetto di studio e discussione.
NSCLC: Screening
Presupposti: elevata incidenza, la diagnosi precoce
migliora la sopravvivenza e il tasso di resecabilità
Svantaggi: elevato costo, elevato tasso di falsi positivi
(chirurgia inutile) e falsi negative (diagnosi ritardata),
elevata esposizioni a radiazioni ionizzanti
Sono in corso studi randomizzati per misurare
l’efficacia della TC spirale a basse dosi nel ridurre la
mortalità per cancro al polmone.
L’utilizzo di una TC spirale a basse dosi è da
considerarsi investigazionale con un’evidenza di livello
di tipo 3 per gli individui ad alto rischio
NSCLC: Diagnosi
Approssimativamente il 95% di pazienti che
presentano un tumore al polmone hanno dei sintomi
che frequentemente sono attribuiti ad effetti collaterali
del fumo.
Sintomi principali:
üTosse
üDispnea
üCalo ponderale
üEmottisi
üSindromi paraneoplastiche
üL’osteoarteropatia ipertrofica polmonare (clubbing
delle dita e l’ asimmetria dei periosti delle ossa lunghe
distali)
üIpercalcemia maligna
üDolore
Iter Diagnostico
La prima formulazione di una sospetto di una
carcinoma polmonare avviene solitamente sulla base
di un radiogramma toracico:
Le più comuni modalità di presentazione in un
radiogramma standard:
üLesione periferica solitaria
üAtelettasia polmonare (con senza versamento
pleurico)
üLesione addensante ilare con/senza infiltrazione del
mediastino senza segni di metastasi a distanza o di
versamento pleurico
üLesione metastatica singola o multiple a distanza
üVersamento pleurico.
Iter Diagnostico
ü
ü
ü
ü
ü
ü
ü
ü
ü
ü
E.O.
RX torace: esami di I istanza
Esame citologico dell'escreato (sensibilità del 66%, specificità 99%)
TC con MDC (valuta TNM, sensibilità complessiva del 57%, una
specificità dell’82% per N mediastino)
Fibrobronscopia con biopsia o agoaspirato transbronchiale
PET (sensibilità del 98.0% e di specificità dell’83.3%)
Agobiopsia transtoracica (sotto guida TC, per
lesioni periferiche)
Mediastinoscopia (per valutare N del mediastino
in pazienti candidabili all’intervento con TC/PET
+ o dubbia)
Mediastinotomia
VATS (per biopsia delle stazioni linfonodali,
particolarmente utile nei casi di tumore N3 e T4
(Stadio IIIB)
Stadiazione Clinica di Neoplasia
Accertata
ü
ü
ü
ü
ü
La definizione di estensione del fattore T la si ottiene mediante
radiografia del torace, TC toracica e fibrobroncoscopia.
RM trova giustificazioni in casi estremamente selezionati al fine
di valutare le strutture di confine (parete toracica, diaframma,
apice polmonare, mediastino )
La valutazione di N richiede TC e/o RM e/o PET, agoaspirato
transbronchiale e mediastinoscopia, mediastinotomia e
videotoracoscopia.
L'accurata determinazione dell'estensione dell'interessamento
linfonodale costituisce il più importante
fattore per la scelta terapeutica e per la
sopravvivenza a lungo termine dopo
chirurgia radicale.
Scintigrafia ossea, TC o ecografia
addome per la valutazione del M, TC
encefalo su indicazione clinica
Classificazione TNM
Classificazione TNM
Lung Cancer Survival by Pathologic
Stage: Iaslc New Classification
Goldstraw et al. JTO: 2: 706-714. 2007
Lung Cancer Histotypes
NSCLC ~80%
The Need of a Right Sample Tissue
Biopsy Techniques in Lung Cancer Diagnosis
ü
Sputum cytology
ü
Bronchial brushings and washings
ü
Fluids
ü
FNA – cytology – primary or mets
ü
Transbronchial biopsy
ü
Bronchial Biopsy
ü
Core biopsy – primary or mets
ü
Liver biopsy
ü
Mediastinoscopy
ü
Lymph node excision
ü
VATS biopsy / resection
ü
Thoracotomy & tumour excision
Kerr K., 2008
Fattori Prognostici in NSCLC
Clinical factors
Biologic factors
üAge
üEGFR
üSex
üPS
üKRAS
Tumour factors
Pharmacogenetic factors
üHistology
üERCC1
üStage
üRRM1
üTS
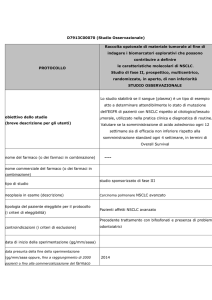
The Prognostic and Predictive Role of
Histology in Advanced Non-Small Cell
Lung Cancer
Historically, histologic subtype has not reliably been shown
to have prognostic importance in advanced NSCLC.
Although histologic subtypes are often described for patients
with NSCLC enrolled in clinical trials, analyses that examine
a potential association between histology and efficacy
outcomes are often not reported.
FR Hirsch et al, JTO 2009
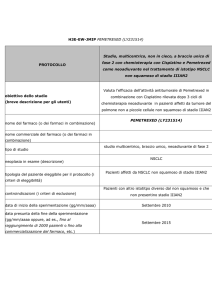
Histology and Pemetrexed
Table 1. Phase III Randomized Trials in Non-small Cell Lung
Cancer Showing a Superior Activity of Pemetrexed in Nonsquamous Histology
GV Scagliotti , ED ASCO 2009
TS mRNA Expression in Lung Cancer Cells
Scagliotti G, ASCO 2009
Potential oncogenic “drivers” in nonsmall cella lung cancer (NSCLC)
Bang Y, PASCO 2010
Potential EGFR TKI’s Predictive Markers
Clinical Predictive
Markers
Biological Predictive
Markers
Habits: never smoker
EGFR protein (IHC)
Histology: adeno and BAC
EGFR gene copy (FISH)
Gender: female
EGFR mutation
Race: Asian
K-RAS mutation
Opzioni Terapeutiche
Stage
%
IA
IB
II
III A
III A
N2
20-25
5y-S%
Surgery
55-70
Surgery ±
Adjuvant Treatment
30-35
III B
IV
Terapeutical
Strategy
50-40
25-40
Neoadjuvant Treatment +
Surgery ± Adjuvant Treatment
10-25
Chemotherapy + Radiotherapy
10-20
Chemotherapy ± Biologics +
BSC
<10
Correlazione fra Stadio TNM e Scelta
Terapeutica
Stadio I, II e IIIA “non bulky”
ü
Lobectomia per lesioni periferiche.
ü
Exeresi sublobare per
funzionale respiratorio
ü
Pneumonectomia o lobectomia con broncoplastica
per le lesioni centrali
ü
Nei pazienti anziani ( > 71 anni) la lobectomia non
da nessun vantaggio rispetto alla resezione
limitata. ( Mery, Chest 2005)
pazienti
con
deficit
Stadio I A e B
T1-2a N0 M0
La chirurgia è il trattamento di scelta
(mortalità è postoperatoria 3-5%)
% recidiva locale < lobectomia vs
resezione
Pazienti inoperabili o con insufficiente
riserva
polmonare
o
con
controindicazioni
mediche
all’intervento sono candidati a RT con
intento curativo (Noordijk Radiother
Oncol 1988; Dosoretz, Int J Radiat
Oncol Biol Phys 1992)
Stadio II
T1-2, N1, M0
T2b-T3 N0 M0
La chirurgia è il trattamento di scelta (mortalità
postoperatoria 3-5%)
è
Pazienti inoperabili o con insufficiente riserva polmonare o
con controindicazioni mediche all’intervento sono candidati a
RT con intento curativo (Noordijk Radiother Oncol 1988;
Dosoretz, Int J Radiat Oncol Biol Phys 1992)
Chemioterapia adiuvante con schemi contenenti platino
RUOLO DELLA
CHEMIOTERAPIA
POSTOPERATORIA
Perche’ la Chemioterapia Adiuvante?
1.
Poor survival after surgery
2.
Positive results from clinical trials
3.
Positive results from meta-analysis
4.
Follow-up confirmation
5.
NVB-CDDP reverses the trend of poor outcome of ADK
6.
Positive comparison with other adjuvant setting
7.
Easy patients selection
8.
Well established treatment strategy
9.
Cheaper treatment in lung cancer
10. Strongly recommended by international guidelines
Adjuvant CT Trials in NSLCL
Synopsis of Results by Stage
Trial/Stage
IA
IB
II
IALT
JBR.10
4 cm ?
ANITA
LACE MA
Positive
Negative
IIIA
Lung Adjuvant Cisplatin Evaluation
A pooled analysis by the LACE collaborative group
Stadio III A
T1-2 N2 M0
T3 N1-2 M0
T4 N0-1 M0
Terapia chirurgica (se possibile) + CT adiuvante o RT
adiuvante
RT + Chemioterapia (definitiva)
RT adiuvante: dati controversi su OS ma miglior controllo
locale (Emami Am J Clin Oncol 1997, Sawyer Ann Thorac
Surg 1997, Keller NEJM 2000)
Trattamento neoadiuvante (CT + RT) Rosell NEJM 1994,
Roth J Natl Cancer Inst 1994, Albain J Clin Oncol 1995
Stadio III A
Le possibilità della terapia chirurgica in questo stadio devono
tener conto dell' entitá dell'estensione del tumore primario e del
grado di interessamento linfonodale
Se il linfonodo metastatico è singolo e sono tecnicamente
resecabili sia il linfonodo, sia il tumore primitivo, si esegue
resezione insieme ad una linfoadenectomia mediastinica
Nel caso di invasione neoplastica della parete toracica o
diaframma o pleura mediastinica o pericardio si esegue una
lobectomia con resezione "en bloc" della struttura interessata.
Qualora il tumore giunga ad interessare i bronchi principali si
può eseguire un intervento di sleeve lobectomy o di sleeve
pneumonectomy
Non esistono evidenze cliniche conclusive che dimostrino la
superiorità della linfoadenectomia ilomediastinica sistematica
rispetto al semplice campionamento (sampling) linfonodale.
Stadio III A (N2)
POTENZIALMENTE RESECABILE à Terapia di
induzione o neo – adiuvante: chemioterapia o
chemioterapia + radioterapia.
NON RESECABILE à no chirurgia; radioterapia
+ chemioterapia
Algoritmo Clinico per CT Adiuvante
Stadio II-IIIA
üEtà
< 70-75 anni
üEtà
> 70-75
üPS
0-1
üPS
>1
üNo
comorbidità
üComorbidità
üIntervallo
< 40 giorni
üCompleto
recupero
üEsiti
üCompleta
informazione
üScarsa
üERCC1
Negativo (?)
CT adiuvante
üIntervallo
(cardiovascolare)
> 40 giorni
post-chirurgici o com.
üERCC1
informazione
positivo (?)
Follow-up
Stadio III B
any T, N3, M0
T4, any N, M0
Chemioterapia + Radioterapia (Le Chevalier, J Natl Cancer
Inst 1991) (Dillman, NEJM 1990) (Pfister, J Clin Oncol
2004
Chemioterapia + radioterapia concomitante à chirurgia
(Rusch J Thorac Cardiovasc Surg 1993) (Albain J Clin
Oncol 1995)
Chemioterapia
Radioterapia palliativa (Langendijk, Int J Radiat Oncol Biol
Phys 2000) (Sundstrøm J Clin Oncol 2004)
Systemic Therapy for NSCLC in 2014
Proposed Treatment Algorithm
EGFR mutation positive
or ALK positive
Erlotinib,
gefitinib,
afatinib,
or crizotinib
Good PS
Nonsquamous
Bevacizumab eligible
Poor PS
Squamous
Single-agent
or combination
chemotherapy
Bevacizumab ineligible
First line
Platinum/pemetrexed
(or other*) ± bevacizumab
Platinum/pemetrexed
(or other*)
Bevacizumab, erlotinib ,
pemetrexed or observation
Progression
Based on prior
therapy
Based on prior
therapy
Based on Prior
Therapy
Based on prior therapy
*With docetaxel, paclitaxel, gemcitabine, vinorelbine.
Updated from Gandara DR, et al. Clin Lung Cancer. 2009;10:392-394.
Second
line
Chemotherapy by
algorithm
Erlotinib or pemetrexed
or observation
Maintenance
End of first-line chemotherapy
A-NSCLC Therapy Significant Milestones
in 1st-Line
Median survival (months)
12 ----------------------------------------------------------------------------10 -------------------------------------8
P
6–8 ms
6
P-based
doublets
8–10 ms
Cb-PAC
+
Cis-VNB
BEVA 12.5
+
ms in
CTXB 11.3
selected
ms in
NSQ
EGFR +
PEM /cis
12.6 ms in
ADC
4
2
BSC
2–4 ms
0
1970
1980
1990
2007
2008
2009
Changes in the Therapeutic Landscape of
Stage IV Lung Cancer: 2002-2014
HER2
EGFR mutants
ALK
ROS/RET BRAF
KRAS
KRAS
Adeno
LCC-NOS
SCC
SCLC
First-line Treatment With EGFR TKIs vs
Chemotherapy in EGFR-Mutated Patients
Study
Treatment
N
Median PFS,
Mos (P Value)
Median OS,
Mos (P Value)
Gefitinib vs carbo/pac
230
10.8 vs 5.4
(< .001)
30.5 vs 23.6
(.31)
Gefitinib vs cis/doc
177
9.2 vs 6.3
(< .0001)
36 vs 39
(.443)
Erlotinib vs carbo/gem
165
13.7 vs 4.6
(< .0001)
22.7 vs 28.9
(.69)
Erlotinib vs plt-based
CT
174
9.7 vs 5.2
(< .0001)
19.3 vs 19.5
(.87)
LUX-Lung 3[8]
Afatinib vs cis/pem
345
11.1 vs 6.9
(.001)
Not reported
LUX-Lung 6[9]
Afatinib vs cis/gem
364
11.0 vs 5.6
(< .0001)
Not reported
NEJ002[1,2]
WJTOG3405[3,4]
OPTIMAL[5,6]
EURTAC[7]
Meta-analysis of Randomized First-line EGFR
TKI Studies: Improved PFS
Study
HR
(95% CI)
HR
(95% CI)
EGFRmut (first-line therapy)
EURTAC
0.37 (0.25-0.54)
First-SIGNAL
0.54 (0.27-1.10)
GTOWG
1.08 (0.24-4.90)
INTACT1-2
0.55 (0.19-1.60)
IPASS
0.48 (0.36-0.64)
LUX LUNG3
0.58 (0.43-0.78)
NEJ002
0.32 (0.24-0.44)
OPTIMAL
0.16 (0.11-0.26)
TALENT
0.59 (0.21-1.67)
TOPICAL
0.90 (0.39-2.06)
TRIBUTE
0.49 (0.20-1.20)
WJTOG3405
0.52 (0.38-0.72)
Subtotal
0.43 (0.38-0.49)
Favors EGFR TKI
Lee CK, et al. J Natl Cancer Inst. 2013;105:595-605
Favors Chemo
Crizotinib in ALK-Positive NSCLC: Efficacy
PROFILE 1001[1]
(N = 143)
PROFILE 1005[2]
(N = 259)
PROFILE 1007[3]
(N = 173)
CR
3 (2)
4 (2)
1 (1)
PR
84 (59)
151 (58)
112 (65)
SD
31 (22)*
69 (27)
32 (18)
PD
NR
19 (7)
11 (6)
Objective response rate, % (95% CI)
60.8 (52.3-68.9)
59.8 (53.6-65.9)
65 (58-72)
Median duration of response,
wks (95% CI)
49.1 (39.3-75.4)
45.6 (35.3-53.6)
32.1 (2.1-72.4)†
Median duration of treatment,
wks (range)
43.1 (0.1-138.6)
N/A
15.9 (2.9-73.4)
9.7 (7.7-12.8)
8.1 (6.8-9.7)
7.7 (6.0-8.8)
Outcome
Best overall response, n (%)
Median PFS, mos (95% CI)
*At Wk 8.
†Range.
Targeted Therapy Focuses on Driver
Gene Alterations: “Oncogenic Addiction”
EGFR mutants
Activity
ALK
ROS/RET
Gefitinib[1,2]
Erlotinib[3,4]
Afatinib[5,6]
EGFR
EGFR
EGFR
(ErbB family)
Target
EGFR
Crizotinib[7-9]
ALK, ROS1,
MET
ALK
RR, %
60-80
50-80
~ 60
~ 60
PFS, mos
10-11
10-14
~ 11
~ 10
NSCLC Adenocarcinoma: Beyond EGFR
Mutations and ALK Translocation
MET amp ERBB2 amp
(0.9%)
RIT1
(2.2%)
(2.2%)
NF1
HRAS (0.4%)
NRAS (0.4%)
RET fusion (0.9%)
MAP2K1 (0.9%)
ALK fusion (1.3%)
ROS1 fusion (1.7%)
ERBB2 (1.7%)
None
8.3%
24.4%
MET ex14
4.3%
7.0%
BRAF
11.3%
EGFR
Govindan R. ISLAC 2013. Abstract PL05.1.
32.2%
KRAS
Lung Cancer Mutation Consortium:
OS by Mutation and Treatment
100
OS (%)
80
60
40
Driver mutation + targeted therapy (n = 313)
Driver mutation + no targeted therapy (n = 265)
No driver mutation (n = 361)
20
0
0
1
2
3
Yrs
Johnson B, et al. ASCO 2013. Abstract 8019.
4
5
Changes in the Therapeutic Landscape of
Stage IV Lung Cancer: 2002-2014
Histology still guides the therapeutic
choice for the vast majority of patients
KRAS
KRAS
Adeno
LCC-NOS
SCC
Changes in the Therapeutic Landscape of
Stage IV Lung Cancer: 2002-2014
Histology still guides the therapeutic
choice for the vast majority of patients
KRAS
KRAS
NON-SQUAMOUS NSCLC
Adeno
LCC/NOS
SCC
Refining the IHC Diagnosis of NSCLCNOS
NSCLC
60% to 75%
of cases
87%
accuracy
Squamous
80%
accuracy
Adenoca
Occasional
rare types
NSCLC
probably squamous
~ 20% to 35%
of cases
overall
83%
accuracy
NSCLC
probably adeno
NSCLC-NOS
Immunohistochemistry
to predict subtype
NSCLC-NOS
IHC not predictive
TTF1, p63, CK5/6 & AB/PAS
25% to 40%
of cases
6% of cases
overall
50% Adenoca
37% Large cell
13% Squamous
when resected
C/P vs C/G in Advanced NSCLC: OS by
Histology
Squamous
Median Survival
C/P 11.8 mos
C/G 10.4 mos
C/P vs C/G Adjusted HR: 0.81
(95% CI: 0.70-0.94)
1.0
0.9
0.8
0.7
0.6
0.5
0.4
0.3
0.2
0.1
0
0
6
12
18
Mos
24
30
Scagliotti GV, et al. J Clin Oncol. 2008;26:3543-3551.
Survival Probability
Survival Probability
Nonsquamous
Median Survival
C/P 9.4 mos
C/G 10.8 mos
C/P vs C/G Adjusted HR: 1.23
(95% CI: 1.00-1.51)
1.0
0.9
0.8
0.7
0.6
0.5
0.4
0.3
0.2
0.1
0
0
6
12
18
Mos
24
30
OS by Histology in Phase III Pemetrexed
Studies
NSCLC Histology
Second-line
Pem vs Docetaxel[1]
First-line Pem/Cis
vs Gem/Cis[1]
Maintenance
Pem vs Placebo[2]
Pem
Doc
Cis/Pem
Cis/Gem
Pem
Placebo
Nonsquamous,* n
205
194
618
634
325
156
Median OS, mos
9.3
8.0
11.0
10.1
15.5
10.3
Adjusted HR
(95% CI; P value)
0.78 (0.61-1.00;
.048)
Squamous, n
0.84 (0.74-0.96;
.011)
0.70 (0.56-0.88;
.002)
78
94
244
229
116
66
Median OS, mos
6.2
7.4
9.4
10.8
9.9
10.8
Adjusted HR
(95% CI; P value)
1.56 (1.08-2.26;
.018)
1.23 (1.00-1.51;
.050)
*Adenocarcinoma, large cell carcinoma, or other/indeterminate NSCLC histology
1.07 (0.77-1.50;
.678)
Heterogeneity of ERCC1, RRM1, and TS
mRNA Expression in NSCLC
ERCC1
RRM1
TS
10
10
8
8
8
6
6
6
4
4
4
2
2
2
0
0
0
Gene Expression Level
Relative to β-actin
10
AC
AC
SCCA
SCCA
AC
SCCA
ERCC1
(Reference < 1.7
for platinum)*
% Below
Reference
Level
RRM1
(Reference < 0.97
for gemcitabine)*
% Below
Reference
Level
TS
(Reference < 2.33
for pemetrexed)*
% Below
Reference
Level
NSCLC-total
43.4
NSCLC-total
39.6
NSCLC-total
41.3
NSCLC-AC
46.0
NSCLC-AC
42.2
NSCLC-AC
45.7
NSCLC-SCCA
30.7
NSCLC-SCCA
13.0
NSCLC-SCCA
25.9
*Gene expression level cutoff for drug sensitivity.
Meta-analysis of NSCLC Maintenance
Therapy: OS
Continuation Maintenance
Brodowicz 2006
Perol 2010
Belani 2010
Barlesi 2011
Paz-Ares 2012
0.2
1.1 Cytotoxic Agents
Ciuleanu 2009
Fidias 2009
HR: 0.82
(95% CI: 0.66-1.01;
P = .06)
0.5
1
2
Peto Odds Ratio
Exp[0-E)/V], Fixed, 95% CI
Study or Subgroup
Peto Odds
Ratio Exp[O-E/V],
Fixed, 95% CI
Study or
Subgroup
Switch Maintenance
5
Favors
Favors
Experimental Control
7 trials report no detrimental effect on QOL
HR: 0.80
(95% CI: 0.63-1.01);
P = .06)
1.2 Molecularly Targeted Agents
Cappuzzo 2010
Gaatar 2010
Perol 2010
Zhang 2012
Total
HR: 0.80 (95% CI: 0.72-0.92);
P =.0002)
HR: 0.81
(95% CI: 0.71-0.92);
P = .001)
0.2
0.5 1
2
5
Favors Switch Favors
Maintenance Control
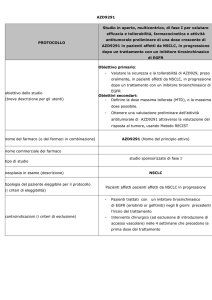
CHEMIOTERAPIA DI I LINEA
Clinical Recommendations
Non – small – cell lung cancer: ESMO clinical
recommendations for diagnosis, treatment and follow-up
G. D’Addario1 & E. Felip2
On behalf of the ESMO Guidelines Working Group
1
Onkologie Schaffhausen, Schaffhausen, Switzerland;
Medical Oncology Service, Vall d’Hebron University Hospital, Barcelona, Spain
2
Treatment of stage IV disease
üTwo-drug, platinum-based chemotherapy combined with
vinorelbine, gemcitabine or a taxane prolongs survival, improves
quality of life and controls symptoms in patients with good
performance status [I, A]. Non – platinum combination
chemotherapy can be considered in patients who are fit to
receive platinum agents. In first – line metastatic EGFR –
mutated patients EGFR TKIs treatment may be contemplated.
Annals of Oncology 19 (Supplement 2): ii39– ii40, 2008
doi:10, 1093/annonc/mdn 081
Treatment Decision
Age
üYoung vs Elderly
Biology
üEGFR mut, ERCC1
PS
ü0-1 vs 2
Toxicities of previous regimen*
üMild vs moderate vs severe
Comorbidities
üNone/mild vs Moderate/severe
Response to previous treatment*
üPR/CR vs SD vs PD
Strategies
üContinuous therapy vs holidays
w/o CT
Time to progression*
üShort vs long
Costs
üCheap vs expensive
* Only for second line and subsequent lines
SCLC
SLC: Incidenza e Mortalità
La sopravvivenza mediana senza trattamento è di 3 mesi per
la malattia limitata e di un mese e mezzo per quella estesa
Nella popolazione maschile europea il tasso di incidenza
annuale di tumore a piccole a cellule (standardizzato per l’età)
varia da piu’ di 15 (Olanda, Slovenia, Estonia, Sud della
Spagna, Croazia, Germania) a meno di 2 (a Ragusa e Lat
via);nelle donne il tasso varia da piu’ di 5 a meno di 1 .
Fattori di Rischio
1. Il fumo di tabacco.
2. Sostanze di origine lavorativa
(Asbesto, Cromo, Arsenico, Berillio, Cloruro di Vinile, Idrocarburi
Aromatici Policiclici, Clorometiletere, Radon e altri) sono
riconosciute come carcinogeni polmonari che spesso, come nel
caso dell’amianto, potenziano il loro effetto in presenza di fumo
di tabacco.
3. Il ruolo dell'inquinamento atmosferico è oggi riconosciuto come
un importante fattore
ma è ancora oggetto di studio e
discussione.
Istologia
ü
Il SCLC è caratterizzato da piccole cellule rotonde di
piccole dimensioni, con nuclei colorati e scarso citoplasma
ü
Alto tasso di mitosi
ü
Ampia necrosi tumorale
ü
Immuoistochimica: differenziazione neuroendocrina
ü
Diagnosi differenziale dai tumori neuroendocrini del
polmone (carcinoidi, carcinoidi atipici etc)
SCLC: Diagnosi
Piu’ dell’80% dei pazienti con SCLC riferiscono che I sintomi
sono comparsi da 3 mesi o meno
Sintomi principali:
üTosse
üDispnea
üCalo ponderale
üDolore toracico
üSindromi paraneoplastiche (sindrome da inappropriata
secrezione di ADH (11%), la sindrome di Cushing (2.4%) e la
sindrome di Eaton Lambert ).
üSindrome mediastinica
üDisfagia
üRaucvedine
üDolore
SCLC: Diagnosi
Al momento della diagnosi 2/3 dei pazienti hanno malattia
metastatica, all’osso (30%), al fegato (25%),al midollo osseo
(25%) o al SNC (10%). I sintomi legati alle metastasi a
distanza possono o meno essere presenti.
Il SCLC solitamente si presenta come una lesione di grandi
dimensioni, a rapido accrescimento, a partenza dal parter
centrale dei grossi bronchi e con invasione rapida del
mediastino.
Iter Diagnostico
La prima formulazione di una sospetto di una carcinoma
polmonare avviene solitamente sulla base di un radiogramma
toracico.
Le più comuni modalità di presentazione in un radiogramma
standard:
üSi presenta una grossa massa centrale,
üSegni di invasione mediastinica.
üCome screening la lastra del torace ha una sensibilità del 4550%
Iter Diagnostico
La citologia su espettorato ha una sensibilità del 25-30%,
Rx Torace e citologia su espettorato ha una sensibilità del 6070%
Marker Tumorali (NSE e Cromogranina): non sono utili nell’iter
diagnostico a causa della loro scarsa sensibilità e specificità.
sono elevati nel 60-65 % dei casi.
Iter Diagnostico
Fibrobroncoscopia: permette di eseguire una biopsia ed il
lavaggio bronchiale (sensibilità è piu’ dell’80 %).
L’aggiunta di un agoaspirato con ago fine (EBNA) alla biopsia
ed al lavaggio bronchiale può incrementare la sensibilità fino al
90%.
Difficile agobiopsia TC-guidato: lesioni centrali difficilmente
raggiungibili per via transtoracica.
Iter Diagnostico
II Opzioni
Video-toracoscopia à per lesioni periferiche o linfonodi
mediastinici
Mediastinoscopia
à biopsia escissionale dei linfonodi del
mediastino anteriore o
lesione perilari
Stadiazione Clinica di Neoplasia
Accertata
La definizione di estensione del fattore T (la si ottiene mediante
radiografia del torace, TC toracica e fibrobroncoscopia.
La valutazione di N richiede TC torace
La valutazione di M richiede TC addome e torace
Scintigrafia ossea,
TC encefalo o RMN encefalo
Classificazione TNM
Il sistema di stadiazione convenzionale
Il SCLC è tradizionalmente classificato in limitato o esteso.
La definizione di malattia limitata è basata sulla fattibilità di
trattare completamente il tumore con un trattamento
radioterapico.
Classificazione TNM
Malattia limitata
La definizione di malattia limitata include pazienti con
malattia localizzata all’emitorace con metastasi linfonodali
regionali (includendo i linfonodi ipsilaterali e controlaterali,
mediastinici e sopraclaveari) e senza versamento pleurico.
L’interessamento del nervo ricorrente e della vena cava
superiore sono considerate malattia limitata. Recentemente,
pazienti con interessamento mediastinico controlaterale e/o
sopraclaveare e/o versamento pleurico omolaterale sono
stati inclusi in questo gruppo in quanto hanno una prognosi
migliore dei pazienti con metastasi a distanza.
Classificazione TNM
Malattia estesa
La malattia estesa rappresenta qualsiasi tumore oltre i limiti
definiti sopra
Fattori Prognostici e Predittivi
Una malattia in stadio limitato è il più importante fattore
prognostico positivo.
Il Performace status
Metastasi epatiche, ossee ,midollari e/o encefaliche
Un’elevato livello di LDH e ALP, bassi livelli di sodio o
albumina o emoglobina sono associati ad una cattiva
prognosi.
Trattamento del SCLC Limitato
ü
Chemioterapia e radioterapia sequenziale
ü
Chemioterapia e radioterapia concomitante
ü
Radioterapia esclusiva nei pazienti unfit
ü
Chirurgia in casi molto selezionati ( stadio I con N0 e
buon PS)
ü
WBRT ( radioterapia panencefalica ) profilattica in tutti i
pazienti in risposta completa, gli ultimi studi clinici
suggeriscono un beneficio anche nei pazienti in risposta
parziale e buon performance status
Trattamento del SCLC Limitato
ü
Chemioterapia e radioterapia concomitante più efficace
della Chemioterapia e radioterapia sequenziale ma con
un peggior profilo di tossicità ( da preferire quindi nei
pazienti in buon performance status )
ü
Chemioterapia di riferimento: Cisplatino ed Etoposide
ü
Valida opzione : carboplatino ed Etoposide nei pazienti
con Insufficienza renale o ridotto PS
ü
Monoterapia nei pazienti unfit : preferire platino
Trattamento del SCLC Avanzato
La probabilità di essere curativi per i pazienti con tumore a
piccole cellule metastatico è bassa con meno del 5% di
sopravvivenza a 5
anni. Il trattamento dev’essere
considerato palliativo nella maggior parte degli individui. La
chemioterapia combinata migliora la sopravvivenza media
ed è anche in grado di migliorare i sintomi nel 50% dei
pazienti con versamenti pleurici, nell’80% dei pazienti con
sindrome della vena cava superiore e nel 70% dei pazienti
con polmone atelattasico.
La radioterapia associata alla chemioterapia è in grado di
ridurre la progressione di malattia in sede toracica senza
alterare pero né la sopravvivenza libera da malattia né la
sopravvivenza globale.
Trattamento del SCLC Avanzato
ü
Chemioterapia di riferimento: Cisplatino ed Etoposide
ü
4-6 cicli totali
ü
Valida opzione : carboplatino ed Etoposide nei pazienti
con Insufficienza renale o ridotto PS
ü
Monoterapia nei pazienti unfit : preferire platino
ü
Radioterapia WBRT o sul torace utili per il controllo dei
sintomi
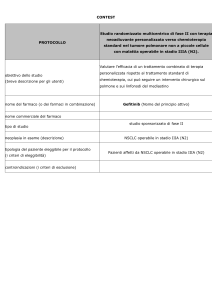
Trattamento del SCLC Avanzato in
Recidiva o Progressione Dopo I Linea
ü
II linea in caso di Platino refrattari o platinoresistenti
(recidiva entro 3 mesi dal termine della chemioterapia
con platino)
•
CAV (cisplatino/adriamicina/alcaloidi
Elevata tossicità
•
Topotecan : elevata mielotossicità
ü
Rintrodurre platino nei tumori con un lungo intervallo
libero da progressione
ü
Radioterapia a scopo palliativo
della
vinca):