I gas
• Gas ideali
• Gas reali
• Umidità
Tavola periodica
Notazione:
A
ZX
Z ⇒ numero atomico ≡ numero di protoni
definisce l’elemento chimico
A ⇒ numero di massa ≡ numero di nucleoni (protoni + neutroni)
Isotopi: atomi con stesso Z ma A diverso
(es: 12C e 14C)
Massa Atomica e Molecolare
Massa atomica (o molecolare) M
Rapporto tra la massa di un atomo (molecola) e la dodicesima parte
della massa dell’atomo 12C. Si misura in unità di massa atomica (uma)
⇒ massa atomica del 12C: M=12 uma
In pratica:
• la massa atomica di un elemento chimico ha un valore (espresso in
uma) circa pari al numero di massa A;
Es: MO ≈ 16 uma;
MN ≈ 14 uma
• la massa molecolare di un composto chimico è pari alla somma delle
masse atomiche di ciascun elemento del composto
Es: MCO2 ≈ (12+2×16) uma = 44 uma
La Mole
Mole (grammoatomo o grammomolecola)
Quantità di sostanza corrispondente alla massa molecolare espressa
in grammi.
• Esempio: 1 mole di H2O corrisponde a circa (2×1+16)g=18g di acqua.
• 1 uma = 1 grammo/mole
• Una mole di una qualsiasi sostanza contiene lo stesso numero di
atomi o molecole (numero di Avogadro):
NA=6,02·1023 mole-1
Quindi:
numero di moli n =
massa espressa in grammi m
massa atomica o molecolare M
numero di molecole N = (num. di Avogadro NA)×(num. di moli n)
Esempio:
Data una massa m = 8,8 mg di CO2, calcolare:
1) il numero di moli
[R.
n = 2 ⋅10 −4 moli
[R.
N = 12,04 ⋅1019
]
2) il numero di molecole
]
Gas Perfetto (ideale)
Idealizzazione:
• volume occupato dalle molecole è trascurabile;
• forze di attrazione tra molecole sono trascurabili;
• gli urti tra molecole sono elastici:
urti elastici
urti non elastici
In pratica:
ogni gas a temperatura elevata e molto rarefatto si
comporta come un gas ideale.
Equazione di stato di un gas ideale
Se il gas ideale è in equilibrio (p,V e T non variano)
pV = n ⋅ R ⋅ T
numero di moli
temperatura assoluta (K)
R è la costante dei gas perfetti
J
R = 8,32
K ⋅ mole
Sistema
Internazionale
litri ⋅ atm
= 0.082
K ⋅ mole
Unità pratiche:
volume
⇒ litri
pressione ⇒ atm
Equazione di stato di un gas ideale
• Se T = costante:
p
T2 > T1
p·V = costante
(Legge di Boyle)
curve isoterme
T1
T2
V
• Se t = 0 oC, p = 1 Atm
(condizioni NTP) ed n = 1 :
litri ⋅ atm
1 mole ⋅ 0.082
⋅ 273 K
nRT
K ⋅ mole
V=
=
= 22,4 litri
p
1 atm
Legge di Avogadro: “Una mole di gas ideale a t = 0 oC e
pressione p = 1 atm occupa un volume pari a 22,4 litri.”
Miscela di gas
Sia dato una miscela di gas in un recipiente di volume V a temperatura T:
RT
=
p
n
• Pressione parziale del componente i-esimo
i
i
V
è la pressione che eserciterebbe il costituente i se da solo occupasse tutto il volume.
• Legge di Dalton: la pressione totale di una miscela di gas è pari alla
somma delle pressioni parziali di ciascun componente della miscela:
RT
RT
= (n1 + n2 + L)
= p1 + p2 + L
V
V
ni
pi =
p
Frazione molare (%)
n
p=n
ovvero
Esempio: aria a 15 oC, p = 1 atm, al livello del mare:
Componente
fr. molare
Componente
fr. molare
Azoto (N2)
78,00 %
Argon (Ar)
0,97 %
Ossigeno (O2)
20,93 %
An. Carbonica (CO2)
0.03 %
+ vapore acqueo (0,1 % ÷ 2 %)
Gas Reale
Curve isoterme
liquido
Se T è maggiore della
temperatura critica
(Tc) il gas non può in
alcun modo passare
alla fase liquida !
p
Pressione di
vapore saturo pvs
(tensione di vapore)
dipende da T
T > Tc
vapore saturo
liquido e vapore in
equilibrio
Gas
Tc (oC)
gas
Gas
o
vapore
Tc
T < Tc
V
Tc(oC)
N2
-147,1
H2O
+347,1
CO2
+31,3
N2O
+39,5
O2
-118,8
aria
-141,0
Gas reale ⇒ gas perfetto quando:
• T >> Tc ;
• grande volume e bassa pressione.
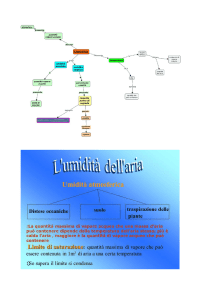
Umidità
t (oC)
pvs (mmHg)
0o
4,58
10o
9,2
20o
17,55
37o
47,20
100o
760
200o
11618
Equilibrio
liquido-vapore
H2O
• Umidità assoluta: quantità di vapore acqueo in in m3 di aria (g/m3)
• Umidità relativa U.R. (%):
pressione parziale del vapore acqueo pH 2O
U.R. =
=
pressione di vapore saturo
Pvs
• Punto di rugiada: quando il vapore acqueo comincia a condensare
⇒ U.R. = 100%
Umidità
Esempio:
nH 2O
n
U.R. ( 20 o C) =
= 1% ⇒
pH 2O = patm ⋅
nH 2O
n
= 7,6 mmHg
7,6 mmHg
= 43 %
17,55 mmHg
7,6 mmHg
U.R. (10 C) =
= 83 %
9,2 mmHg
o
U.R. (0 o C) =
7,6 mmHg
= 165 %
4,58 mmHg
Il vapore condensa tra
10 oC e 0 oC (rugiada)
L’umidità relativa in una stanza diminuisce all’aumentare della
temperatura (aria diventa più secca):
⇒ evaporazione dei liquidi più veloce;
⇒ occorre “umidificare” l’aria.