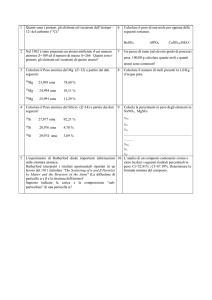
MASSA ATOMICA
Le masse atomiche in grammi sono valori troppo piccoli. Ad esempio, la massa di
carbonio -12 corrisponde a 1,99 * 10 -26 kg. Non è conveniente, da un punto di vista
pratico usare numeri così piccoli. E’ più conveniente usare masse atomiche relative,
cioè masse atomiche che sono rapportate ad una grandezza di riferimento.
I chimici hanno introdotto una opportuna massa di riferimento che è l’unità di massa
atomica uma che corrisponde alla dodicesima parte della massa di un atomo di
carbonio-12, ovvero a 1,66 *10-27 kg (che è lo stesso peso di un singolo protone o di
un singolo neutrone, i quali quindi avranno valore di 1 uma).
La massa atomica di un atomo è dato dalla somma del peso dei protoni e dei neutroni,
gli elettroni non sono considerati perché il peso degli elettroni modifica solo
leggermente il totale, perché la sua massa è pari a 1⁄1836 di quella di un protone.
In uma, la massa atomica è data dalla somma di neutroni e protoni dell’atomo preso
in considerazione, perché ognuno di loro, come detto in precedenza, vale 1 uma.
Es: massa atomica dell’ossigeno è 16 (perché ha 8 protoni e 8 neutroni).
MASSA MOLECOLARE
La massa di una molecola, detta massa molecolare, è uguale alla somma delle masse
di tutti gli atomi che compongono la molecola.
Es: trova la massa molecolare di una molecola di acqua
H2O
2 atomi di H = 2 * 1,01= 2,02 uma
1 atomo di ossigeno = 1 * 16 = 16 uma
Tot. 18,02 uma