LA MATERIA
La chimica è la scienza che si occupa delle proprietà della materia e della
trasformazione di una forma di materia in un’altra.
Ma cosa è la materia?
La materia è tutto ciò che possiede massa ed occupa spazio.
La materia può essere classificata in: sostanze pure e miscele.
Si definisce sostanza la materia che ha sempre la stessa composizione.
Ogni campione di una sostanza ha le stesse proprietà chimiche e fisiche perchè una
sostanza presenta una composizione uniforme e costante. Le sostanze sono, a loro
volta, classificate in due categorie: elementi e composti.
1. Un elemento è una sostanza formata da atomi tutti uguali (della stessa specie).
Due elementi non possono avere lo stesso tipo di atomi.
2. Un composto è una sostanza formata da due o più atomi diversi in proporzioni
fisse e costanti. Un composto presenta proprietà diverse da quelle degli atomi
che la compongono.
Ricordiamo che la più piccola particella di una sostanza (elemento o composto) che
ne conserva tutte le caratteristiche è la molecola e che una molecola può essere
formata da un solo atomo o da più atomi.
In natura più spesso si trovano miscele, cioè materia di composizione variabile,
formata da due o più sostanze che conservano ognuna le proprie caratteristiche.
Esse si possono distinguere in miscugli e soluzioni.
1. Il miscuglio è una miscela eterogenea, in cui le singole sostanze componenti
rimangono separate, anche se vengono mescolate. Un esempio di miscuglio è
una sabbia formata da granuli diversi.
2. Le soluzioni sono miscele omogenee, in cui non è possibile distinguere le
singole sostanze componenti e che, pertanto, presentano le stesse caratteristiche
in ogni loro parte. Non sono tuttavia sostanze pure, perché la loro
composizione può variare entro limiti anche ampi, come quando si fa sciogliere
del sale nell’acqua.
NUMERO ATOMICO , NUMERO DI MASSA E SIMBOLO
CHIMICO
Gli atomi di un dato elemento hanno sempre lo stesso numero di protoni, per esempio
tutti gli atomi di idrogeno contengono 1 protone nel nucleo, tutti gli atomi di ossigeno
contengono 8 protoni. Quindi, tale numero identifica un tipo di atomo, è chiamato
numero atomico e viene rappresentato con la lettera Z.
Il numero atomico di un elemento è uguale al numero di protoni
Atomi di elementi diversi hanno un diverso numero di protoni, cioè diverso numero
atomico. Un atomo è neutro perchè il numero di protoni (carichi positivi) è uguale al
numero di elettroni (carichi negativi), pertanto il numero atomico ci dice anche il
numero di elettroni.
Il numero di massa di un atomo è la somma del numero di protoni (carichi positivi)
e neutroni (carica neutra) contenuti nel nucleo.
Il numero atomico e il numero di massa sono utilizzati per identificare un atomo. Il
numero atomico si scrive in basso a sinistra del simbolo e il numero di massa in alto a
sinistra del simbolo chimico.
SIMBOLI CHIMICI DEGLI ELEMENTI
Ogni elemento è rappresentato, oltre che dal numero atomico, da un simbolo chimico
che si ottiene utilizzando la prima lettera maiuscola e, eventualmente, la seconda o la
terza lettera del nome latino dell’elemento. Ad esempio il simbolo dell’oro è Au dal
nome latino aurum, quello dell’azoto è N da nitrogen, ecc. I simboli chimici sono
universali e danno la possibilità a scienziati che parlano lingue diverse di comunicare
senza fare confusione.
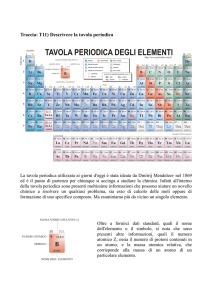
LA TAVOLA PERIODICA DEGLI ELEMENTI
Gli scienziati hanno organizzato in maniera logica gli elementi in una tabella
chiamata tavola periodica degli elementi. La tavola periodica raggruppa tutti gli
elementi in modo tale che la posizione di ciascuno di essi mette in relazione la
struttura atomica dell’atomo con le sue proprietà chimiche e fisiche. Nella tavola
periodica, gli elementi sono sistemati in ordine crescente del numero atomico
formando delle righe (chiamate periodi) e delle colonne (chiamate gruppi). Nella
tavola periodica si trovano i 112 elementi, dal n°1 al n°92 si trovano in natura, mentre
quelli con un numero atomico superiore a 93 sono artificiali.
I PERIODI
Ogni riga della tavola periodica prende il nome di periodo
Ogni periodo corrisponde a un livello energetico, il primo periodo corrisponde al
livello n=1, il secondo a n=2 ecc. Il numero di elementi per periodo varia perchè a
mano a mano che aumenta il numero atomico, aumenta il numero di orbitali occupati
dagli elettroni e quindi il numero di livelli energetici. I periodi sono formati, quindi,
da elementi che hanno gli elettroni esterni nello stesso livello energetico.
I GRUPPI
Ogni colonna della tavola periodica si chiama gruppo
Tutti gli elementi che appartengono allo stesso gruppo hanno proprietà chimiche
simili perchè contengono lo stesso numero di elettroni nell’ultimo livello energetico.
METALLI, NON METALLI E SEMIMETALLI
Gli elementi sono classificati in tre gruppi: i metalli, i semimetalli e i non metalli.
I METALLI: la maggior parte degli elementi sono classificati come metalli, essi si
trovano a sinistra della linea seghettata e sebbene abbiano aspetto molto variabili,
hanno alcune proprietà in comune:
• Sono buoni conduttori di calore e di corrente elettrica
• A temperatura ambiente sono solidi, tranne il mercurio che è liquido
• Sono lucenti
• Sono duttili, cioè possono essere lavorati in fili
• Sono malleabili, cioè possono essere lavorati in lamine
I NON METALLI: si trovano a destra della linea seghettata della tavola periodica, e
hanno proprietà opposte a quelle dei metalli. La maggior parte dei non metalli, a
temperatura ambiente, sono gas, il bromo è liquido e alcuni sono solidi. I solidi, come
lo zolfo, il fosforo, il carbonio, non possono essere lavorati perchè sono fragili e
friabili.
I SEMIMETALLI: sono gli elementi che confinano, a destra e a sinistra, con la
linea seghettata presente nella tavola periodica, essi si comportano alcune volte come
metalli e altre come i non metalli.
LE PROPRIETA’ PERIODICHE DEGLI ELEMENTI
Le proprietà periodiche degli elementi sono quelle proprietà che variano
gradualmente nell’ambito di un periodo o di un gruppo. Seguire un tale ordine
significa muoversi orizzontalmente nel sistema periodico, percorrendo i vari periodi,
separati l’uno dall’altro da un gas nobile. Ogni volta che percorrendo un periodo si va
a capo per iniziare il successivo, si incontra una brusca variazione delle proprietà
periodiche. Esaminiamo le proprietà periodiche principali:
Raggio e volume atomico: è il raggio di un atomo espresso in nm, cioè la metà
della distanza internucleare tra due atomi dello stesso elemento, legati in
modo covalente.
In un gruppo il raggio atomico aumenta procedendo verso il basso, infatti
scendendo lungo un gruppo, gli elettroni vanno a collocarsi in orbitali più
esterni, quindi più lontani dal nucleo.
Procedendo verso destra, in un periodo, il raggio atomico diminuisce; infatti
procedendo verso destra aumenta il numero di elettroni ma tutti sono collocati
nello stesso livello di energia e quindi alla medesima distanza dal nucleo.
Energia di ionizzazione: di un atomo o di una molecola è l'energia minima
richiesta per allontanare da esso/a un elettrone e portarlo a distanza infinita,
a 0 K e in condizioni di energia cinetica nulla.
L’energia di ionizzazione aumenta dal basso verso l’alto nei gruppi, e da
sinistra a destra nei periodi.
Gli andamenti descritti possono essere messi in relazione con le dimensioni
atomiche, infatti più lontani dal nucleo sono gli elettroni, meno energia sarà
necessaria per distaccarli. E’ inversamente proporzionale al raggio atomico.
Affinità elettronica: alcuni atomi tendono ad acquistare spontaneamente un
elettrone formando ioni negativi (anioni) più stabili ( e quindi con contenuto
energetico minore) dell’atomo neutro da cui provengono.
Ad es: l’atomo di fluoro F con struttura elettronica esterna 2s2 2p5 tende ad
acquistare spontaneamente un elettrone formando lo ione fluoruro F- con
struttura elettronica esterna ad ottetto completo 2s2 2p6 . Nel passaggio da F a Fvengono liberati 332,9 KJ/mol.
L’energia liberata (detta affinità elettronica) è tanto più alta quanto maggiore è
la tendenza dell’atomo ad acquistare l’elettrone. L’affinità elettronica viene
definita come l’energia, espressa in Kcal/mol ( o KJ/mol), liberata da una mole
di atomi neutri allo stato gassoso quando si trasforma in una mole di anioni
monovalenti.
L’affinità elettronica è associabile alle dimensioni dell’atomo: è tanto
maggiore quanto più piccolo è il volume atomico. Infatti più piccolo è un
atomo, tanto più vicino al nucleo si collocherà l’elettrone acquistato, liberando
maggiori quantità di energia.
Pertanto, l’affinità elettronica aumenta dal basso verso l’alto nei gruppi e
da sinistra a destra in un periodo.
Elettronegatività: è una misura relativa della capacità di un atomo di attrarre
gli elettroni del legame chimico. Esso dipende sia dall’energia di ionizzazione
che è relativa alla forza di attrazione esercitata da un nucleo verso i propri
elettroni, sia dall’affinità elettronica che indica con quanta forza elettroni
estranei possano essere attirati. Esistono varie scale per la misura
dell’elettronegatività tra cui si ricordano quella di Pauling, quella di Mulliken e
quella di Allred-Rochow.