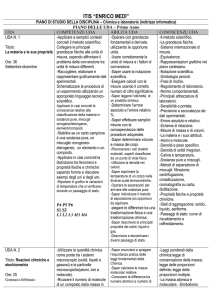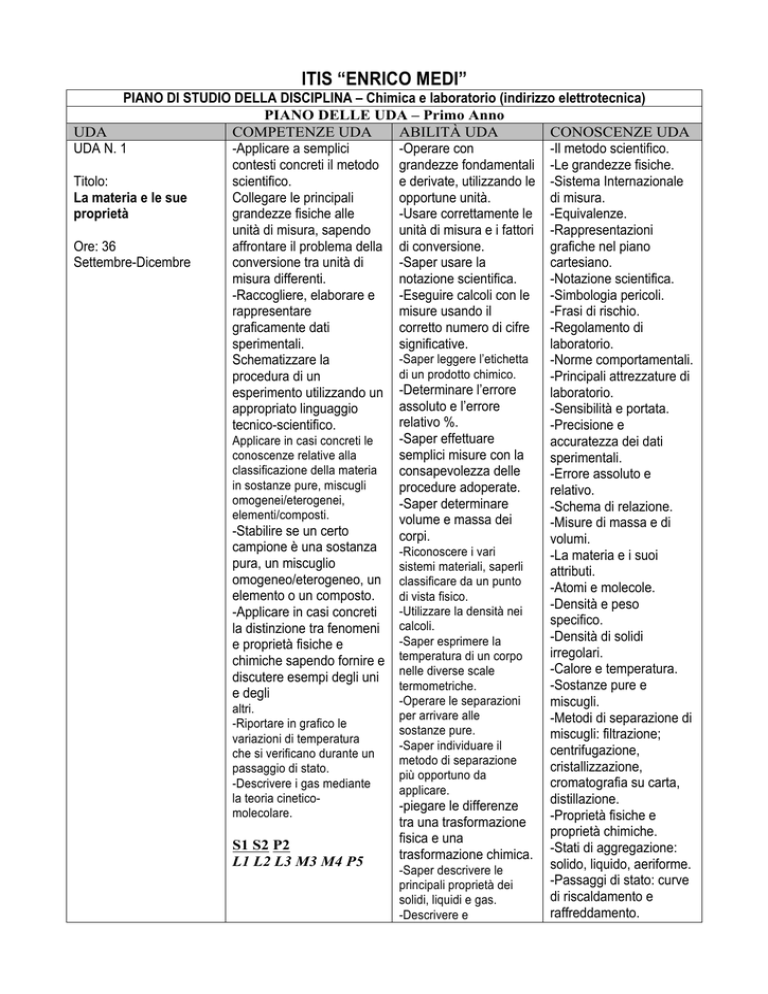
ITIS “ENRICO MEDI”
PIANO DI STUDIO DELLA DISCIPLINA – Chimica e laboratorio (indirizzo elettrotecnica)
PIANO DELLE UDA – Primo Anno
UDA
COMPETENZE UDA
ABILITÀ UDA
CONOSCENZE UDA
UDA N. 1
-Applicare a semplici
-Operare con
-Il metodo scientifico.
contesti concreti il metodo grandezze fondamentali -Le grandezze fisiche.
Titolo:
scientifico.
e derivate, utilizzando le -Sistema Internazionale
La materia e le sue
Collegare le principali
opportune unità.
di misura.
proprietà
grandezze fisiche alle
-Usare correttamente le -Equivalenze.
unità di misura, sapendo
unità di misura e i fattori -Rappresentazioni
Ore: 36
affrontare il problema della di conversione.
grafiche nel piano
Settembre-Dicembre
conversione tra unità di
-Saper usare la
cartesiano.
misura differenti.
notazione scientifica.
-Notazione scientifica.
-Raccogliere, elaborare e
-Eseguire calcoli con le -Simbologia pericoli.
rappresentare
misure usando il
-Frasi di rischio.
graficamente dati
corretto numero di cifre -Regolamento di
sperimentali.
significative.
laboratorio.
-Saper leggere l’etichetta
Schematizzare la
-Norme comportamentali.
di un prodotto chimico.
procedura di un
-Principali attrezzature di
-Determinare
l’errore
esperimento utilizzando un
laboratorio.
assoluto e l’errore
appropriato linguaggio
-Sensibilità e portata.
relativo
%.
tecnico-scientifico.
-Precisione e
-Saper effettuare
Applicare in casi concreti le
accuratezza dei dati
semplici misure con la
conoscenze relative alla
sperimentali.
classificazione della materia
consapevolezza delle
-Errore assoluto e
in sostanze pure, miscugli
procedure adoperate.
relativo.
omogenei/eterogenei,
-Saper determinare
-Schema di relazione.
elementi/composti.
volume e massa dei
-Misure di massa e di
-Stabilire se un certo
corpi.
volumi.
campione è una sostanza -Riconoscere i vari
-La materia e i suoi
pura, un miscuglio
sistemi materiali, saperli
attributi.
omogeneo/eterogeneo, un classificare da un punto
-Atomi e molecole.
elemento o un composto.
di vista fisico.
-Densità e peso
-Applicare in casi concreti -Utilizzare la densità nei
specifico.
la distinzione tra fenomeni calcoli.
-Densità di solidi
-Saper esprimere la
e proprietà fisiche e
irregolari.
chimiche sapendo fornire e temperatura di un corpo
-Calore e temperatura.
discutere esempi degli uni nelle diverse scale
-Sostanze pure e
termometriche.
e degli
-Operare le separazioni
miscugli.
altri.
per arrivare alle
-Metodi di separazione di
-Riportare in grafico le
sostanze pure.
miscugli: filtrazione;
variazioni di temperatura
-Saper individuare il
centrifugazione,
che si verificano durante un
metodo di separazione
cristallizzazione,
passaggio di stato.
più opportuno da
cromatografia su carta,
-Descrivere i gas mediante
applicare.
la teoria cineticodistillazione.
-piegare le differenze
molecolare.
-Proprietà fisiche e
tra una trasformazione
proprietà chimiche.
fisica e una
S1 S2 P2
trasformazione chimica. -Stati di aggregazione:
L1 L2 L3 M3 M4 P5
solido, liquido, aeriforme.
-Saper descrivere le
-Passaggi di stato: curve
principali proprietà dei
di riscaldamento e
solidi, liquidi e gas.
raffreddamento.
-Descrivere e
denominare i diversi
passaggi di stato.
UDA N. 2
Titolo: Reazioni
chimiche e
stechiometria
Ore: 25
Dicembre-Febbraio
-Utilizzare la quantità
chimica come ponte tra i
sistemi macroscopici
(solidi, liquidi e gassosi) e
le particelle
microscopiche(atomi, ioni
e molecole).
-Ricavare il numero di
molecole di un composto
dalla massa in grammi e
viceversa.
-Verificare
sperimentalmente la legge
di conservazione della
massa e definire in quali
condizioni viene rispettata.
S1 S2 S3 P2
L1 L2 L3 M 1 M3
-Saper enunciare e
spiegare l’importanza
pratica delle leggi
fondamentali della
Chimica.
-Saper calcolare le
masse molecolari
relative.
-Conoscere la differenza
tra numero atomico e
numero di massa.
-Definire la mole e
illustrare il suo
significato.
-Saper calcolare il
numero di moli e di
particelle presenti in una
certa quantità di
sostanza.
-Saper calcolare la
composizione
percentuale di una
sostanza.
-Saper bilanciare una
reazione chimica.
-Leggi ponderali della
chimica:legge di
conservazione della
massa; legge delle
proporzioni definite;
legge delle proporzioni
multiple.
-La massa atomica e
molecolare. -Simbolismo
chimico.
-Mole e numero di
Avogadro.
-Semplici calcoli
stechiometrici sul calcolo
delle moli.
-Bilanciamento di
reazioni.
UDA N. 3
Titolo: L’atomo e le sue
proprietà
Ore: 38
Marzo-Giugno
-Descrivere la natura delle
particelle elementari che
compongono l’atomo e le
esperienze che hanno
portato alla loro scoperta.
-Identificare gli elementi
attraverso il loro numero
atomico e mediante le loro
proprietà.
-Riconoscere un elemento
chimico sulla base della
radiazione
elettromagnetica emessa
dagli atomi eccitati con
una fonte di calore.
-Spiegare la struttura delle
sostanze, descrivere le
proprietà osservabili dei
materiali sulla base della
loro composizione
microscopica.
P2 S1 S2 S3
L1 L2 L3
-Confrontare i modelli
atomici di Thomson,
Rutheford e Bohr.
-Saper descrivere
l’attuale modello
atomico in termine di
numeri quantici ed
orbitali.
-Saper determinare la
configurazione
elettronica di un
elemento sulla base del
numero atomico.
-Saper rappresentare la
configurazione
elettronica esterna di un
elemento con la
simbologia di Lewis.
-Saper riconoscere il tipo
di legame esistente tra
due atomi.
-Saper spiegare la
tendenza di un atomo a
formare legami in base
alla sua configurazione
elettronica esterna.
TOTALE ORE 99
Legenda: grassetto sottolineato: competenze responsabili,
grassetto corsivo non sottolineato; competenze concorrenti.
-L’atomo e sue particelle.
-Modello atomico di
Thomson.
-Modello atomico di
Rutherford.
-Modello atomico di Bohr.
-Modello
quantomeccanico.
-Configurazioni
elettroniche.
-Tavola periodica di
Mendeleev.
-La moderna tavola
periodica.
-Proprietà periodiche
degli elementi: raggio
atomico; energia di
ionizzazione; affinità
elettronica;
elettronegatività.
-Metalli, non metalli,
semimetalli.
-I semiconduttori e le loro
proprietà e
caratteristiche.
-Saggi alla fiamma.
-Il Legame ionico e
covalente.