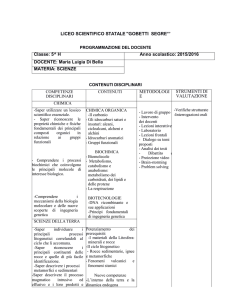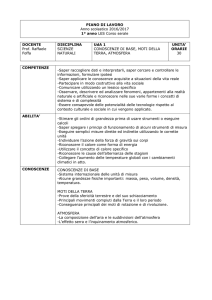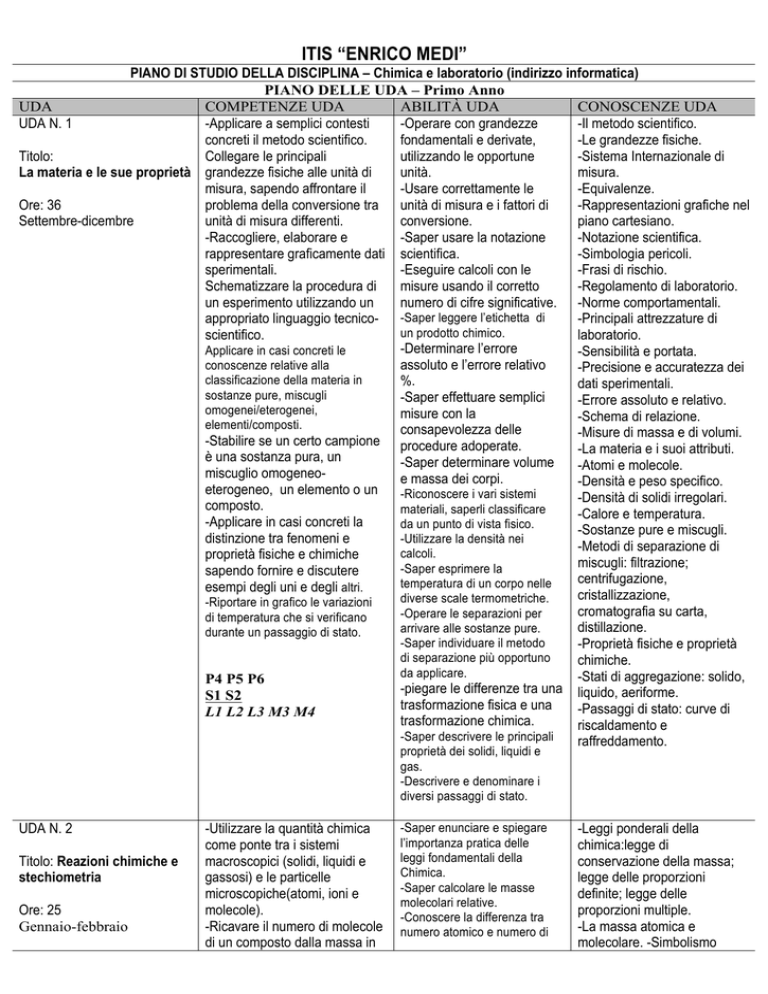
ITIS “ENRICO MEDI”
PIANO DI STUDIO DELLA DISCIPLINA – Chimica e laboratorio (indirizzo informatica)
PIANO DELLE UDA – Primo Anno
UDA
COMPETENZE UDA
ABILITÀ UDA
CONOSCENZE UDA
UDA N. 1
-Applicare a semplici contesti
-Operare con grandezze
-Il metodo scientifico.
concreti il metodo scientifico.
fondamentali e derivate,
-Le grandezze fisiche.
Titolo:
Collegare le principali
utilizzando le opportune
-Sistema Internazionale di
La materia e le sue proprietà grandezze fisiche alle unità di
unità.
misura.
misura, sapendo affrontare il
-Usare correttamente le
-Equivalenze.
Ore: 36
problema della conversione tra unità di misura e i fattori di
-Rappresentazioni grafiche nel
Settembre-dicembre
unità di misura differenti.
conversione.
piano cartesiano.
-Raccogliere, elaborare e
-Saper usare la notazione
-Notazione scientifica.
rappresentare graficamente dati scientifica.
-Simbologia pericoli.
sperimentali.
-Eseguire calcoli con le
-Frasi di rischio.
Schematizzare la procedura di
misure usando il corretto
-Regolamento di laboratorio.
un esperimento utilizzando un
numero di cifre significative. -Norme comportamentali.
appropriato linguaggio tecnico- -Saper leggere l’etichetta di
-Principali attrezzature di
un prodotto chimico.
scientifico.
laboratorio.
-Determinare
l’errore
Applicare in casi concreti le
-Sensibilità e portata.
assoluto e l’errore relativo
conoscenze relative alla
-Precisione e accuratezza dei
classificazione della materia in
%.
dati sperimentali.
sostanze pure, miscugli
-Saper effettuare semplici
-Errore assoluto e relativo.
omogenei/eterogenei,
misure con la
-Schema di relazione.
elementi/composti.
consapevolezza delle
-Misure di massa e di volumi.
-Stabilire se un certo campione procedure adoperate.
-La materia e i suoi attributi.
è una sostanza pura, un
-Saper determinare volume
-Atomi e molecole.
miscuglio omogeneoe massa dei corpi.
-Densità e peso specifico.
eterogeneo, un elemento o un -Riconoscere i vari sistemi
-Densità di solidi irregolari.
composto.
materiali, saperli classificare
-Calore e temperatura.
-Applicare in casi concreti la
da un punto di vista fisico.
-Sostanze pure e miscugli.
distinzione tra fenomeni e
-Utilizzare la densità nei
-Metodi di separazione di
calcoli.
proprietà fisiche e chimiche
miscugli: filtrazione;
-Saper esprimere la
sapendo fornire e discutere
centrifugazione,
temperatura di un corpo nelle
esempi degli uni e degli altri.
cristallizzazione,
diverse scale termometriche.
-Riportare in grafico le variazioni
cromatografia su carta,
-Operare
le
separazioni
per
di temperatura che si verificano
distillazione.
arrivare
alle
sostanze
pure.
durante un passaggio di stato.
-Saper individuare il metodo
-Proprietà fisiche e proprietà
di separazione più opportuno
chimiche.
da applicare.
-Stati di aggregazione: solido,
P4 P5 P6
-piegare
le
differenze
tra
una
liquido, aeriforme.
S1 S2
trasformazione
fisica
e
una
-Passaggi di stato: curve di
L1 L2 L3 M3 M4
trasformazione chimica.
riscaldamento e
-Saper descrivere le principali
raffreddamento.
proprietà dei solidi, liquidi e
gas.
-Descrivere e denominare i
diversi passaggi di stato.
UDA N. 2
Titolo: Reazioni chimiche e
stechiometria
Ore: 25
Gennaio-febbraio
-Utilizzare la quantità chimica
come ponte tra i sistemi
macroscopici (solidi, liquidi e
gassosi) e le particelle
microscopiche(atomi, ioni e
molecole).
-Ricavare il numero di molecole
di un composto dalla massa in
-Saper enunciare e spiegare
l’importanza pratica delle
leggi fondamentali della
Chimica.
-Saper calcolare le masse
molecolari relative.
-Conoscere la differenza tra
numero atomico e numero di
-Leggi ponderali della
chimica:legge di
conservazione della massa;
legge delle proporzioni
definite; legge delle
proporzioni multiple.
-La massa atomica e
molecolare. -Simbolismo
grammi e viceversa.
-Verificare sperimentalmente la
legge di conservazione della
massa e definire in quali
condizioni viene rispettata.
P4 P5 P6
S1 S2
L1 L2 L3 M 1 M3
UDA N. 3
Titolo: L’atomo e le sue
proprietà
Ore: 38
Marzo-giugno
-Descrivere la natura delle
particelle elementari che
compongono l’atomo e le
esperienze che hanno portato
alla loro scoperta.
-Identificare gli elementi
attraverso il loro numero
atomico e mediante le loro
proprietà.
-Riconoscere un elemento
chimico sulla base della
radiazione elettromagnetica
emessa dagli atomi eccitati con
una fonte di calore.
-Spiegare la struttura delle
sostanze, descrivere le
proprietà osservabili dei
materiali sulla base della loro
composizione microscopica.
massa.
-Definire la mole e illustrare il
suo significato.
-Saper calcolare il numero di
moli e di particelle presenti in
una certa quantità di
sostanza.
-Saper calcolare la
composizione percentuale di
una sostanza.
-Saper bilanciare una
reazione chimica.
-Confrontare i modelli
atomici di Thomson,
Rutheford e Bohr.
-Saper descrivere l’attuale
modello atomico in termine
di numeri quantici ed orbitali.
-Saper determinare la
configurazione elettronica di
un elemento sulla base del
numero atomico.
-Saper rappresentare la
configurazione elettronica
esterna di un elemento con
la simbologia di Lewis.
-Saper riconoscere il tipo di
legame esistente tra due
atomi.
-Saper spiegare la tendenza
di un atomo a formare legami
in base alla sua
configurazione elettronica
esterna.
P4 P5 P6
S1 S2 S3
L1 L2 L3
TOTALE ORE 99
Legenda: grassetto sottolineato: competenze responsabili,
grassetto corsivo non sottolineato; competenze concorrenti.
chimico.
-Mole e numero di Avogadro.
-Semplici calcoli stechiometrici
sul calcolo delle moli.
-Bilanciamento di reazioni.
-L’atomo e sue particelle.
-Modello atomico di Thomson.
-Modello atomico di
Rutherford.
-Modello atomico di Bohr.
-Modello quantomeccanico.
-Configurazioni elettroniche.
-Tavola periodica di
Mendeleev.
-La moderna tavola periodica.
-Proprietà periodiche degli
elementi: raggio atomico;
energia di ionizzazione;
affinità elettronica;
elettronegatività.
-Metalli, non metalli,
semimetalli.
-I semiconduttori e le loro
proprietà e caratteristiche.
-Il drogaggio dei
semiconduttori.
-Saggi alla fiamma.
-Il Legame ionico e
covalente.