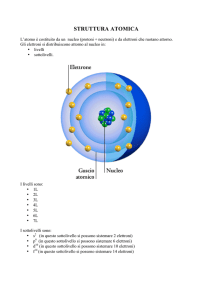
** ITN - Caboto - Gaeta ** Fisica - prof. Vindice Luigi -
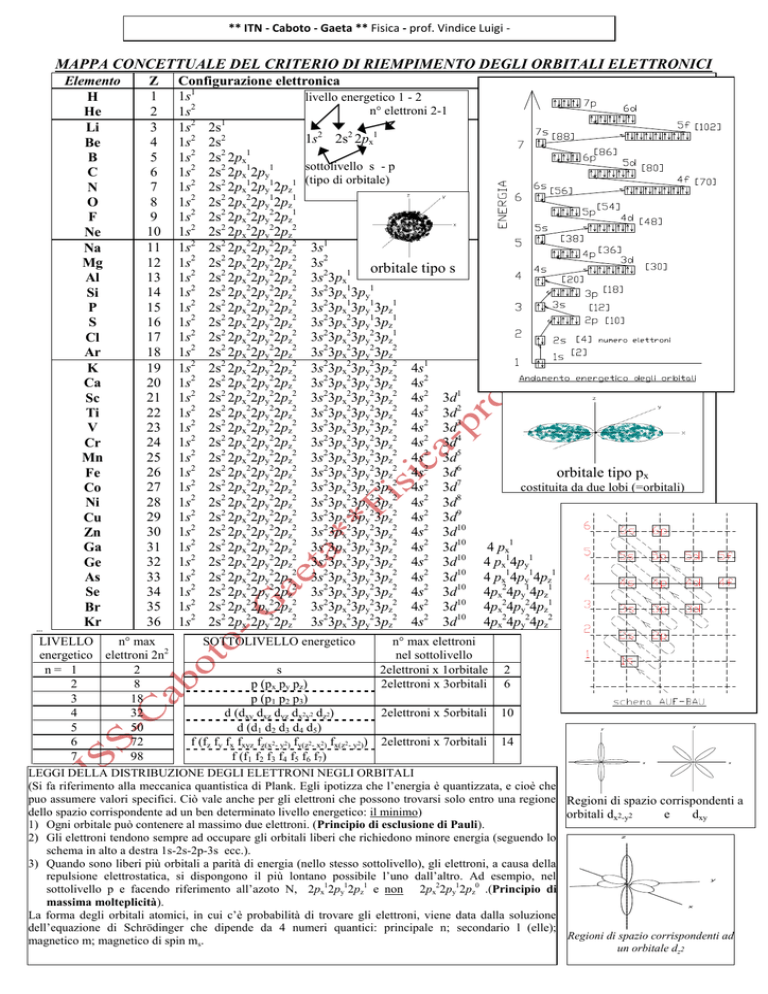
MAPPA CONCETTUALE DEL CRITERIO DI RIEMPIMENTO DEGLI ORBITALI ELETTRONICI
Elemento
H
He
Li
Be
B
C
N
O
F
Ne
Na
Mg
Al
Si
P
S
Cl
Ar
K
Ca
Sc
Ti
V
Cr
Mn
Fe
Co
Ni
Cu
Zn
Ga
Ge
As
Se
Br
Kr
Z
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
19
20
21
22
23
24
25
26
27
28
29
30
31
32
33
34
35
36
Configurazione elettronica
1s1
livello energetico 1 - 2
n° elettroni 2-1
1s2
1s2 2s1
1s2 2s2 2px1
1s2 2s2
2
2
1
1s 2s 2px
sottolivello s - p
1s2 2s2 2px12py1
2
2
1
1
1 (tipo di orbitale)
1s 2s 2px 2py 2pz
1s2 2s2 2px22py12pz1
1s2 2s2 2px22py22pz1
1s2 2s2 2px22py22pz2
1s2 2s2 2px22py22pz2 3s1
1s2 2s2 2px22py22pz2 3s2
orbitale tipo s
1s2 2s2 2px22py22pz2 3s23px1
1s2 2s2 2px22py22pz2 3s23px13py1
1s2 2s2 2px22py22pz2 3s23px13py13pz1
1s2 2s2 2px22py22pz2 3s23px23py13pz1
1s2 2s2 2px22py22pz2 3s23px23py23pz1
1s2 2s2 2px22py22pz2 3s23px23py23pz2
1s2 2s2 2px22py22pz2 3s23px23py23pz2 4s1
1s2 2s2 2px22py22pz2 3s23px23py23pz2 4s2
1s2 2s2 2px22py22pz2 3s23px23py23pz2 4s2 3d1
1s2 2s2 2px22py22pz2 3s23px23py23pz2 4s2 3d2
1s2 2s2 2px22py22pz2 3s23px23py23pz2 4s2 3d3
1s2 2s2 2px22py22pz2 3s23px23py23pz2 4s2 3d4
1s2 2s2 2px22py22pz2 3s23px23py23pz2 4s2 3d5
1s2 2s2 2px22py22pz2 3s23px23py23pz2 4s2 3d6
1s2 2s2 2px22py22pz2 3s23px23py23pz2 4s2 3d7
1s2 2s2 2px22py22pz2 3s23px23py23pz2 4s2 3d8
1s2 2s2 2px22py22pz2 3s23px23py23pz2 4s2 3d9
1s2 2s2 2px22py22pz2 3s23px23py23pz2 4s2 3d10
1s2 2s2 2px22py22pz2 3s23px23py23pz2 4s2 3d10
1s2 2s2 2px22py22pz2 3s23px23py23pz2 4s2 3d10
1s2 2s2 2px22py22pz2 3s23px23py23pz2 4s2 3d10
1s2 2s2 2px22py22pz2 3s23px23py23pz2 4s2 3d10
1s2 2s2 2px22py22pz2 3s23px23py23pz2 4s2 3d10
1s2 2s2 2px22py22pz2 3s23px23py23pz2 4s2 3d10
orbitale tipo px
costituita da due lobi (=orbitali)
4 px1
4 px14py1
4 px14py14pz1
4px24py14pz1
4px24py24pz1
4px24py24pz2
***
LIVELLO
n° max
SOTTOLIVELLO energetico
n° max elettroni
energetico elettroni 2n2
nel sottolivello
n= 1
2
s
2elettroni x 1orbitale 2
2
8
p (px py pz)
2elettroni x 3orbitali 6
3
18
p (p1 p2 p3)
4
32
d (dxy dxz dyz dx2y2 dz2)
2elettroni x 5orbitali 10
5
50
d (d1 d2 d3 d4 d5)
6
72
f (fz fy fx fxyz fz(x2- y2) fy(z2- x2) fx(z2- y2)) 2elettroni x 7orbitali 14
7
98
f (f1 f2 f3 f4 f5 f6 f7)
LEGGI DELLA DISTRIBUZIONE DEGLI ELETTRONI NEGLI ORBITALI
(Si fa riferimento alla meccanica quantistica di Plank. Egli ipotizza che l’energia è quantizzata, e cioè che
puo assumere valori specifici. Ciò vale anche per gli elettroni che possono trovarsi solo entro una regione Regioni di spazio corrispondenti a
dello spazio corrispondente ad un ben determinato livello energetico: il minimo)
orbitali dx2-y2
e
dxy
1) Ogni orbitale può contenere al massimo due elettroni. (Principio di esclusione di Pauli).
2) Gli elettroni tendono sempre ad occupare gli orbitali liberi che richiedono minore energia (seguendo lo
schema in alto a destra 1s-2s-2p-3s ecc.).
3) Quando sono liberi più orbitali a parità di energia (nello stesso sottolivello), gli elettroni, a causa della
repulsione elettrostatica, si dispongono il più lontano possibile l’uno dall’altro. Ad esempio, nel
sottolivello p e facendo riferimento all’azoto N, 2px12py12pz1 e non 2px22py12pz0 .(Principio di
massima molteplicità).
La forma degli orbitali atomici, in cui c’è probabilità di trovare gli elettroni, viene data dalla soluzione
dell’equazione di Schrödinger che dipende da 4 numeri quantici: principale n; secondario l (elle);
Regioni di spazio corrispondenti ad
magnetico m; magnetico di spin ms.
y
y
x
x
z
y
x
un orbitale dz2