Teoria Atomica
Chimica Generale ed Inorganica
Chimica Generale
prof. Dario Duca
Teoria Atomica Moderna"
Chimica generale ed Inorganica: Chimica Generale"
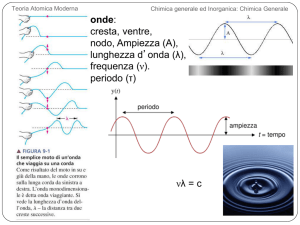
onde:"
cresta, ventre, "
FIGURA 9-1 Il semplice moto di un’onda che viaggia su una corda
nodo, Ampiezza (A),"
lunghezza d onda (λ),"
frequenza (ν)."
periodo (τ)"
"
"
"
"
"
"
"
"
νλ = c"
Teoria Atomica Moderna"
Chimica generale ed Inorganica: Chimica Generale"
luce e radiazioni elettromagnetiche"
νλ = c"
Teoria Atomica Moderna"
Chimica generale ed Inorganica: Chimica Generale"
Teoria Atomica Moderna"
Chimica generale ed Inorganica: Chimica Generale"
Teoria Atomica Moderna"
Chimica generale ed Inorganica: Chimica Generale"
Interferenza:"
è dovuta alla sovrapposizione, in un punto dello spazio, di due
FIGURA 9-4
Esempiessere
di interferenza costruttiva o distruttiva: onde in fase
o più onde,
può
o fuori fase"
Diffrazione:"
è un fenomeno legato
all interazione di un onda"
con un ostacolo di dimensioni
comparabili alla sua λ"
Reticolo di diffrazione
!
Teoria Atomica Moderna"
Chimica generale ed Inorganica: Chimica Generale"
Rifrazione:"
è la deviazione che si manifesta nel
FIGURA 9-6 Rifrazione della luce
cammino di un onda al passaggio da un
mezzo fisico ad un altro nel quale cambia la
sua velocità di propagazione!
!
!
!
!
!
!
!
Dispersione (ottica):"
!
è un fenomeno legato alla separazione delle componenti spettrali
di un onda che si propagano con diversa velocità in un dato mezzo!
!
!
!
!
!
Teoria Atomica Moderna"
Chimica generale ed Inorganica: Chimica Generale"
sorgenti di emissione di luce"
E = hν
νλ = c"
E = mc2"
Teoria Atomica Moderna"
Chimica generale ed Inorganica: Chimica Generale"
FIGURA 9-9 Spettro atomico, o a righe, dell’elio
Spettri Atomici:"
"
emissione, assorbimento "
Teoria Atomica Moderna"
Chimica generale ed Inorganica: Chimica Generale"
FIGURA 9-10 La serie di Balmer per gli atomi di idrogeno - spettro a righe
serie di Balmer"
equazione di Rydberg"
€
νλ = c"
% 1 1(
ν = 3,2881×1015 ' 2 − 2 *;
&2 n )
n>2
s-1"
% 1 1(
1
= 1,097 ×107 ' 2 − 2 *;
&2 n )
λ
n>2
m-1"
RH = 1,097x107 m-1
costante di Rydberg"
€
Teoria Atomica Moderna"
Chimica generale ed Inorganica: Chimica Generale"
Modello di Bohr
FIGURA 9-13 Modello di Bohr dell’atomo di idrogeno
serie di"
Balmer, Paschen, Bracket,
Pfund
$ 1
1
1'
= RH& 2 − 2 );
%m n (
λ
m≥2 n>m
$ 1
1'
ΔE = RY& 2 − 2 ); m ≥ 2, n > m
%m n (
€
E = hν νλ = c → E = hc/λ
€
RY = hcRH"
Teoria Atomica Moderna"
r × p = n
Chimica generale ed Inorganica: Chimica Generale"
µur = n
e2 µu2
k 2 =
r
r
=
h
2π
k=
e2 µ n22
k 2 =
r
r µ2r 2
2
r =n
= n2a0
2
kµe
modello di Bohr"
2
1 2
e2
E = T + V = µu − k
2
r
& 1 e2 e2 )
k e2
E = k(
− +=−
r *
2 r
'2 r
k e2
1 ke2
1 2π 2µe4
1
E=−
=− 2
=− 2
=
−R
Y 2
2 r
n 2a0
n (4πε0 )2 h2
n
& 1 1)
ΔE n →n = RY ( 2 − 2 +
n1 ≥ 1 n2 > n1
2
1
n
n
' 1
2*
2π 2µe4
RY =
(4πε0 )2 h2
$ 1
serie di"
1'
ΔE = RY& 2 − 2 ); m = 1, n > m Lyman
%m n (
2π 2µZ2e4
R =
(4πε0 )2 h2
Z
Y
€
& 1
1 )
µ−1 = ( +
+
' me mnucl *
1
4πε0
€
Teoria Atomica Moderna"
Chimica generale ed Inorganica: Chimica Generale"
modello di Bohr"
r × p = n
2π 2µ Z 2e4
R =
(4πε0 )2 h2
Z
Y
k
Ze2 µ n2 2
=
r2
r µ 2r 2
µur = n
=
h
2π
Ze2 µu2
k 2 =
r
r
2
n2a 0
r = n2
=
2
Z
Z kµe
k=
1
4πε0
µu
n2a 0
= n
Z
u=
1 Z
µ na 0
Teoria Atomica Moderna"
Chimica generale ed Inorganica: Chimica Generale"
FIGURA 9-15 Spettroscopia di emissione e di assorbimento
Spettroscopia:"
"
di assorbimento"
"
di emissione "
Teoria Atomica Moderna"
molteplicità dei livelli:"
"
effetto Stark"
"
effetto Zeeman"
Chimica generale ed Inorganica: Chimica Generale"
Teoria Atomica Moderna"
correzioni al modello di Bohr
modello di Bohr-Sommerfeld"
Chimica generale ed Inorganica: Chimica Generale"
Teoria Atomica Moderna"
E = mc 2 = hν
mc 2 = h
rxp = n
c
λ
Chimica generale ed Inorganica: Chimica Generale"
2π r = nλ
mc =
h
λ
νλ = c
mc =
nh
2π r
Teoria Atomica Moderna"
Chimica generale ed Inorganica: Chimica Generale"
Onde Stazionarie!
"
y=y0[sen(kx+ωt)+sen(kx–ωt)]"
"
y=2y0[sen(kx)cos(ωt)]"
lunghezza d onda quantizzata λ =
2l
n
n = 1,2,…"
onde stazionarie bidimensionali
e tridimensionali"
€
Teoria Atomica Moderna"
Chimica generale ed Inorganica: Chimica Generale"
Diffrazione di raggi-X e di fasci di elettroni!
"
esperimento di Davisson-Germer su cristallo di Ni e fogli di metallo"
verifica sperimentale dell ipotesi di De Broglie "
"
G.P. Thomson - Nobel 1937 l elettrone ha natura ondulatoria"
esperimenti su fogli di Sn"
"
J.J. Thomson - Nobel 1906 l elettrone ha natura corpuscolare "
Teoria Atomica Moderna"
Chimica generale ed Inorganica: Chimica Generale"
Δx⋅ Δp x ≥
2
oggetti macroscopici e microscopici"
€
= 1,054571628(53)×10-34"
Δx ≥
2 ⋅ Δp x
massa /Kg velocità/ms−1 Δx ≥
2 ⋅ 0.1⋅ px
€
1
0
9 ⋅ 10
5 ⋅ 10
1⋅ 10−36
9 ⋅ 10−31
2 ⋅ 10 8
3 ⋅ 10−12
€
2 ⋅ 10−22
2 ⋅ 10−22
€
2 ⋅ Δpx
3 ⋅ 10 −11
3 ⋅ 10 −10
px /Kgms−1 Δp x /Kgms−1 Δx ≥
0.01⋅ px
0.001⋅ px
Teoria Atomica Moderna"
Chimica generale ed Inorganica: Chimica Generale"
principio d’indeterminazione"
Δx ⋅ Δp x ≥
€
2
=
h
2π
Teoria Atomica Moderna"
Chimica generale ed Inorganica: Chimica Generale"
Meccanica Ondulatoria – Schrödinger!
equazione agli autovalori
Hψ = Eψ
autovalori e autofunzioni
E1 ⇒ ψ1
E2 ⇒ ψ2
E3 ⇒ ψ3
.
.
.
En ⇒ ψn
Meccanica Matriciale: Born – Heisenberg – Jordan, Dirac!
€
Teoria Atomica Moderna"
Chimica generale ed Inorganica: Chimica Generale"
Equazione di Schrödinger - approccio postulativo"
"
FIGURA 9-18 L’elettrone come onda materiale
i)
esiste una funzione delle coordinate delle particelle in un
sistema - Ψ(x1,y1,z1, …., xn,yn,zn,t)- che descrive lo stato del
sistema nella sua evoluzione temporale. La funzione
contiene tutta l’informazione relativa al sistema;"
ii)
si può sempre trovare un’equazione che descriva
l’evoluzione temporale del sistema;"
iii) gli osservabili sperimentali possono essere calcolati
attraverso l’opportuna definizione di operatori quantomeccanici;"
iv) la funzione |Ψ|2 rappresenta una densità di probabilità - per
esempio riferendoci ad un sistema uni-particellare la
probabilità di trovare la particella in una data regione di
spazio in un dato tempo. "
Teoria Atomica Moderna"
Chimica generale ed Inorganica: Chimica Generale"
Equazione di Schrödinger - note sui precedenti punti"
"
FIGURA 9-18 L’elettrone come onda materiale
i)
le Ψ(r,t) devono essere a singolo valore, con la loro derivata
prima devono essere continue, devono tendere a 0 per r
tendente ad ∞, devono essere normalizzate - ∫ Ψa*Ψadr=1 - e
ortogonali - ∫Ψa*Ψbdr=0 - quadraticamente integrabili."
ii)
l’equazione dell’evoluzione temporale - riferendoci
dell’energia di un sistema uni-particellare in uno spazio monodimensionale - è:"
∂Ψ(x,t)
2 ∂2 Ψ(x,t)
−
=−
+ V (x,t)Ψ(x,t)
i ∂t
2m ∂x 2
∂
iii) Energia del sistema:" H = T + V x → x p x →
i ∂x
iv)
con le premesse del punto ii) la probabilità di trovare la
particella nella regione di spazio x, x+dx al tempo t è:!
2
Ψ(x,t) dx
€
€
Teoria Atomica Moderna"
Chimica generale ed Inorganica: Chimica Generale"
idrogeno
H = T +V
monodimensionale
x→x
E = T+V
1
Ze 2
E = µ v 2x +
2
( 4πε0 ) x(n↔e)
Hψ = Eψ
Hψ = [ T + V]QM ψ = Eψ
px →
! ∂
i ∂x
1
e2
E = m e v 2x +
2
( 4πε0 ) x
"1
e2 %
Hψ = $ m e v 2x +
' ψ = Eψ
$# 2
( 4πε0 ) x '&QM
" 1 ) ! ∂ ,2
"1
" 1
e2 %
e2 %
e2 %
2
2
px +
'ψ = Eψ
$ m ev x +
' ψ =$
' ψ =$
+
. +
$# 2
( 4πε0 ) x '&QM $# 2m e
( 4πε0 ) x '&QM $# 2m e * i ∂x - ( 4πε0 ) x '&
" ! 2 ∂2
e2 %
+
$−
'ψ = Eψ
$# 2m e ∂x 2 ( 4πε 0 ) x '&
" ! 2 ∂2
%
+ Vx 'ψ = Eψ
$−
2
# 2m ∂x
&
Teoria Atomica Moderna"
Chimica generale ed Inorganica: Chimica Generale"
H xψ = E xψ
H xyzψ = E xyzψ
# ! 2 ) ∂2
&
∂2
∂2 ,
%−
+ 2 + 2 + 2 . + Vxyz (ψ = Eψ
$ 2m * ∂x ∂y ∂z '
,
e2
.ψ = Eψ
⇔
Z,
µ
x 2 + y 2 + z 2 .-
# ! 2 ∂2
&
+
V
%−
(ψ = Eψ
x
2
$ 2m ∂x
'
) 2
!
−+
∇2 +
+ 2m
( 4πε0 )
*
!2 2
−
∇ ψ + Vψ = Eψ
2m
Hψ = Eψ
ψ (x, y, z) → ψ (r, θ , φ ) → R(r)Θ(θ )Φ(φ ) → R(r)Y(θ , φ )
R nl (r)Ylm l (θ , φ )
E=−
⇔
RY
n2
ΔE n2 →n1
)1 1,
= RY + 2 − 2 .
* n1 n 2 -
n,
l,
ml
n 1,2, ... ∞"
l 0,1, ... n-1"
ml -l, -l+1, ... 0, ...+l"
Teoria Atomica Moderna"
Chimica generale ed Inorganica: Chimica Generale"
FIGURA 9-22 Livelli e sottolivelli di un atomo di idrogeno
orbitali idrogenoidi"
Teoria Atomica Moderna"
Chimica generale ed Inorganica: Chimica Generale"
n 1,2, ... ∞"
l 0,1, ... n-1"
ml -l, -l+1, ... 0, ...+l"
Teoria Atomica Moderna"
Chimica generale ed Inorganica: Chimica Generale"
rappresentazione radiale"
Teoria Atomica Moderna"
Chimica generale ed Inorganica: Chimica Generale"
rappresentazione angolare"
Teoria Atomica Moderna"
Chimica generale ed Inorganica: Chimica Generale"
isoipse"
FIGURA 9-24 Due rappresentazioni della funzione angolare dell’orbitale p
Teoria Atomica Moderna"
Chimica generale ed Inorganica: Chimica Generale"
isoipse"
FIGURA 9-24 Due rappresentazioni della funzione angolare dell’orbitale p
Teoria Atomica Moderna"
Chimica generale ed Inorganica: Chimica Generale"
isoipse"
FIGURA 9-24 Due rappresentazioni della funzione angolare dell’orbitale p
Teoria Atomica Moderna"
Chimica generale ed Inorganica: Chimica Generale"
isoipse"
FIGURA 9-24 Due rappresentazioni della funzione angolare dell’orbitale p
Teoria Atomica Moderna"
Chimica generale ed Inorganica: Chimica Generale"
isoipse"
ψ = ± .01
ψ = ± .01
Teoria Atomica Moderna"
Chimica generale ed Inorganica: Chimica Generale"
isoipse"
FIGURA 9-24 Due rappresentazioni della funzione angolare dell’orbitale p
Teoria Atomica Moderna"
FIGURA 9-26 I tre orbitali 2p
Chimica generale ed Inorganica: Chimica Generale"
Teoria Atomica Moderna"
FIGURA 9-27 Sezioni dei cinque orbitali d
Chimica generale ed Inorganica: Chimica Generale"
Teoria Atomica Moderna"
Chimica generale ed Inorganica: Chimica Generale"
FIGURA 9-22 Livelli e sottolivelli di un atomo di idrogeno
nodi angolari e radiali"
"
nodi angolari
"l
"s, l = 0; p, l = 1; d, l = 2; f, l = 3 "
nodi radiali
"n − l − 1 "1s, 0; 2p, 0; 2s, 1; 3s, 2; 4f, 0"
"
nodi totali" n − 1
"n = 1, 0; n = 2, 1; n = 3, 2"
"
"
"n = 4, 3 " 4s, 3; 4p, 3; 4d, 3; 4f, 3"
Teoria Atomica Moderna"
probabilità di trovare l elettrone"
"
e"
"
densità di probabilità"
"
e"
"
densità di carica"
"
"
ψ2dv e ψ2"
Chimica generale ed Inorganica: Chimica Generale"
Teoria Atomica Moderna"
Chimica generale ed Inorganica: Chimica Generale"
FIGURA 9-25 Tre rappresentazioni della probabilità di trovare l’elettrone e della densità di carica per un orbitale
2p
Teoria Atomica Moderna"
Chimica generale ed Inorganica: Chimica Generale"
distribuzione radiale di probabilità"
"
4π r2R2(r)"
Teoria Atomica Moderna"
FIGURA 9-29 Lo spin elettronico visualizzato
esperimento di Stern-Gerlach"
"
spin dell elettrone"
Chimica generale ed Inorganica: Chimica Generale"
Teoria Atomica Moderna"
Chimica generale ed Inorganica: Chimica Generale"
equazione di Schrödinger e livelli di energia"
Hψ = Eψ n,l,ml
E
En ⇒ ψn n,0,0 n,1,(-1,0,1) ⋅ ⋅ ⋅ n,n − 1,(−n + 1,−n + 2,...,0,...,n − 2,,n − 1)
.
.
.
E 3 ⇒ ψ 3 3,0,0 3,1,(-1,0,1) 3,2,(-2,-1,0,1,2)
E 2 ⇒ ψ 2 2,0,0 2,1,(-1,0,1)
E1 ⇒ ψ1 1,0,0
€
:: :: :: :: :"
:: :: :: :: :
Teoria Atomica Moderna"
un inciso sui numeri quantici"
Chimica generale ed Inorganica: Chimica Generale"
Teoria Atomica Moderna"
livelli di energia: dettagli"
E
:: :: :: :: :"
:: :: :: :: :
Chimica generale ed Inorganica: Chimica Generale"
Teoria Atomica Moderna"
Chimica generale ed Inorganica: Chimica Generale"
atomo idrogenoide e metodo auf-bau"
FIGURA 9-33 Diagramma dell’energia degli orbitali dei primi tre gusci elettronici
principio di esclusione di Pauli"
"
regola della massima"
molteplicità di Hund"
Teoria Atomica Moderna"
Chimica generale ed Inorganica: Chimica Generale"
Teoria Atomica Moderna"
Chimica generale ed Inorganica: Chimica Generale"
Teoria Atomica Moderna"
Chimica generale ed Inorganica: Chimica Generale"
Chimica Generale ed Inorganica
Chimica Generale
prof. Dario Duca