Teoria Atomica Moderna
Chimica generale ed Inorganica: Chimica Generale
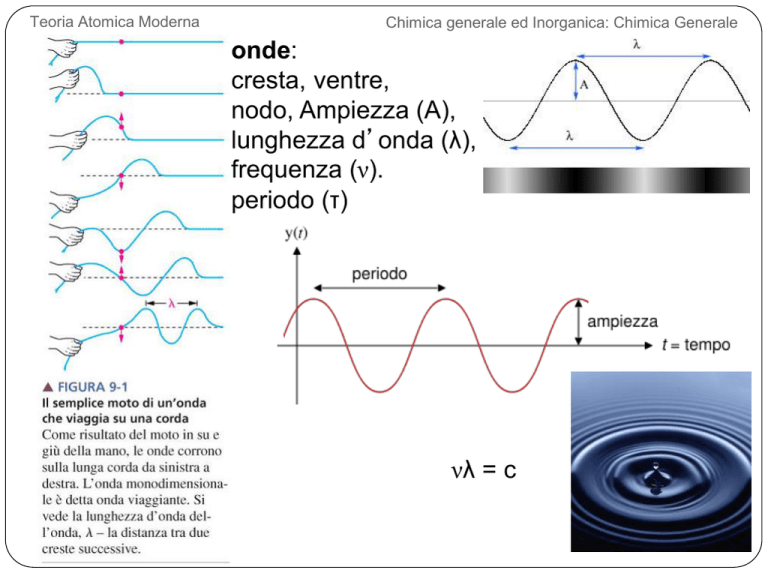
onde:
cresta, ventre,
FIGURA 9-1 Il semplice moto di un’onda che viaggia su una corda
nodo, Ampiezza (A),
lunghezza d’onda (λ),
frequenza (ν).
periodo (τ)
νλ = c
Teoria Atomica Moderna
Ångstrom
Chimica generale ed Inorganica: Chimica Generale
E = hν
h è la costante
di Plank
Spettro elettromagnetico
Teoria Atomica Moderna
Chimica generale ed Inorganica: Chimica Generale
Teoria Atomica Moderna
sorgenti di emissione di luce
Chimica generale ed Inorganica: Chimica Generale
Teoria Atomica Moderna
Chimica generale ed Inorganica: Chimica Generale
FIGURA 9-9 Spettro atomico, o a righe, dell’elio
Spettri Atomici:
emissione, assorbimento
Teoria Atomica Moderna
Chimica generale ed Inorganica: Chimica Generale
FIGURA 9-10 La serie di Balmer per gli atomi di idrogeno - spettro a righe
L’esistenza di livelli separati di energia è un concetto difficile da accettare, in
quanto è contrario all’esperienza quotidiana con sistemi fisici macroscopici
Teoria Atomica Moderna
Chimica generale ed Inorganica: Chimica Generale
Modello di Bohr
FIGURA 9-13 Modello di Bohr dell’atomo di
I 3 Postulati di Bohr:
L’elettrone si muove in orbite circolari attorno al
nucleo secondo un moto descritto dalla fisica classica
L’elettrone possiede una serie fissa di orbite permesse,
dette stati stazionari
Un elettrone può, passare solo da un orbita permessa ad
un’altra. In queste transizioni, vengono coinvolte
quantità fisse di energia (quanti) o assorbite o emesse
Teoria Atomica Moderna
Chimica generale ed Inorganica: Chimica Generale
modello di Bohr
Teoria di Bohr e la Spettroscopia
Teoria di Bohr e l’energia di ionizzazione
Teoria Atomica Moderna
Chimica generale ed Inorganica: Chimica Generale
E mc 2
E h
mc 2 h
c
p
h
Essendo il momento p definito come
P=mc
Relazione di De Broglie
– Dualismo onda-particella
Teoria Atomica Moderna
Chimica generale ed Inorganica: Chimica Generale
Meccanica Ondulatoria – Schrödinger
equazione agli autovalori
autovalori e autofunzioni
Meccanica Matriciale: Born – Heisenberg – Jordan, Dirac
Teoria Atomica Moderna
Chimica generale ed Inorganica: Chimica Generale
FIGURA 9-24 Due rappresentazioni della funzione angolare dell’orbitale p
Teoria Atomica Moderna
Chimica generale ed Inorganica: Chimica Generale
FIGURA 9-24 Due rappresentazioni della funzione angolare dell’orbitale p
Teoria Atomica Moderna
Chimica generale ed Inorganica: Chimica Generale
FIGURA 9-24 Due rappresentazioni della funzione angolare dell’orbitale p
Teoria Atomica Moderna
Chimica generale ed Inorganica: Chimica Generale
FIGURA 9-24 Due rappresentazioni della funzione angolare dell’orbitale p
La soluzione matematica dell’equazione di Schrödinger
definisce una funzione d’onda in cui specificando tre numeri
quantici si ottiene un orbitale
Numeri quantici
n è il numero quantico principale
n=1, 2, 3, 4, …
l è il secondo numero quantico orbitale può assumere valore 0 e
ogni numero intero positivo non superiore a n
l= 0, 1, 2, 3, n-1
Il terzo numero quantico magnetico ml che può assumere ogni
valore intero sia positivo che negativo, tra –l ed l
ml = -l, -l+1, -l+2, … 0, 1, 2,…l -1, l
Teoria Atomica Moderna
FIGURA 9-26 I tre orbitali 2p
Chimica generale ed Inorganica: Chimica Generale
Teoria Atomica Moderna
FIGURA 9-27 Sezioni dei cinque orbitali d
Chimica generale ed Inorganica: Chimica Generale
Teoria Atomica Moderna
Chimica generale ed Inorganica: Chimica Generale
Il quarto numero quantico
FIGURA 9-29 Lo spin elettronico visualizzato
esperimento di Stern-Gerlach
spin dell’ elettrone
Numeri quantici
n, l, m
Regole Auf-Bau
Principio di eclusione Pauli
Regola di Hund
E
28
Elettroni di core
Elettroni di valenza
LEGAME CHIMICO - TEORIA DI LEWIS
La configurazione elettronica dei gas nobili è responsabile della loro inerzia
chimica.
Gli atomi degli altri elementi si combinano tra loro per raggiungere le
configurazioni elettroniche dei gas nobili
Gli elettroni esterni (di valenza), giocano un ruolo fondamentale nel
legame chimico
In alcuni casi gli elettroni vengono trasferiti da un atomo ad un altro
(Legami ionici)
In altri casi due o più coppie di elettroni vengono condivise tra gli atomi
(Legami Covalenti)
Ottetto (doppietto per l’idrogeno)
Legame Chimico I
Chimica generale ed Inorganica: Chimica Generale
elettroni di core e di valenza
legame ionico
Na+ Cllegame covalente
Cl—Cl
legame covalente polare
Li—Cl
ottetto
Legame Chimico I
Chimica generale ed Inorganica: Chimica Generale
simboli e formule di Lewis
Elettroni di valenza












