Chimica Organica
Informazione Scientifica sul Farmaco
Capitolo 13
Acidi Carbossilici e Derivati
Organic Chemistry, 5th Edition
L. G. Wade, Jr. Prentice Hall
Organic Chemistry, 3rd Edition
Paula Y. Bruice, Prentice Hall
Introduzione
•
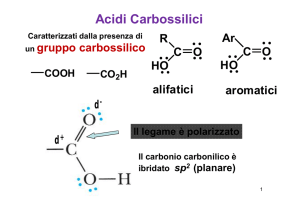
Il gruppo funzionale degli acidi carbossilici è costituito da un C=O con
legato un –OH.
O
R C
OH
•
•
•
•
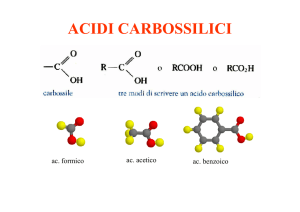
Il gruppo carbossilico normalmente si scrive -COOH.
Gli acidi carbossilici alifatici hanno un gruppo alchilico legato al COOH.
Gli acidi carbossilici aromatici hanno un gruppo arilico legato al COOH.
Gli acidi grassi sono acidi alifatici a lunga catena.
2
Importanza
•
•
•
•
•
Acido acetico, presente nell’aceto, usato nell’industria come
solvente, catalizzatore e reagente nelle sintesi.
Acidi grassi presenti in grassi e oli.
Acidi benzoici nei farmaci e nei conservanti.
Acido adipico usato per fare il nylon 66.
Acido ftalico usato per fare i poliesteri.
COOH
COOH
O
C
O
CH3
Acido acetilsalicilico
aspirina
CH3CHCH2
CH3
Acido stearico
Un acido grasso
CHCOOH
CH3
Ibuprofene
moment, antalgyl, nurofen
3
Nomi comuni
•
•
Molti acidi alifatici hanno nomi comuni.
Le posizioni dei sostituenti lungo la catena sono indicati con le lettere
greche.
Cl O
CH3CH2CHC OH
Acido -clorobutirrico
Ph
CH3CH2CH2CHCH2COOH
Acido -fenilcaproico
4
Nomi IUPAC
• La –o degli alcani è sostituita con -oico e si premette acido.
• Il carbonio carbossilico è il #1.
• Il gruppo carbossilico ha la priorità rispetto a doppi e tripli legami,
gruppi ossidrilici e carbonilici
Ph
Cl O
CH3CH2CHC OH
H
C C
H
Acido 2-clorobutanoico
COOH
Acido trans-3-fenil-2-propenoico
(acido cinnamico)
OH
8
4
7
6
5
2
3
9
1
COOH
O
Acido 5-etil-6-idrossi-7-metil-3-osso-7-nonenoico
5
Acidi carbossilici ciclici
• Quando un cicloalcano è legato direttamente ad un -COOH il nome è
acido cicloalcancarbossilico.
• Se il –COOH è legato al benzene l’acido si chiama benzoico.
COOH
CH(CH3)2
Acido 2-isopropilciclopentancarbossilico
COOH
OH
Acido o-idrossibenzoico
(acido salicilico)
6
Acidi bicarbossilici
• Gli acidi bicarbossilici hanno spesso nomi comuni (vanno
memorizzati).
• Nomi IUPAC: il gruppo 1 è quello più vicino al primo sostituente.
• Due gruppi carbossilici su un benzene: acidi ftalici.
Br
HOOCCH2CHCH2CH2COOH
Acido 3-bromoesandioico
(acido -bromoadipico)
7
Struttura del carbossile
•
•
•
Carbonio sp2.
Angoli di legame circa 120.
O-H eclissato con C=O, per avere la sovrapposizione degli orbitali
con il doppietto libero dell’ossigeno.
8
Proprietà fisiche
• Punti di ebollizione più alti di quelli degli alcoli di pari peso
molecolare a causa della formazione di dimeri.
• La solubilità in acqua diminuisce all’aumentare del numero di
carboni.
• Fino a 4 carboni gli acidi sono miscibili con l’acqua.
• Più solubili degli alcoli.
• Solubili anche in solventi moderatamente polari come il cloroformio,
9
si scioglie in forma di dimero.
Acidità
• Gli acidi carbossilici
(Ka~10-5) sono più
acidi dei fenoli
(Ka~10-10) e degli
alcoli (Ka~10-16)
• La maggiore acidità
è dovuta alla
stabilizzazione per
risonanza della
base coniugata
10
Effetto dei sostituenti sull’acidità
COOH
COOH
COOH
COOH
COOH
NO2
NO2
OCH3
p-methoxy benzoic acid
pKa = 4.46
m-nitro
pKa = 4.19 pKa = 3.47
NO2
p-nitro
o-nitro
pKa = 3.41
pKa = 2.16
11
Sali degli acidi carbossilici
•
•
L’idrossido di sodio rimuove un protone dagli acidi formando sali
Se si aggiunge un acido più forte, come HCl, si riforma l’acido
(l’acido forte sposta l’acido debole).
Aq. NaOH
RCOO-Na+
RCOOH
Aq. HCl
•
•
Nome dell’anione: sotituire -oico con -oato.
Nome del catione
Cl
-
+
CH3CH2CHCH2COO K
3-cloropentanoato di potassio
-clorovalerato di potassio
Proprietà dei sali
•
•
•
•
Di solito solidi ed inodori.
I carbossilati di Na+, K+, Li+, e NH4+ sono solubili in acqua.
I saponi sono i sali degli acidi grassi (acidi a lunga catena, 14-20
C).
I Sali si possono preparare per reazione di un acido con
NaHCO3, si sviluppa CO2.
13
Sintesi Review
•
Ossidazione degli alcoli primari e delle aldeidi con CrVI
(Na2Cr2O7/H2SO4).
CH3CH2CH2OH
O
CH3CH2CH
Na2Cr2O7
H2SO4
Na2Cr2O7
H2SO4
CH3CH2COOH
CH3CH2COOH
14
Derivati degli acidi carbossilici
• Il gruppo legato al carbonio acilico determina la classe del
composto:
O
-OH, acidi carbossilici
-Cl, cloruri acilici
-OR’, esteri
-NH2, ammidi
Carbonio acilico
C
R
OH
• Possono essere interconvertiti con una certa facilità
15
Nomenclatura esteri
• Sono identificati come alchil carbossilati.
• Il gruppo alchilico deriva da un alcol, il carbossilato da un acido.
CH3
O
O
HCOCH2
CH3CHCH2OCCH3
benzil metanoato
2-metilpropil etanoato
Esteri ciclici
• Reazione tra un -OH e un -COOH nella stessa molecola, lattone.
• Si premette la parola lattone al nome IUPAC dell’acido.
O
H3C
O
lattone 4-idrossi-2-metilpentanoico
16
CH3
Ammidi
•
•
Formalmente deriva da un acido carbossilico e da ammoniaca o
ammina.
Non sono basiche perché il doppietto dell’azoto
è delocalizzato.
_
O
C
H
O
N
H
C + H
N
H
H
H
•
•
•
Ammide primaria: un solo legame C-N (due N-H).
Ammide secondaria: (N-sostituita) due legami C-N (un N-H).
Ammide terziaria: (N,N-disostituita) tre legami C-N (nessun N-H)
O
H3C
C
NH2
Ammide 1°
H3C
O
CH3
C
NH
Ammide 2°
H3C
O
CH3
C
N
Ammide 3°
CH2CH3
17
Nomenclatura ammidi
•
•
Per le ammidi 1 sostituire -oico nel nome dell’acido con -ammide.
Per le 2 e 3, il gruppo alchilico legato all’azoto è preceduto da N-.
O CH3
CH3CHC N CH2CH3
CH3
Ammidi cicliche (lattami)
•
O
N-etil-N-metil-2-metilpropanammide
Legame ammidico intramolecolare, lattami.
N H
CH3
-valerolattame
18
Alogenuri acilici
• Si preparano dall’acido per reazione con SOCl2.
O
O
CH3CH2C
OH
SOCl2
CH3CH2C
Cl
• Sono più reattivi degli acidi carbossilici.
• Nome: sostituire -oico dell’acido con -oile e premettere il nome
dell’alogenuro
O
C
Br
Cl
cloruro di benzoile
Benzoil cloruro
O
CH3CHCH2C Br
bromuro di 3-bromobutanoile
3-bromobutanoil bromuro
19
Anidridi
•
•
Formalmente si ottengono da due molecole di acido per perdita di
una molecola di acqua.
Più reattive degli acidi, meno degli alogenuri.
O
O
O
R C O H
H O C
R
La parola acido sostituita con anidride.
Gli acidi bicarbossilici formano anidridi cicliche
di 5- o 6-termini.
O
CH3
O
C O C CH3
R C O C
R
O
Nomenclatura
•
•
O
O
O
Anidride 1,2-benzenedicarbossilica
Anidride ftalica
Anidride etanoica
20
Anidride acetica
Reattività: cloruri acilici
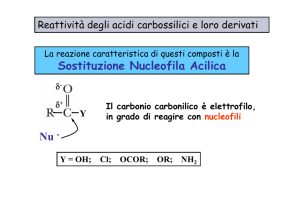
• Il carbonio carbossilico è elettrofilo, per cui reagisce con i nucleofili
(vedi anche composti carbonilici)
• Il cloruro è un buon gruppo uscente, la reazione prosegue
• La reazione prende il nome di sostituzione nucleofila acilica
• È facilitata da buoni gruppi uscenti.
O
O
+
C
R C H
O
R
H
Nu
+
Nu
C
R
Cl
O
O
O
+
C
C
R C Cl
R
Nu
R
Cl
Nu
Nu
21
Altri derivati cloruri acilici
• I cloruri acilici reagiscono con gli alcoli per formare esteri.
• Si tratta di una sostituzione nucleofila acilica.
O
O
CCl
COCH3
+ CH3OH
+ HCl
• I cloruri acilici reagiscono con ammoniaca e ammine per dare
ammidi.
O
O
CCl
CNHCH3
+ CH3NH2
NaOH
+ NaCl + H2O
22
Esterificazione di Fischer
•
•
•
•
Acido + alcol
estere + acqua.
Catalizzata dagli acidi.
Tutti i passaggi sono reversibili.
E’ un equilibrio, per cui vanno scelte opportunamente le
condizioni.
O
COOH
+ CH3CH2OH
+
H
COCH2CH3
+ HOH
23
Interconversione
•
I derivati più reattivi si
convertono facilmente in
quelli meno reattivi.
24
Idrolisi
Tutti i derivati reagiscono con H2O (con catalizzatore) per formare
acidi carbossilici
O
O
CH3
O
CH3
C OCH3 + HOH
O
CH3
CH3
C Cl + HOH
C NHCH3 + HCl
C OH
O
+
H
H2O
+ HCl
CH3
C OH
+ CH3OH
O
CH3
+
-
C OH + CH3NH3 Cl
25
Saponificazione
• Idrolisi degli esteri Base-catalizzata.
• “Saponificatione” perché è il metodo di preparazione tradizionale
dei saponi
• I saponi si preparano facendo bollire NaOH con i grassi
(trigliceridi) si formano i Sali sodici degli acidi grassi.
• Un esempio di sapone è il sodio stearato, Na+ -OOC(CH2)16CH3.
O
O
CH2 O- CR
RCO- CH
+
3 Na OH
saponification
O
CH2 O- CR
A triacylglycerol
(a triglyceride)
CH 2 OH
CHOH
O
+
CH 2 OH
1,2,3-Propanetriol
(Glycerol; Glycerin)
-
+
3 RCO Na
Sodium soaps
26
Come funziona un sapone
NaOH
27
Riduzione ad alcoli 1
• Si usano riducenti forti, LiAlH4.
• Il Borano, BH3 in THF, riduce gli acidi carbossilici ma non i chetoni.
28
Riduzione delle Ammidi
•
•
•
LiAlH4 riduce le ammidi 1° ad ammine 1°.
Le ammidi 2 sono ridotte ad ammine 2.
Le ammide 3 sono ridotte ad ammine 3.
O
CH3
C NHCH3
1) LiAlH4
2) H2O
CH3 CH2 NHCH3
29
Condensazione di Claisen
•
•
Gli idrogeni in al gruppo estereo hanno pKa circa 23 (i chetoni
circa 19)
Possono essere strappati con una base forte e formare uno ione
enolato
H
C
O
O
base
C
OR
C
C
O
C
OR
C
OR
30
Condensazione di Claisen
•
Lo ione enolato può attaccare una seconda molecola di estere
dando un -cheto estere
H
C
O
O
C
C
C
O
C
OCH2CH3
C
OR
OR
H3C
H
+
H2C
H
O
C
OR
O
C
C
- RO
OCH2CH3
O
C
C
O
C
C
OR
OR
O
C
H
-
1. CH3CH2ONa
2. HCl
H3C
O
O
C
CH2 C
OCH2CH3
+
CH3CH2OH
31
Polichetidi
•
Una serie di condensazioni di Claisen porta alla formazione di
polichetidi, precursori ad esempio degli antibiotici macrolidici
O
H3C
C
OCH2CH3
+
H2C
O
C
OCH2CH3
H
1. CH3CH2ONa
2. HCl
H3C
O
O
C
CH2 C
OCH2CH3
CH3COOCH2CH3
H3C
O
O
C
CH2 C
O
CH2COCH2CH3
n
H3C
O
O
C
CH2 C
O
CH2COCH2CH3
32
Fine del Capitolo 13
33