Molti alimenti, dal sapore “agro, brusco”e prodotti naturali in genere , contengono
uno o più acidi carbossilici: l’aceto contiene l’acido acetico e il limone l’acido citrico,
il sapore agro delle mele è dovuto all’acido malico.
Gli acidi carbossilici sono molto importanti sia dal punto di vista Biochimico che della
Chuimica Organica.
Sia gli acidi “liberi” che i loro sali sono presenti nei sistemi biologici.
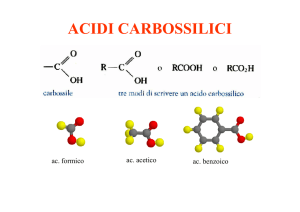
Come le aldeidi e chetoni, gli acidi carbossilici presentano il “ gruppo carbonilico”
C = O, ma presentano anche il “gruppo idrossilico”.
Nomenclatura IUPAC :
acido alcan - oico
OH
COOH
Nomenclatura dei Sali :
alcan-oato di metallo
Es : benzoato di sodio
Proprionato di Ca e Na
acido 3-idrossi-2,2-dimetil-butanoico
COOH
acido 10-undecilenico
Rappresentazione strutturale :
1.23 A
O
Geometria trigonale planare
LCAO: il C ibrido Sp3
C
120º
O
1.36 A
H
Proprietà Fisiche:
• Punti di ebollizione elevati, (HCOOH; acido formico PM 46, P.e 101°), dovuto alla
formazione di legami Ponte H
H
O
O
C
C
O
H
O
• C1 – C4 totale solubilità in acqua
• C3 – C10 sono responsabili dell’odore di “sporco” ( l’odore di “chiuso “ è dato
dall’acido butirrico).
In Vetrina :
Conservante di alimenti: inibisce la crescita di funghi
COO - Na+
H2C
Farmaco: trattamento delle infezioni da fungni sulla pelle
CH(CH 2)8COO - Zn +
OCOCH 3
Farmaco: anti dolorifico (Aspirina)
COOH
O
Droga:
HN
N
N
Dietilamide dell'acido lisergico(LSD)
Stato di OSSIDAZIONE del carbonio :
H
H
H
H
H
C
H
C
H
-2
-4
O
OH
H
O
H
C
C
O
C
O
OH
H
+2
0
+4
Gli acidi carbossilici si ottengono quindi per ossidazione :
+ KMnO4
R
+
OH
CrO 3
COOH
R
COOH
di un alcano
di un alcol primario
O
+
R
H
Ag+
R
COOH
di un’aldeide
Derivati degli acidi Carbossilici
¾Sono quei composti che mantengono lo stesso Stato di Ossidazione ( + 3 ) del
Carbonio nel – COOH
O
R
Acil alogenuro
X = alogeno
X
O
R
Anidride : condensazione fra due acidi
O
R
O
O
R
Estere : condensazioe fra acido e alcoli
R'
O
O
Ammide : condensazioe fra acido e ammina
Primaria secondaria e terziaria
R
N
R'
''R
O
R
R
NH
R
C
N
'RO
'RO
R
C
OR'
O
Immide
Nitrile
Orto estere
ACIDITA’ e formazione di Sali
CH3CH2OH + H2O
CH3CH2O
-
+ H3O+
Ka ≅ 10 -17
CH3COOH
CH3COO
-
+ H3O+
Ka ≅ 10 - 5
+ H2O
Composto
PKa
HCOOH
CH3COOH
FCH2COOH
ClCH2COOH
BrCH2COOH
Cl 2CHCOOH
PhCOOH
H2CO3
3.75
4.75
2.67
2.87
2.90
0.77
4.21
1°ionizz.6.36
2°ionizz.10.25
¾ Gli acidi Carbossilici sono i composti organici più acidi di tutti, ma confrontati
con gli acidi minerali sono acidi deboli
O
O
+ H2O
R
O
R
O
R
H
O
O
dissociazione
99%
1%
¾ se R = H invece di un carbonio l’acidità aumenta essendo l’H più elettronegativo .
¾ se sul C in α è presente un atomo di alogeno l’acidità aumenta a causa dell’effetto
induttivo elettron accettore , tale effetto diminuisce scendendo nel gruppo:F > Cl > Br >
¾ Se il n° di alogeni legati al C α aumenta , aumenta l’acidità.
¾ Tale effetto diminuisce drasticamente con la distanza : il ClCH2CH2COOH ha la +
stessa acidità dell’acido propionico
¾ La forma indissociata è presente a PH acidi mentre la base coniugata RCOO –
risulta presente a PH basici
¾ Sali di acidi carbossilici con basi forti danno idrolisi basica .
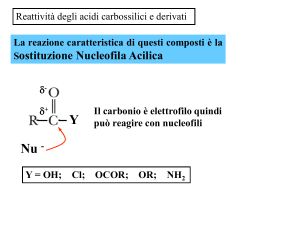
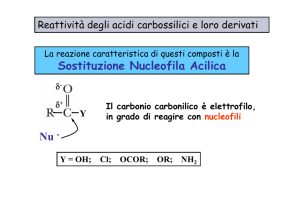
Reattività degli Acidi Carbossilici
O
R
1
O
H
2
Percorso 1
La rottura del legame C – O porta alla sostituzione nucleofila del gruppo OH o O–R.
Percorso 2
La rottura del legame O – H porta alla sostituzione elettrofila del H.
Sostituzione elettrofila del H
¾ La formazione di sali RCOOH + NaOH
→
RCOO – Na *.
¾ L’ossigeno dell’anione carbossilato è un buon nucleofilo sia nelle SN1 che SN2.
O
SN2
R
O
O
Br
R
O
Sostituzione Nucleofila del OH
¾ ESTERIFICAZIONE
C3 H7 COOH
H2SO4
+ C2 H5 OH
C3 H7 COO C2 H5 + H2 O
Meccanismo :
H
O
OH
OH
+
H
18
O R'
+
O
- H
R
R
R
OH
OH
OH
OH
OH
18
O R'
O H
R
R
R
'R
18
18
O R'
- H2O
R
OH
OH
OH2
18
O R'
Considerazioni :
l’uso dell’Ossigeno marcato permette di capire che abbiamo una sostituzione
nucleofila da parte dell’ossigeno* dell’alcol.
Formazione di alogenuri acilici
O
COOH
EtOOC
+ SOCL 2
EtOOC
+ SO 2
Nota : la reazione è con alogenuri di acidi inorganici
Cl
+ HCl
Formazione di anidridi
COOH
O
∆
+ P 2O5
O
O
+ 2 H 3PO4
Nota: La reazione è con anidridi inorganiche
OVVERO come schema generale :
O
R
δ+
+
δ−
H
O
Y
Y
R
Z
+
R
OH
H
Z
Y
Z
La reazione quindi la possiamo vedere come una addizione di un acido di Bronsted
H – Y al C = O e successiva eliminazione di un altro acido H - Z.
In generale possiamo parlare quindi di: Sostituzione Nucleofila degli acidi
Carbossilici e loro derivati
Da un punto di vista più biochimico, possiamo vedere questa reazione come un
Trasferimento di un gruppo Acile da Z ad un Nucleofilo Nu
O
-
Nu
R
O
H
Z
Nu
R
Z
Z : gruppo acilante
O
R
OH
Nu
Nu
R
Z
prodotto di acilazione
Prodotto di addizione
Reazioni degli alogenuri acilici
H3C
RCOCl
O
ammide
+ H3C
N
H
NH 2
O
O2N
O
NH 3+ Cl -
+ HCl
O
OH
Cl
estere
O2N
O
O2N
H2O
+ HCl
OH
acido
O2N
E' possibile formare un legame C - C con un sistema aromatico :
O
R
O
Cl
+ Al Cl
O
Al Cl
3
R
4
R
O
R
Acilazione di
Friedel-Craft
Reazioni delle anidridi
RCOOCOR'
O
RO
NH 2
RO
O
N
H
ammide
+
CH 3COOH
OH
O
O
O
CH 3COOH
+
estere
O
O
+
AlCl3
Anche le anidridi danno l'acilazione aromatica
chetone
CH 3COOH
Come gli acidi carbossilici, l'acido fosforico può essere convertito in anidride :
O
O
HO
P
O
OH
OH
OH
- H 2O
pirofosforico
P
+
O
P
HO
O
OH
+ HO
OH
P
OH
O
HO P OH
OH
P
HO
O
O
O
OH
- H 2O
O
P
O
P
OH
OH
OH
OH
trifosforico
Le due anidridi che si ottengono sono estremamente importanti in biochimica, infatti sono
capaci di trasferire energia essendo il legame P - O - P un legame definito ad "alta energia”.
Reazioni degli esteri RCOOR'
O
O
+
Ph
NH 2
+ CH 3OH
Ph
OCH 3
ammide
OCOR'
NHCH 3
OH
+
OCOR'
OH
OCOR'
OH
estere dell'acido
grasso
OH
trasmetilazione
grasso o olio
3 R'COOCH 3
+
L’idrolisi degli esteri ( saponificazione dei lipidi )
18
OH-
O
+ H 2O
'R
18
O18
O
+
R'
OR
OR
'R
O18 -
+ ROH
OH
'R
OR
O18H
Note :
l’idrolisi basica va a completezza perché si forma RCOO- che viene sottratto all'equiibrio,
a differenza dell'idrolisi acida, che per spostarla a sinistra bisogna togliere l'acqua..
Si conferma la Sostituzione nucleofila .
Polimeri "naturali"
HO
COOH
HO
HO
COOH
COOH
copolimero
acido lattico e glicolico
O
O
O
O
O
O
per suture chirurgiche
ha la proprietà di idrolizzare
entro sei mesi, quindi
"riassorbito"
O
Lactomero
Di interesse biochimico sono gli esteri dell'acido fosforico
O
O
P
OH
OH
OH
O
OH
P
O
OH
OH
P
O
OH
P
O
O
O
di estere
mono estere
glicerol fosfato
O
O
O
tri estere
La reazione tra l'anidride fosforica ed un alcol si chiama FOSFORILAZIONE,
un processo molto importante nei sistemi biologici : come trasferimento di energia
e come mezzo di solubilizzazione.
Reazioni delle ammidi RCONHR'
O
O-
H3O+
O
R
R
NH 2
NH 2+
OH
OH -
O
R
O-
L’unica reazione è l’idrolisi acida o basica.
Polimeri sintetici : Nylon 66
O
H2N
NH 2
Cl
Cl
O
O
H
N
NH
N
H
HN
O
Un'eccezione : La Penicillina
L'effetto antibiotico è dovuto alla sua forte reattività verso residui -SH di cisteine di
pareti cellulari di sistemi biologici, infatti :
L'ammide ciclica (β lattame) trasferisce facilmente il gruppo acile perché elimina la
tensione d'anello.
S
NHCOR'
N
HOOC
IN CONCLUSIONE
O
Possiamo vedere una reattività relativa dei derivati acilici
Z
alogeno
RCOCl
(RCO)2 O
RCOOR'
capacità
acilante
decrescente
RCOO-
O
R'O-
RCOOH
OH-
RCONHR'
R'NH-
δ+
R
Z
Due fattori :
⇒ Carattere elettrofilo del gruppo carbonilico (dipende dalla elettronegatività di
Z, e dalla sua coniugazione)
⇒ carattere di buon gruppo uscente di Z
quindi quest'ordine rispecchia le frequenze di stiramento dei legami e soprattutto
le costanti di acidità dei rispettivi acidi H - Z ( HCl > RCOOH > ROH > RNH2).
RIDUZIONE
O
+ H
R
-
R
Z
ZH
Z = O, N
Z = OR, OCOR, NHR, Alogeno
O
O
+ R'- metallo
R
R
Z
R'
Omet
met = Mg, Li, Na
R
'R
Z
OH
R
'R
R'
Reazione di sostituzione elettrofila sul C in α
In virtù della tautomeria, abbiamo lo stesso tipo di reazione dei composti carbonilici.
OH
COOR
Br2
Br
COOR
OR
enolestere
Condensazione di Claisen
⇒ Il primo stadio è analogo alla condensazione aldolica .
⇒ Il secondo stadio porta all'eliminazione del gruppo alcolico con formazione
di un β cheto estere.
OH
R
COOR
R
-
R
COOR
+ ROH
O
OR
R
OR
R
R
O
O
COOR
R
-
O
OR
OR
R
O
Se è presente un altro H sul C in α la reazione va a completezza perché si forma
l'anione, essendo questo più stabile.