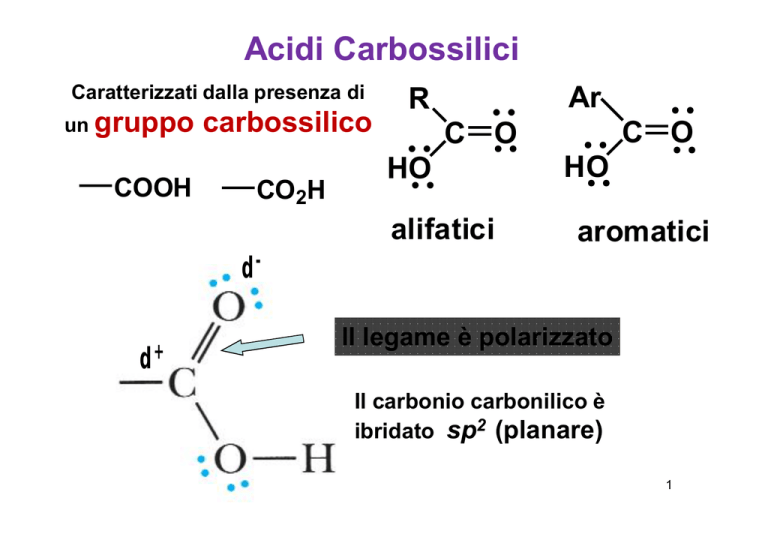
Acidi Carbossilici
Caratterizzati dalla presenza di
un gruppo
COOH
carbossilico
CO2H
Ar
R
C O
C O
HO
alifatici
HO
aromatici
dd+
Il legame è polarizzato
Il carbonio carbonilico è
ibridato sp2 (planare)
1
Nomenclatura (IUPAC): Il nome degli acidi carbossilici si ricava da quello degli
alcani togliendo la o e mettendo al suo posto il suffisso oico e facendo precedere
il nome dalla parola acido
CH 3
H
C O
H3C
HO
C
O
COOH
CH3CH2CHCH2CH 2COH
acido etanoico
acido acetico
1
4
HO
acido metanoico
acido formico
O
acido 4-metilesanoico
acido benzoico
O
acido 4-esenoico
H 3CHC
4
CHCH2CH 2COH
Acidi bicarbossilici
COOH
COOH
COOH
COOH
COOH
COOH
CH2
CH 2
CH2
CH 2
ossalico
COOH
CH 2
CH2
CH 2
malonico
COOH
CH2
COOH
CH 2
CH 2
succinico
glutarico
COOH
adipico
acido esandioico
2
Quando si usano i nomi comuni si aggiungono spesso le
lettere greche a, b, g, d, e per indicare la posizione dei
sostituenti
Acido g-idrossibutirrico
H
9
C
H3C(H2C)7
C
H
Acido a-amminopropionico
(Alanina)
(CH2)7COOH
Acido cis-9-ottadecenoico
(acido oleico)
Gruppo acetile
3
Alcuni acidi carbossilici alifatici
Struttura
HCOOH
CH3COOH
CH3CH2COOH
CH3(CH2)2COOH
CH3(CH2)3COOH
CH3(CH2)4COOH
CH3(CH2)6COOH
CH3(CH2)8COOH
CH3(CH2)10COOH
CH3(CH2)12COOH
IUPAC
acido
metanoico
etanoico
propanoico
butanoico
pentanoico
esanoico
ottanoico
decanoico
dodecanoico
tetradecanoico
Nome comune
acido
formico
acetico
proprionico
butirrico
valerianico
caproico
caprilico
caprico
laurico
miristico
CH3(CH2)14COOH
esadecanoico
palmitico
CH3(CH2)16COOH
ottadecanoico
stearico
CH3(CH2)18COOH
eicosanoico
arachidico
4
Proprietà fisiche
Formano dei legami idrogeno
intermolecolari molto forti
Hanno dei punti di
ebollizione più alti di alcol,
aldeidi, chetoni di pari peso
molecolare
legame idrogeno
Aumenta la parte
La solubilità in acqua diminuisce
lipofila nella molecola
all’aumentare del peso
molecolare
coda idrofobica (non polare)
COOH
testa polare
Acido decanoico
CH3-(CH2)8-COOH
5
CH3COOH I-CH2COOH Br-CH2COOH Cl-CH2COOH F-CH2COOH
pKa
2.90
4.76
3.18
2.86
2.59
Acidità crescente
CH2-COOH + H2O
Cl
d+ CH2-COOd- Cl
+ H3O+
Solubilità in acqua dei sali degli acidi carbossilici:
poco solubile in acqua
buona solubilità in acqua
6
Riduzione di un gruppo carbossilico
Il LiAlH4 è un potentissimo riducente
E’ possibile effettuare delle riduzioni selettive
Acido 5-ossoesanoico
Acido 5-idrossiesanoico
7
La decarbossilazione è la perdita del gruppo
carbossilico per eliminazione di CO2
Calore
reazione lenta
La reazione è molto più veloce nei b-chetoacidi
calore
acido 3-ossobutanoico
reazione veloce
Perché in questo caso la decarbossilazione è più veloce?
8
Meccanismo di decarbossilazione di un b-chetoacido
Stadio 1 Stato di transizione ciclico e risistemazione di sei e-
Stadio 2
Equilibrio cheto-enolico
9
Decarbossilazione di -chetoacidi
H
H
O
O
O
C
C
C
H3C
CH2
O
acido acetoacetico
-ossobutanoico
H3C
+
CH 2
O
O
C
C
O
enolo
del chetone
H3C
+ CO2
CH3
acetone
Ciclo degli acidi tricarbossilici (TCA) Krebs
HOOC
O
O
COOH
COOH
HOOC
COOH
acido -chetoglutarico
10
Derivati degli acidi carbossilici
Per sostituzione dell'ossidrile del carbossile si ottengono vari
derivati degli acidi carbossilici, noti come derivati acilici
O
Gruppo acilico
Ar/R
(Ar) R
C
X
X= OH acidi carbossilici
O X= OR esteri
X=-NH2, NHR, NRR'; ammidi
X= OCOR' anidridi
X= alogeni; alogenuri acilici
11
I derivati degli acidi carbossilici
O
R
C
Cl
Cloruri acilici
(cloruri degli acidi)
O
R
O
C
R
C
OH
O
Acido
carbossilico
R
C
O
Anidridi degli acidi
O
O
R
C
O R'
Esteri
R
NH2
Ammidi
12
Alogenuri acilici: Prendono il nome dagli acidi
carbosssilici cambiando il suffisso ico in ile e premettendo
la parola cloruro (alogenuro)
O
R C
Cl
Cloruro di etanoile
(Cloruro di acetile)
Cloruro di benzoile
Anidridi degli acidi carbossilici: Prendono il nome dagli
acidi carbossilici da cui derivano
Anidride acetica
Anidride benzoica
R
C
C
O
O
R
O
13
Esteri: Il gruppo alchilico (o arilico) viene nominato per primo,
seguito dal nome dell’acido cambiando il suffisso oico in ato:
H3C
O
C O
C O CH2CH3
H3C O
etanoato di metile
acetato di metile
benzoato di etile
H3CH2CH2C
C O
O
propanoato di terz -butile
H3C C CH3
CH3
14
Ammidi
degli acidi carbossilici: Il nome si ricava da quello degli
alcani togliendo la o e mettendo al suo posto il suffisso ammide
O
R
NH2
CH3
NH2
etanammide
(acetammide)
H
CH3CH2
NH2
NH2
propanammide
benzammide
N(CH3)2
N,N-dimetilformammide (DMF)
15
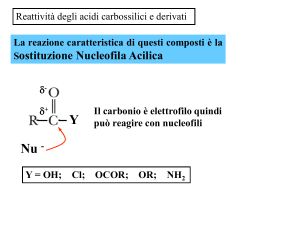
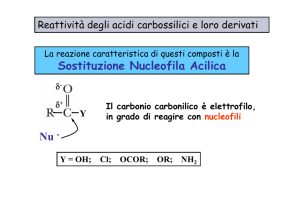
Reattività degli acidi carbossilici e derivati:
Sostituzione Nucleofila Acilica
d-
d+
Nu
Il carbonio è elettrofilo quindi può
reagire con i nucleofili
Y
Y = OH;
Nu
+ R
C O
X
a
Cl;
OCOR;
Nu
R C O
-
X
intermedio
tetraedrico
b
OR;
NH2
Nu
C O + XR
16
Mecanismo generale della Sostituzione Nucleofila Acilica
Stadio 1: il nucleofilo si addiziona al carbonile
La forza del nucleofilo
attaccante influenza la
velocità del 1° stadio
Stadio 2: l’intermedio tetraedrico riforma il carbonile ed
espelle il gruppo uscente (eliminazione)
La bontà del gruppo
uscente (facilità della sua
eliminazione) determina
la velocità del 2° stadio
Nel complesso si ha una reazione di sostituzione
17
Capacità come gruppo uscente
Basicità crescente
Nu
R
+ C O
X
a
Nu
R C O
-
X
intermedio
tetraedrico
b
Nu
C O + XR
18
Reattività crescente
O
R C
R C X >
O
O
O
O > R C OR' , R C OH > R C NHR
R C
alogenuri
acilici
O
esteri
ammidi
acidi
anidridi
Tale ordine è determinato, a parità di nucleofilo, da due fattori:
1) elettrofilicità del carbonio carbonilico
quanto più il gruppo legato al carbonile è elettronattrattore tanto
più l'attacco del nucleofilo è favorito
2) quanto migliore è la bontà del gruppo uscente tanto più la
reazione è favorita
19
Perché aldeidi e chetoni danno l’addizione nucleofila al C=O
mentre i derivati degli acidi carbossilici danno la sostituzione
nucleofila al C=O ?
Addizione
Sostituzione
La differente reattività è dovuta al fatto che aldeidi e chetoni non
posseggono un buon gruppo uscente.
20
Carbanione e ione idruro (H-) sono basi fortissime.
Formazione degli alogenuri acilici da acidi
carbossilici
O
OH
acido butanoico
O
+ SOCl2
cloruro di
tionile
Cl + SO2 + HCl
cloruro di
butanoile
21
Esterificazione di Fischer
Formazione di esteri da acidi carbossilici
Etanoato di etile
(acetato di etile)
La esterificazione di Fischer è una reazione catalizzata
da acidi ed è una Sostituzione Nucleofila Acilica
22
Meccanismo dell’esterificazione di Fischer
23
Meccanismo dell’esterificazione di Fischer
O
H2SO4
CH3OH
CH3 COH +
ac.acetico alcol metilico
O
CH3 COCH3 + H2O
acetato di metile
1) protonazione dell'acido carbossilico
+
O
H3C COH + H+
OH
H3C COH
O H
H3C C OH
+
O H
+
H3C C OH
2) addizione nucleofila del metanolo sul carbonile dell'acido
O H
H3C C OH
+
+
CH3OH
O H
H3C C OH
O+
H3C
H
24
Meccanismo dell’esterificazione di Fischer
3) trasferimento veloce del protone dall'alcol protonato
all'ossidrile
+
O H
H O H
+
H 3C C OH
H3C C OH + H2O
H3C C OH
O+
H3 C O
H3C O
H3C
H
4) deprotonazione dell'estere e ripristino del catalizzatore
acido
+
+ H+
H3C C OH
H3 C C O
H3 C O
H3C O
Il protone H+ non è mai nudo ma sempre solvatato, in questo
caso dal CH3OH che è anche il solvente di reazione
25