04/04/14
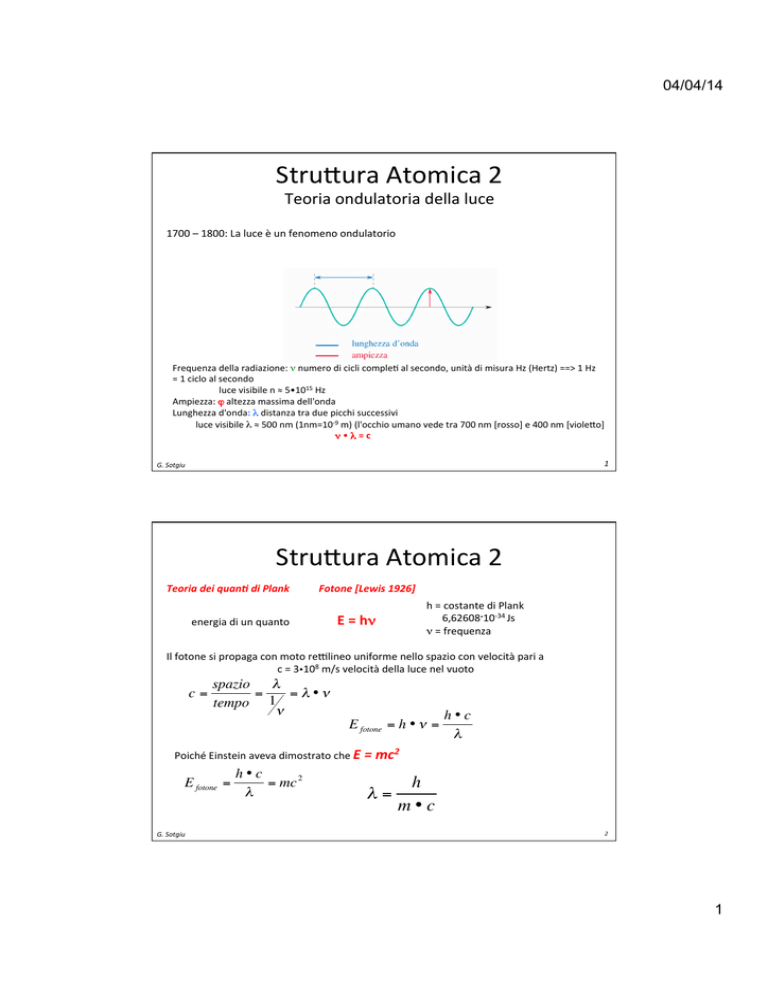
Stru%ura Atomica 2 Teoria ondulatoria della luce 1700 – 1800: La luce è un fenomeno ondulatorio Frequenza della radiazione: ν numero di cicli comple@ al secondo, unità di misura Hz (Hertz) ==> 1 Hz = 1 ciclo al secondo luce visibile n ≈ 5•1015 Hz Ampiezza: ϕ altezza massima dell'onda Lunghezza d'onda: λ distanza tra due picchi successivi luce visibile λ ≈ 500 nm (1nm=10-­‐9 m) (l'occhio umano vede tra 700 nm [rosso] e 400 nm [viole%o] ν • λ = c 1 G. Sotgiu Stru%ura Atomica 2 Teoria dei quan, di Plank Fotone [Lewis 1926] energia di un quanto h = costante di Plank 6,62608.10-­‐34 Js ν = frequenza E = hν
Il fotone si propaga con moto re\lineo uniforme nello spazio con velocità pari a c = 3108 m/s velocità della luce nel vuoto c=
€
spazio λ
=
= λ•ν
tempo 1
ν
E fotone = h • ν =
h•c
λ
Poiché Einstein aveva dimostrato che E = mc2 E fotone =
h•c
2
= mc
€
λ
G. Sotgiu λ=
h
m•c
2 €
€
1
04/04/14
Stru%ura Atomica 2 Teoria di De Broglie [1924] par@celle dotate di massa ed in movimento possono avere proprietà ondulatorie Per un corpo dotato di massa m e velocità v Par@celle pesan@ hanno lunghezze λ = h/m v d’onda molto corte che non possono essere osservate lunghezza d’onda dell’onda stazionaria associata al moto della par@cella di massa m onda stazionaria: non c’è dissipazione di energia, i pcchi non si muovono lungo la corda G. Sotgiu per la vibrazione a più bassa energia (fondamentale) esiste una sola possibile vibrazione ==> n = 1 • per n = 1 non vi sono nodi (ampiezza = 0) • al crescere di n cresce il numero di nodi pari a (n-­‐1) • permessi solo alcuni modi di vibrare 3 Stru%ura Atomica 2 Teoria di De Broglie [1924] ü Ci possono essere solo alcune lunghezze d’onda per ciascuno dei mo@ permessi della corda (per stazionarietà) ü Esistenza di sta@ discre@ e di valori discre@ di energia come naturale conseguenza del confinamento di un ogge%o con natura ondulatoria in una regione finita dello spazio Se l’ele%rone si comporta come un’onda stazionaria nell’atomo di idrogeno, allora la lunghezza d’onda deve stare esa%amente dentro l’orbita. 2π r = nλ con n = 1,2,3,.... λ = h/m v mvr = nh/2π 2π r = nh/m v Il postulato di De Broglie ha come conseguenza la quan@zzazione del momento angolare e dei livelli energe@ci dell’atomo di idrogeno G. Sotgiu 4 2
04/04/14
Stru%ura Atomica 2 Principio di Indeterminazione di Heisemberg [1926] Un’onda si estende su una regione dello spazio: come localizzarla? Non è possibile determinare simultaneamente ed accuratamente la posizione e il momento di una par=cella di massa m dove Δx = incertezza sulla posizione Δmv = incertezza sul momento Δx Δmv ≥ h/4π
a) b) a) un’onda è estesa su una ampia porzione di spazio , con una lunghezza d’onda ben definita. Quindi piccola incertezza sul momento (lunghezza d’onda), ma ampia incertezza su posizione b) si ha una elevata localizzazione nella posizione (Δx molto piccolo) ma la lunghezza d’onda è difficilmente definibile (ampia incertezza sul momento). G. Sotgiu 5 Stru%ura Atomica 2 Principio di Indeterminazione di Heisemberg [1926] è impossibile a%ribuire all’ele%rone un moto @po orbita ben definito par,cella onda DUALISMO L’Equazione di Schrödinger [1926] Descrive le proprietà ondulatorie dell’ele%rone: posizione, massa, E totale, E potenziale Ψ = funzione d’onda descrive l’onda associata all’ele%rone nello spazio descrive un orbitale atomico HΨ = EΨ
H = operatore Hamiltoniano E = energia dell’ele%rone Differen@ orbitali hanno differen@ Ψ e quindi differen@ E G. Sotgiu 6 3
04/04/14
Stru%ura Atomica 2 L’Equazione di Schrödinger [1926] HΨ = EΨ
⎡ − h 2 ⎛ δ 2 δ 2 δ 2 ⎞
⎤
⎢ 2 ⎜⎜ 2 + 2 + 2 ⎟⎟ + V ( x, y, z )⎥ Ψ( x, y, z ) = EΨ( x, y, z )
⎣ 8π m ⎝ δx δy δz ⎠
⎦
Energia Cine@ca V=
− Ze 2
4πε o x 2 + y 2 + z 2
=
− Ze 2
4πε o r
Energia Potenziale h = costante di Planck m = massa della par@cella E = Energia totale del sistema e = carica dell’ele%rone (x2 + y2 + z2)1/2 = r = distanza dal nucleo Z = carica del nucleo 4πεo = permi\vità del vuoto G. Sotgiu 7 Stru%ura Atomica 2 L’Equazione di Schrödinger [1926] Esistono infinite soluzioni dell’eq. di Schrödinger, ciascuna descrive un ele%rone in un orbitale atomico Il significato di Ψ
• Ψ non ha un significato fisico, è solo un’espressione matema@ca • Ψ2 = probabilità di trovare l’ele%rone in un dato punto dello spazio o Se si considera tu%o lo spazio allora Ψ2 = 100% o Se si considera dove l’ele%rone sta per il 90% del tempo, Ψ2 = orbitale atomico Vincoli fisici su Ψ
• Ψ deve avere un solo valore perché un dato ele%rone ha una sola energia • Ψ ed Ψ2 devono essere con@nue perchè l’ele%rone non può “saltare” • Ψ ––> 0 come r ––> ∞ perché la probabilità deve decrescere allontanandosi • La probabilità totale di trovare l’ele%rone deve essere = 1 G. Sotgiu 8 4
04/04/14
Stru%ura Atomica 2 L’Equazione di Schrödinger [1926] Funzioni d’onda atomiche Risoluzione matema@ca per l’atomo H: nucleo carico + ed un ele%rone – Si o%engono soluzioni contenen@ 4 parametri de\ numeri quan@ci Regole di selezione Simbolo Nome Valori Ruolo n l m ms Principale 1,2, 3,... Determina la maggior parte dell’energia Angolare 0, 1, 2,...,n – 1 Descrive la dipendenza angolare e contribuisce all’energia 0, ±1, ±2, ±l Descrive l’orientazione nello spazio (momento angolare nella direzione z) ± ½ Descrive l’orientazione dello spin ele%ronico nello spazio (momento magne@co) Magne=co Spin Se non è presente un campo magne@co, tu\ i valori di m hanno la stessa energia ed anche entrambi i valori di ms G. Sotgiu 9 Stru%ura Atomica 2 Forma degli orbitali atomici nell’atomo di idrogeno La forma degli orbitali, e quindi la distribuzione spaziale della probabilità di trovare l'ele%rone in un punto a%orno al nucleo, dipende dai valori dei numeri quan@ci Rappresentazione grafica G. Sotgiu 10 5
04/04/14
Stru%ura Atomica 2 Forma degli orbitali atomici nell’atomo di idrogeno l = 0 ORBITALE TIPO S G. Sotgiu 11 Stru%ura Atomica 2 Forma degli orbitali atomici nell’atomo di idrogeno l = 1 m = 1, 0, -­‐1 G. Sotgiu ORBITALE TIPO P 12 6
04/04/14
Stru%ura Atomica 2 Forma degli orbitali atomici nell’atomo di idrogeno l = 2 m = 2,1, 0, -­‐1,-­‐2 ORBITALE TIPO d G. Sotgiu 13 Stru%ura Atomica 2 Orbitali atomici nell’atomo di idrogeno N° quan@co l
so%olivello 0
s
1
p
2
d
3
f
4
g
5
h
6
i
valore di n (numero) Xy valore di l (le%era) G. Sotgiu 14 7
04/04/14
Stru%ura Atomica 2 Orbitali atomici nell’atomo di idrogeno N° quan@co l
so%olivello 0
s
1
p
2
d
3
f
4
g
5
h
6
i
Per l'atomo di idrogeno l’energia dipende solo da n, per cui tu\ gli orbitali dello stesso guscio hanno la stessa energia (es: 3s, 3p, 3d) Energia degli orbitali: il valore dell'energia di un orbitale è, in modulo, il valore dell'energia necessaria a portare l'ele%rone a distanza infinita rispe%o al nucleo E ha valori sempre nega@vi E ––> 0 e r ––> ∞ per n ––> ∞ G. Sotgiu 15 Stru%ura Atomica 2 Orbitali atomici per atomi poli-­‐ele%ronici – TIPO orbitali – FORMA orbitali – DIMENSIONE orbitali ≈ orbitali idrogeno Per atomi mul@-­‐ele%ronici le energie sono in parte determinate anche da l
Sequenza energe@ca orbitali 1s < 2s < 2p < 3s < 3p < 4s ≈ 3d < 4p <5s < 4d < 5p < 6s … Orbitali sullo stesso livello di energia sono de\ degeneri G. Sotgiu 16 8
04/04/14
Stru%ura Atomica 2 Configurazione Ele4ronica Rappresenta la distribuzione degli ele%roni nei vari orbitali per un dato atomo cioè fornisce le combinazioni di numeri quan@ci che perme%ono di definire le funzioni d’onda associate agli ele%roni cos@tuen@ l’atomo. TRE principi: 1) Scala di energia: gli e– sono colloca@ su orbitali per dare la più bassa energia • Si riempiono prima i più bassi valori di n e l • i valori di ml e non influenzano l’energia 2) Principio di esclusione di Pauli = ogni e– ha un unico set di numeri quan@ci Almeno un num. quan@co deve essere differente: 2 e– sullo stesso orbitale devono avere ms = +/-­‐ ½ 3) Regola di Hund: gli e– colloca@ su orbitali degeneri, devono avere il massimo valore di spin possibile G. Sotgiu 17 Stru%ura Atomica 2 Configurazione Ele4ronica Esempio di Auƒau: atomo di ossigeno Z = 8 ==> 8 ele%roni (stato fond.) criterio energia + Pauli + Hund criterio energia criterio energia + Pauli criterio energia criterio energia + Pauli criterio energia Notazione per ossigeno: 1s2 2s2 2p4 Notazione abbreviata: sodio Na Z = 11 ==> 1s2 2s2 2p6 3s1 [Ne] 3s1 Notazione di Lewis G. Sotgiu 18 9
04/04/14
Stru%ura Atomica 2 Configurazione Ele4ronica Nickel: (1s2)(2s22p6)(3s23p6)(3d8)(4s2) Ma poiché la sequenza energe@ca orbitali era 1s < 2s < 2p < 3s < 3p < 4s ≈ 3d < 4p <5s < 4d < 5p < 6s … si “riempiono” prima gli orbitali 4s che i 3d Eccezioni: (da Z = 20 in poi) nel riempimento di alcuni orbitali d e f Esempio: cromo Cr Z = 24 [Ar]3d54s1 e non [Ar]3d44s2 rame Cu Z = 29 [Ar]3d104s1 e non [Ar]3d94s2 Spiegazione classica: shell piene o semi-­‐piene sono par@colarmente stabili G. Sotgiu 19 Stru%ura Atomica 2 G. Sotgiu 20 10
04/04/14
Stru%ura Atomica 2 lantanidi a\nidi metalli di transizione G. Sotgiu 21 Stru%ura Atomica 2 -­‐ Proprietà Periodiche Energia di prima Ionizzazione: energia minima necessaria per allontanare completamente un e– (il più esterno) da un atomo gassoso nel suo stato fondamentale Eion + A(g) –––> A+(g) + e– Eion = Energia di Ionizzazione a) Aumento di Eion lungo un periodo al crescere di Z in linea con l’a%razione per l’e– b) Successive ionizzazioni c) Eccezioni i. B p-­‐orbital 2s22p1 più facile da rimuovere – – – ii. O 2s22p4 : e– più facile da rimuovere iii. Andamento simile negli altri periodi G. Sotgiu 22 11
04/04/14
Stru%ura Atomica 2 -­‐ Proprietà Periodiche Energia di Ionizzazione d) Metalli di transizione hanno solo piccole differenze e) Ampia diminuzione all’inizio di un nuovo periodo perché un nuovo orbitale s possiede una energia molto più elevata f) Per i gas nobili diminuisce al crescere di Z perché e– più lontani dal nucleo g) Ionizzazioni successive tengono conto della stru%ura ele%ronica G. Sotgiu 23 Stru%ura Atomica 2 -­‐ Proprietà Periodiche Affinità per l’ele4rone (EA) = Variazione di energia associata all’acquisto di un e– per un atomo gassoso X(g) + e– -­‐-­‐-­‐-­‐-­‐-­‐-­‐> X– (g) 1. Energie di solito inferiori rispe%o alla ionizzazione 2. EA in generale diventa più nega@vo da sin a ds 3. EA diminuisce lungo un gruppo L’e– è più lontano dal nucleo, si osserva minore interazione G. Sotgiu 24 12
04/04/14
Stru%ura Atomica 2 -­‐ Proprietà Periodiche Raggio Atomici Le dimensioni di un atomo sono difficili da determinare: •
distribuzione radiale degli orbitali (curva che va a zero solo a distanza infinita); come fissare un limite per l’atomo •
presenza di altri atomi (cambiano da un composto ad un altro) -­‐
Diverse definizioni per il “raggio atomico” Raggio covalente (o atomico) E’ definito come metà della distanza fra due atomi dello stesso @po uni@ da un legame covalente singolo in una molecola. G. Sotgiu 25 Stru%ura Atomica 2 -­‐ Proprietà Periodiche Raggio Atomici Graduale diminuzione lungo un periodo al crescere di Z (maggiore a%razione per gli e–) Generalmente aumenta scendendo in un gruppo pm = 1 x 10–12 m G. Sotgiu 26 13
04/04/14
Stru%ura Atomica 2 -­‐ Proprietà Periodiche Raggio Ionici (da da@ cristallografici) Ca@one più piccolo dell’atomo neutro Anione più grande dell’atomo neutro Raggio decresce all’aumentare della carica posi@va G. Sotgiu 27 Stru%ura Atomica 2 -­‐ Proprietà Periodiche Ele4ronegaKvità Capacità di un atomo (coinvolto in un legame chimico) di a\rare su di sé gli e– di legame Scala di ele%ronega@vità di Pauling Definizioni D = Energia di dissociazione del legame (es A—A à A·∙ + A·∙) Δ = Energia di risonanza ionica (kJ) χA = Ele%ronega@vità of A Equazioni [D(A − A) + D(B − B)]
Δ(A − B) = D(A − B) −
2
χA − χB = k Δ
€
Per F (fluoro) viene posto χ = 4.0 e per gli altri atomi si parte da esso €
G. Sotgiu 28 14
04/04/14
Stru%ura Atomica 2 -­‐ Proprietà Periodiche Ele4ronegaKvità Graduale aumento lungo un periodo (da sn a ds) Generalmente diminuisce scendendo in un gruppo G. Sotgiu 29 15