II
Cinetica chimica
AS 2007/2008
Cinetica chimica
di Claudia Pedroni
La parola cinetica ha la stessa origine delle parole cinema e cinematica: viene dal greco
e contiene il significato di movimento.
Cosa accade durante una reazione chimica?
Cambiano i legami fra atomi, cioè si spezzano e si formano legami chimici (nubi
elettroniche). Affinché una reazione chimica possa avvenire, è necessario che le nubi
elettroniche (i legami chimici) si compenetrino, solo così possono cambiare i legami
chimici tra gli atomi. In una reazione chimica i reagenti devono quindi scontrarsi
secondo un orientamento ben preciso e con un'energia sufficiente: in altre parole
devono avvenire degli urti efficaci.
Nel momento in cui i reagenti sono così vicini tra loro che si modificano i legami fra
atomi, si forma un aggregato: lo stato di transizione.
Durante una reazione chimica si modificano geometria e energia complessiva delle
particelle; l'energia di attivazione (Ea) è l'energia necessaria ai reagenti per formare
lo stato di transizione.
Fattori che influenzano la velocità di una reazione chimica?
Concentrazione: la probabilità di scontro (incontro) tra reagenti è tanto più alta
quanto maggiore è la loro concentrazione.
Temperatura: la probabilità di scontro (incontro) tra reagenti è tanto più alta
quanto maggiore è la velocità media con cui si muovono le loro particelle. La
temperatura è un valore proporzionale all'energia cinetica media delle
particelle, quindi alla loro velocità al quadrato.
Pagina 1
II
Cinetica chimica
AS 2007/2008
Superficie di contatto: ha senso considerarla solo se la reazione avviene in un
miscuglio eterogeneo (esempio: Zn(s) + HCl(aq) ZnCl2(aq) + H2(g)); maggiore è la
superficie di contatto tra reagenti, più alta è la probabilità di un loro incontro.
Catalizzatore: fornisce una possibilità di reazione secondo un percorso
alternativo che richiede meno energia di attivazione; il catalizzatore non
partecipa alla reazione, cioè non si consuma.
(esempio: per idrolizzare le proteine in 1 cm3 di carne tritata occorre scaldare
per 24 ore a riflusso con 6M HCl; la stessa porzione viene digerita in poche ore
a 37°C grazie agli enzimi)
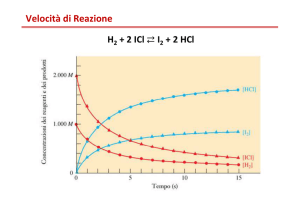
Come definire la velocità di una reazione chimica?
Durante una reazione chimica si consumano i reagenti e si producono i prodotti.
Velocità = variazione di concentrazione di 1 componente / tempo impiegato
Equazioni che mettono in relazione la velocità con i fattori che la influenzano
Si consideri la seguente reazione chimica: a A + b B c C + d D
L'equazione cinetica è:
v = k . [A]m . [B]n
L'equazione di Arrhenius è:
k = A . e-Ea/RT
Dove
[A], [B]
m, n
v
k
A
e
Ea
R
T
sono le concentrazioni molari dei reagenti
sono gli esponenti ricavati
sperimentalmente che definiscono
l'ordine di reazione
è la velocità di reazione
è la costante di velocità
è una costante in relazione a frequenza e
orientamento degli urti
è la base dei logaritmi naturali
è l'energia di attivazione
costante universale dei gas (8,31 J.K-1.mol-1)
è la temperatura in Kelvin
Esempi su cui riflettere
a. Lo zucchero si scioglie più in fretta in acqua quando è in forma di granulato che
quando è una zolletta?
b. Il sale da cucina si scioglie più velocemente in acqua calda che in acqua fredda?
c. La polvere di carbone in una miniera provoca un'esplosione (cos'è dal punto di vista
cinetico? A cosa è dovuta l'azione devastatrice di un'esplosione?).
d. In un motore a combustione interna azoto e ossigeno elementari si combinano per
dare NO (monossido di azoto).
Pagina 2
II
Cinetica chimica
AS 2007/2008
e. Idrogeno e ossigeno elementari si combinano per dare acqua in modo esplosivo
quando c'è una fiamma.
Esercizi
1. Con l’equazioni cinetica e di Arrhenius spiegare la dipendenza di velocità di reazione
dai fattori citati.
2. Descrivere gli esperimenti da effettuare per trovare l’ordine di una reazione,
rispettivamente Ea.
3. Quando una reazione chimica avviene a più tappe, qual è quella più importante per la
velocità complessiva del processo?
4. Considerare la reazione di sintesi dell'ammoniaca a partire dai suoi elementi
costituenti: qual è la velocità di scomparsa di un elemento rispetto all'altro? Qual è
la velocità di formazione del composto in rapporto a quella di scomparsa di ciascun
elemento? Calcolare la velocità di scomparsa, se quella di formazione del composto
è 0,3 M/s.
5. Se una reazione avviene sia in soluzione liquida, sia in soluzione gassosa, quando è
più veloce, perché?
6. Spesso la velocità di una reazione raddoppia o dimezza variando la temperatura di
10°C. Se una reazione a 100°C avviene in 20 minuti, quanto ci impiega a 120°C e
quanto a 80°C? La velocità di reazione è proporzionale o inversamente proporzionale
alla temperatura?
Pagina 3