Proteine Integrali di Membrana - Struttura α-elica
Struttura α-elica delle proteine di membrana
Le proteine transmembrana nella maggior parte attraversano la membrana in conformazione
α-elica (residui apolari). Poiché i legami peptidici sono polari e poiché l’acqua è assente nel
doppio strato, essi formano tra loro legami idrogeno favoriti da tale conformazione
La spinta a massimizzare legami H in assenza di acqua significa che una catena
polipeptidica che entra nel doppio strato è probabile che passi interamente attraverso
di esso prima di cambiare direzione, poiché il ripiegamento della catena richiede una
perdita di interazioni regolari di legami H
Prozione Polipeptidica del Centro di reazione fotosintetico
Grafici di Idropatia
Difficili da cristallizzare e pertanti difficili da studiare per cristallografia ai raggi
X
Grafici di idropatia per localizzare potenziali segmenti ad α-elica di una catena polipeptidica
Indice di idropatia: l’energia necessaria per trasferire segmenti successivi di una catena polipeptidica
da un solvente NON polare all’acqua.
Il calcolo viene fatto per segmenti di 10-20 aa iniziando da ciascun aa successivo della catena.
Valori positivi: è richiesta energia per il trasferimento all’acqua – segmento idrofobico.
La Glicoforina A tipica proteina transmembrana ad attraversamento singolo
Piccola glicoproteina (131 aa,30kDa) dei globuli rossi. Presente in forma dimerica.
Abbondante (106 copie per cellula).
La parte N-terminale è glicosilata. Funzione sconosciuta.
La Batteriorodopsina proteina transmembrana ad attraversamento multiplo
Pompa protonica attivata dalla luce – sette α-eliche.
Trasduttore di energia solare in energia utile alla cellula
Archeo Halobacterium Salinarum. Batteri
fotosintetici
Chiazze di membrana purpurea contenenti
molecole di batteriorodopsina
Il cromoforo in grado di assorbire
fotoni luminosi. In seguito al
legame con un singolo fotone si
eccita, determina un
cambiamento conformazionale
della proteina che trasporta H+ al
di fuori della cellula.
Ciò crea un gradiente di protoni a
cavallo della membrana
plasmatica che fornisce energia
alla cellula.
E’ identico al cromoforo nella
rodopsina delle cellule
fotorecettrici dell’occhio dei
vertebrati.
Batteriorodopsina
Canale del Glicerolo Glpf
CENTRO DI REAZIONE FOTOSINTETICO
DEL BATTERIO RHODOPSEUDOMONAS VIRIDIS
Coenzimi trasportatori di elettroni
Nucleo del centro di reazione
Grossa proteina formata
dall’associazione di
polipeptidi multipli che
funziona come un grosso
complesso
5 α-eliche
5 α-eliche
Proteine Integrali di Membrana - Struttura a barili-β
Struttura a barili-β
•Modo alternativo per i legami peptidici nel doppio strato lipidico di soddisfare le loro richieste di formare legami
idrogeno.
•Formano strutture molto rigide e meno flessibili delle α-eliche e per questo sono abbondanti nella membrana
esterna dei mitocondri, dei batteri e e dei cloroplasti ma poco nelle cellule eucariotiche. Perché sono difficili i
cambiamenti conformazionali.
•Alcuni barili-β formano dei grossi canali transmembrana (le Porine)
Sito di legame
per il Ferro
Recettore per
un virus
batterico
Lipasi
Porina batterica
Proteina trasp ioni Ferro
Le Porine
Sono proteine transmembrana che formano pori e attraversano il doppio strato lipidico
come un barile β
Si trovano sulla membrana esterna dei batteri e permettono ai
soluti idrofilici fino a 600 Da di diffondere attraverso il doppio
strato esterno
Il canale all’interno è rivestito da catene aa polari.
Anse che sporgono nel lume hanno la funzione di restringerlo in
modo da renderlo selettivo solo per alcuni soluti
Ciascun monomero consiste di un barile β composto da
16 filamenti antiparalleli.
OmpX - una porina della membrana esterna di E. Coli
Tutte le porine sono proteine transmembrana trimeriche
I grafici di idropatia non possono identificare i
segmenti che attraversano la membrana come βbarili perché di solito meno di 10 aa sono sufficienti
ad attraversare il doppio strato lipidico.
Tuttavia si fanno cristallizzare facilmente (struttura
raggi X)
Proteine Periferiche Ancoraggio mediante gruppi idrocarburici
legati covalentemente
L’attacco covalente tramite diversi tipi di lipidi serve alla localizzazione di
una proteina nella membrana dopo la sua sintesi nel citosol
Molte proteine sono ancorate agli sfingolipidi dei lipid raft
Attacco delle proteine alla membrana tramite lipidi
ANCORE GPI (Glicosil Fosfatidil Inositolo)
Molti proteoglicani
Fosfatidiletanolamina
Carboidrati (numero variabile)
ANCORE ACILICHE
Es: v-Src (forma mutante di TK )
Gruppo acilico: miristato (C14) o palmitato (C16)
ANCORE PRENILICHE
Es: prot Ras e Rab
(famiglia di GTPasi)
Gruppo prenilico:
farnesile (C15) o geranilgeranile (C20)
Glicosilazione delle Proteine di Membrana
Molte proteine di membrana sono glicosilate
La glicosilazione è presente sempre
sul lato non citoplasmatico della membrana.
L’ambiente citoplasmatico riducente
non consente la formazione di legami
disolfuro.
I legami disolfuro dal lato extracellulare hanno un
ruolo importante nello stabilizzare la struttura ripiegata
della catena o la sua associazione con altre catene
polipeptidiche
Il Glicocalice
La superficie della cellula è ricoperta di zuccheri
che si trovano
- come catene oligosaccaridiche legate
covalentemente alle proteine e ai lipidi di
membrana
- come proteoglicani (lunghe catene
polisaccaridiche unite covalentemente ad un
nucleo proteico).
Ruolo del glicocalice :
Rivestimento Cellulare di un Linfocita colorato con Rosso Rutenio
1 - protezione contro il danneggiamento
meccanico e chimico
2 - mediare processi temporanei di
adesione cellula-cellula
Il glicocalice si visualizza con vari
coloranti come
il ROSSO RUTENIO o con LECTINE
marcate.
Le lectine sono proteine affini ai
carboidrati
Schema semplificato del glicocalice
Le selectine
Sono proteine che legano i carboidrati della superficie cellulare e mediano temporanee adesioni tra
neutrofili e cellule endoteliali nel sangue
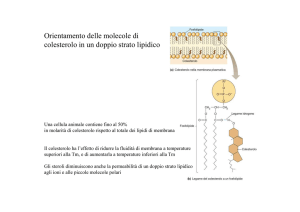
Studio delle Proteine di Membrana
Approcci sperimentali
La membrana plasmatica dei globuli rossi
Vantaggi
Grande disponibiltà
Non hanno nucleo o organelli
(non c’è contaminazione da altri tipi di
membrane)
Membrana facile da preparare:
I“fantasmi” dei globuli rossi:
Proteine della membrana plasmatica dei globuli rossi
Spettrina, glicoforina e banda 3 costituiscono più del 60% in peso delle proteine totali di
membrana dei globuli rossi.
Spettrina
Proteina periferica a forma di bastoncino lungo, sottile e
flessibile lungo circa 100 nm.
Costituisce il 25% delle proteine di membrana ed è una
proteina del citoscheletro.
Si trova al di sotto dell’intera superficie citoplasmatica della
membrana mantenendo la forma biconcava dei globuli rossi.
La spettrina è un eterodimero con catene antiparallele
Le due catene sono formate da domini ripetuti di 106 Aa
Si associa, tramite la testa fosforilata, per formare tetrameri
lunghi 200 nm
Microscopia elettronica –
molecole di spettrina ombreggiate col platino
Spettrina e citoscheletro
4 molecole di spettrina
formano con actina e
altre proteine un
complesso
giunzionale.
Formazione di una
struttura reticolare
sotto la membrana che
conferisce alla cellula
estrema elasticità.
Il legame della spettrina alla membrana dipende dalla
ANCHIRINA che a sua volta lega la
Banda 3 e dalla
BANDA 4.1 che a sua volta lega la
Glicoforina
La Glicoforina
Piccola glicoproteina transmembrana
a passaggio singolo
Funzione sconosciuta, sebbene 106
copie per cellula.
La Banda 3
Deriva il suo nome dall SDS-PAGE (PM= 100kDa)
Proteina transmembrana a passaggio multiplo (12 volte)
106 copie disposte come dimeri
Catalizza il trasporto accoppiato di anioni (scambiatore Cl-/HCO3-)
Le proteine possono essere viste tramite crio-frattura.
Purificazione delle proteine
Purificazione delle
proteine globulari idrosolubili
Purificazione delle
proteine di membrana
Quando sono separate dalle
membrane queste proteine
mantengono la loro
conformazione nativa in un
mezzo acquoso poiché
presentano molti gruppi
idrofilici esposti
Quando sono separate dalle
membrane
le regioni idrofobiche di queste
proteine interagiscono
causandone l’aggregazione in
un mezzo acquoso. Necessitano
di essere solubilizzate nei
DETERGENTI
Purificazione delle proteine di membrana – I DETERGENTI
I detergenti
Non ionici
Le moleclole di detergente sono
anfipatiche e tendono a formare
micelle in acqua
Idrofobica
Ionici
Idrofilica
CMC: Concentrazione micellare critica.
La CMC alla quale si formano le micelle è una
caratteristica di ogni detergente dipendente
dalla sua struttura
Agiscono in modi differenti a seconda delle diverse concentrazioni
Si legano alle regioni idrofobiche esposte delle prot di membrana e al nucleo idrofobico delle proteine
idrosolubili. A causa della carica questi detergenti distruggono anche i legami ionici e i legami idrogeno.
Denaturano le proteine
Solubilizzazione di proteine integrali di membrana
con detergenti NON ionici
Purificazione e ricostituzione della pompa Na+-K+
Occorre utilizzare
detergenti blandi!!
ELETTROFORESI
SDS PAGE e Western Blot (Immunoblotting)
SDS - PAGE
Western Blot (Immunoblotting)
Microscopia elettronica di crio-frattura
Freeze Fracture Electron Microscopy (FFEM)
Consente di studiare la morfologia della
membrana, la localizzazione e la
disposizione delle proteine di membrana
Le cellule sono congelate in azoto liquido e il blocco
congelato viene fratturato con un coltello
Microscopia elettronica di crio-frattura
Freeze Fracture Electron Microscopy (FFEM)
FFEM - Banda 3 e Glicoforina
La proteina tende a rimanere con il monostrato che contiene la massa principale della proteina
Le molecole di banda 3 restano in genere con la faccia P di frattura
Le molecole di glicoforina rimangono in genere con la faccia esterna (E) di frattura
- FFEM Visualizzazione di aggregati della proteina canale per l’acqua Acquaporina-4
(AQP4)
E
P
Diffusione delle proteine
Le proteine di membrana non passano attraverso il doppio strato (flipflop) ma possono ruotare (diffusione rotazionale) o muoversi
lateralmente nella membrana (diffusione laterale) o flettersi (flessione).
Esperimento che dimostra che le proteine di membrana diffondono lateralmente
TECNICHE DI FOTOSBIANCAMENTO
MISURAZIONE DELLA VELOCITA’ DI DIFFUSIONE LATERALE DI UNA PROTEINA DI MEMBRANA
La proteina di interesse deve essere marcata con un anticorpo fluorescente o essere espressa come proteina
di fusione con una proteina fluorescente (es. GFP).
Si ricava il coefficiente di diffusione laterale della proteina che puo’ variare a seconda del tipo cellulare in cui la
proteina è espressa
FRAP
FRAP (Fluorescence Recovery After Photobleaching):
recupero della fluorescenza dopo fotosbiancamento
FLIP
FLIP (Fluorescence Loss In Photobleaching:
perdita di fluorescenza nel fotosbiancamento
- FRAP Velocità di diffusione laterale della proteina canale per l’acqua Acquaporina-4
(AQP4)
Le cellule possono confinare proteine e lipidi in domini specifici della membrana
TIGHT JUNCTIONS NELLE CELLULE EPITELIALI
Nelle cellule epiteliali questa distribuzione asimmetrica è spesso essenziale per la
funzione dell’epitelio stesso
Tre domini diversi nella stessa cellula spermatica
In questo caso esistono domini diversi senza la presenza di tight junctions.
Quattro modi in cui la diffusione laterale delle proteine di membrana può essere
ristretta
Le proteine si autoassemblano in grossi aggregati
Membrana purpurea dell’halobacterium
Le proteine possono essere legate da
interazioni con complessi di
macromolecole all’esterno (B) o
all’interno (C) della cellula
Le proteine possono interagire con
proteine sulla superficie di un’altra cellula