COMPOSTI CHIMICI E NOMENCLATURA
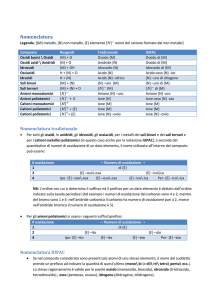
Nomenclatura tradizionale:
Nomenclatura ufficiale (o IUPAC):
Prevede l’uso di prefissi e
suffissi, in base al numero di
ossidazione
dei
vari
elementi.
Noi considereremo solo
alcuni elementi e solo alcuni
numeri di ossidazione.
Si indica il numero di atomi di ogni
elemento presenti all’interno del
composto, tramite
prefissi di
origine greca; quando è presente un
solo atomo di un elemento non si
utilizza alcun prefisso
n°atomi
prefisso
2
bi (o di)
3
tri
4
tetra
5
penta
6
esa
7
epta
NUMERO DI OSSIDAZIONE
E’ una carica positiva o negativa che viene attribuita formalmente a ciascun
elemento in un composto.
Essa è determinata dal numero di elettroni che l’elemento possiede in più (carica
negativa) o in meno (carica positiva) rispetto all’atomo neutro, quando gli
elettroni di legame vengono attribuiti all’elemento più elettronegativo del
composto.
-3
-2
O
+1 H H +1
N
HHH
+1
+1
+1
Il numero di ossidazione non è una carica reale, bensì fittizia, attribuita a ciascun
elemento in un composto
REGOEL PER DETERMINARE I NUMERI DI OSSIDAZIONE
1) Tutte le sostanze allo stato elementare hanno numero di ossidazione zero
2) Negli ioni monoatomici gli elementi hanno numero di ossidazione uguale alla
carica ionica
3) L’idrogeno ha sempre numero di ossidazione +1 oppure -1;
4) L’ossigeno ha sempre numero di ossidazione -2;
5) Gli elementi del primo gruppo (tranne l’idrogeno) hanno sempre +1 ;
6) Gli elementi del secondo gruppo hanno sempre +2 ;
7) Gli elementi del terzo gruppo hanno sempre +3 ;
8) La somma algebrica dei numeri di ossidazione di tutti gli atomi di tutti gli
elementi presenti in un composto è uguale a zero, se il composto è neutro,
oppure è uguale alla carica ionica, se il composto è uno ione poliatomico o
radicale.
CALCOLO DEL NUMERO DI OSSIDAZIONE DI UN ELEMENTO
IN UN COMPOSTO
Per la determinazione del numero di ossidazione di un elemento in un composto devono
essere ben chiare le regole per determinare i numeri di ossidazione.
Vediamo come si determina il numero di ossidazione del cloro (Cl) nel Cl2O:
1)Sopra all’elemento di cui si deve determinare il numero di ossidazione si mette una x (che
Indica l’incognita)
2) dell’altro elemento deve essere noto il numero di ossidazione, in questo caso sappiamo
che l’ossigeno (O) ha sempre numero di ossidazione -2
3) Sappiamo anche che la somma algebrica dei numeri di ossidazione di tutti gli atomi di tutti
gli elementi presenti in un composto neutro è uguale a zero
4) Possiamo impostare l’equazione di primo grado il questo modo:
a) la somma dei numeri di ossidazione degli elementi del composto e: 2x + (-2)
questa deve essere uguale a zero. Avremo quindi 2x + (-2) = 0
N.B. la x va moltiplicata per 2 perché ci sono due atomi di cloro, lo si vede dall’indice
stechiometrico
x
-2
Cl2O
+1
2x-2=0
x=1
-2
Cl2O
Risolvendo l’equazione di primo grado avremo che x =1 cioè il numero di ossidazione del Cl
Nel composto Cl2O è +1
ESERCIZIO
Determinare il numero di ossidazione del Cl (cloro) nel composto HCl
Nel caso in cui il composto fosse formato da tre elementi il discorso non cambia, l’unica
differenza è che devono essere noti i numeri di ossidazione di due elementi:
ESEMPIO
Determinare il numero di ossidazione dello zolfo (S) nel composto H2SO4
Sopra allo S si mette la x, sappiamo che l’H ha sempre numero di ossidazione +1
e l’O ha sempre numero di ossidazione -2 avremo quindi:
+1 x -2
H2SO4
Sappiamo che la somma dei numero di ossidazione di tutti gli elementi che formano un
composto neutro è uguale a zero quindi si ha:
2(+1) + x + 4(-2) = 0
2 + x + (-8) =0
Il numero di ossidazione dello S è +6
2 + x - 8 =0
x = +8 - 2
x = +6
Vediamo come determinare il numero di ossidazione nel caso di composto carichi e non neutri.
I composti carichi vengono definiti RADICALI e hanno una carica ionica
Esempio CO3 2-
Carica ionica
radicale
La procedura da seguire è sempre la stessa l’unica differenza è che la somma dei numeri di
ossidazione degli elementi che formano un radicale è uguale alla carica ionica (non a zero
come nei casi visti prima di composti neutri)
Esempio
Determinare il numero di ossidazione del C nel CO3 2-
+4 -2
x -2
CO32-
x+3(-2)=-2
n° ox.
C
Atomi
di O
n° ox.
O
carica
anione
x=4
CO32-
DETERMINAZIONE DELLA FORMULA CHIMICA DI COMPOSTI BINARI
NOTI I NUMERI DI OSSIDAZIONE
Regola dello zaza
Si ricava l’indice stechiometrico di un elemento dal valore assoluto del numero di
ossidazione dell’elemento che gli sta accanto
+3
In pratica si incrociano gli indici ed i numeri di ossidazione
Si deve tuttavia ricordare che:
•Gli indici vanno generalmente
ridotti ai minimi termini;
+2
Al2O3
-2
Ca2O2
•L’indice 1 si omette sempre;
ESERCIZI
Determinare la formula chimica dei seguenti composti formati da:
1)N (n° ox +4) e H
2)H e O
3)S (n° ox +6) e O
4)C (n° ox +4) e O
5)Ca (n° ox +2) e Cl (n° ox +4)
6)H (n° ox -1) e S (n° ox +2)
-2
+1
-2
K2O1
7
OSSIDI (o OSSIDI BASICI)
Composti binari formati dall’unione di un metallo con l’ossigeno
Nomenclatura tradizionale
a)
•
se il metallo ha un solo numero di ossidazione:
ossido di + nome metallo (es. ossido di sodio Na2O)
b) se il metallo ha due numeri di ossidazione:
•ossido + nome metallo con desinenza OSO, per il numero di ossidazione minore.
Ad es. ossido piomboso PbO (numero di ossidazione +2);
•ossido + nome metallo con desinenza ICO, per il numero di ossidazione
maggiore. Ad es. ossido piombico PbO2 (numero di ossidazione +4).
Nomenclatura IUPAC
Si conta il numero di atomi di ogni elemento e si utilizzano i relativi prefissi,
insieme al termine “ossido di”. Ad es. Na2O ossido di disodio; PbO ossido di
piombo (+2); PbO2 biossido di piombo (+4).
ANIDRIDI (o OSSIDI ACIDI)
Composti binari formati dall’unione di un non metallo con l’ossigeno
Nomenclatura tradizionale
a) se il non metallo ha un solo numero di ossidazione:
anidride + nome non metallo con desinenza ICA (es. anidride carbonica CO2)
b) se il non metallo ha due numeri di ossidazione:
anidride + nome non metallo con desinenza OSA, per il numero di ossidazione
minore. Ad es. anidride solforosa SO2 (+4);
anidride + nome non metallo con desinenza ICA, per il numero di ossidazione
maggiore. Ad es. anidride solforica SO3 (+6).
c) se il non metallo ha quattro numeri di ossidazione, come gli elementi del 7°
gruppo (+1,+3,+5,+7):
anidride IPO nome non metallo con desinenza OSA per il numero di ossidazione
+1. Es. Cl2O anidride ipoclorosa;
anidride + nome non metallo con desinenza OSA, per il numero di ossidazione +3.
Es. anidride clorosa Cl2O3;
anidride + nome non metallo con desinenza ICA, per il numero di ossidazione +5.
Es. anidride clorica Cl2O5;
anidride PER nome non metallo con desinenza ICA per il numero di ossidazione
+7. Es. Cl2O7 anidride perclorica;
Nomenclatura ufficiale
Anche i composti tra ossigeno e non metalli sono chiamati ossidi; si utilizzano
sempre i prefissi relativi al numero di atomi degli elementi.
Ad esempio: SO2 biossido di zolfo (+4); SO3 triossido di zolfo (+6)¸ Cl2O ossido di
dicloro (+1); Cl2O3 triossido di dicloro (+3); Cl2O5 pentaossido di dicloro (+5);
Cl2O7 eptaossido di dicloro (+7).
REAZIONI CHIMICHE
Quando più elementi chimici si uniscono insieme mediante uno o più legami chimici
danno origine ad una reazione chimica o trasformazione chimica.
In una reazione chimica si ha la vera e propria trasformazione della materia, cioè si parte
da determinate sostanze che hanno delle caratteristiche chimiche ben precise e si arriva
ad altre sostanze con caratteristiche chimiche del tutto differenti da quelle di partenza.
Una reazione chimica generica si scrive nel modo seguente:
A+B
AB
A e B prendono il nome di REAGENTI mentre AB PRODOTTO,
la freccia indica il verso della reazione
Tutte le reazioni chimiche seguono il principio di CONSERVAZIONE DELLA MASSA cioè
una certa quantità di reagenti darà la stessa quantità di prodotti a meno che parte della
materia non si sia trasformata in energia. Ragionando in termini di numero di atomi se
nei reagenti è presente un certo numero di atomi dell’elemento A anche nei prodotti dovrò
avere lo stesso numero di atomi dell’elemento A.
IDROSSIDI
Composti ternari di ossigeno, idrogeno e metalli; in essi compare il gruppo
ossidrile (OH-), che si comporta come se avesse numero di ossidazione -1.
Derivano dalla reazione tra ossidi (basici) e acqua, in cui tutti gli elementi
mantengono il proprio numero di ossidazione.
+1
+1
-1
Na2O+H2O → 2Na(OH)
Le formule si scrivono utilizzando le regole già viste per i composti binari,
considerando l’ossidrile come un elemento a numero di ossidazione -1.
SCRIVERE E BILANCIARE UNA REAZIONE
Esempio:
Scrivere la reazione che avviene tra ossidi di sodio e acqua
1)L’ossido di sodio, come dice il nome, è un ossido e quando reagisce con l’acqua forma
un idrossido, più precisamente l’idrossido di sodio
2)Posso iniziare a scrivere la reazione:
Ossido di sodio Na2O + acqua H2O che danno come prodotto idrossido di sodio
3) Determino la formula dell’idrossido di sodio:
a) prima si scrive sempre il metallo (Na) poi il gruppo ossidrile (OH) che caratterizza tutti
gli idrossidi
b) Conoscendo i numeri di ossidazione del Na (+1) e dell’ OH (-1) posso subito dire che
la formula dell’idrossido di sodio è Na(OH) (regola dello zaza)
4) Si scrive la reazione chimica:
Na2O + H2O Na(OH)
5) Si bilancia la reazione tenendo presente il principio di conservazione della massa e che
non si possono assolutamente cambiare le formule dei composti. Questo significa che il
bilanciamento andrà effettuato solo con i coefficienti stechiometrici
Na2O + H2O Na(OH)
1) Iniziamo a vedere quanti atomi di Na ci sono nei reagenti e quanti nei prodotti:
2 atomi di Na nei reagenti e uno nei prodotti, questo vuol dire che se fosse così veramente
la reazione non seguirebbe il principio di conservazione della massa, ma questo non può
avvenire ciò significa che dovremmo fare in modo che risultino 2 atomi di sodio anche nei
prodotti. Basta mettere come coefficiente stechiometrico 2 davanti all’ Na(OH)
Na2O + H2O 2 Na(OH)
2) Per gli altri atomi si fa lo stesso discorso fatto per il Na: ho due atomi di O nei reagenti
e due nei prodotti, due atomi di H nei reagenti e due nei prodotti. La reazione scritta in
questo modo segue il principio di esclusione della massa quindi è bilanciata.
N.B.
Scrivere 2Na(OH) significa dire che ci sono due molecole di Na(OH)
2Na(OH) = Na(OH) + Na(OH)
ESERCIZIO
Scrivere la reazione per la formazione dell’idrossido di ferro partendo da ossido di ferro Fe2O3
e acqua e bilanciarla.
OSSIACIDI o ACIDI TERNARI
Sono composti ternari tra idrogeno, ossigeno ed un non metallo
Derivano dalla reazione tra anidridi e acqua (tutti gli elementi mantengono il
proprio numero di ossidazione); inoltre nella formula dell’ossiacido il non metallo
è presente, tranne qualche eccezione, sempre con un solo atomo
+4 –2
+1
–2
CO2+H2O →
+1
+4 –2
H2CO3
Per trovare la formula dell'ossoacido si deve scrivere a destra nell'ordine idrogeno,
non metallo e ossigeno, mettendo per ognuno di questi elementi tanti atomi
quanti ce ne sono a sinistra
Cl2O7+H2O→ H2Cl2O8
ESERCIZI
1) COSA SI INTENDE PER NUMERO DI OSSIRAZIONE?
2) Trova il numero di ossidazione dell'elemento scritto in grassetto mediante
l'impostazione di un' equazione di primo grado:
H2CO3 ; H2NO3 ; MgO ; C2H5OH ; H2S ; HClO3; PO42-; NO23)Determina la formula chimica dei seguenti composti
COMPOSTO
NO
KS
AlS
BO
CaCl
4) Bilanciare le seguenti reazioni
K2O+ H2O --> K(OH)
Ca + O2 --> CaO
Numero di ossidazione
N (+6)
S (+2)
S (-2)
-----------Cl (-2)