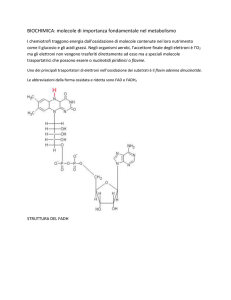
OSSIDORIDUZIONE
In chimica, con il termine ossidoriduzione o redox si descrivono tutte
quelle reazioni chimiche in cui cambia il numero di ossidazione degli
atomi, cioè tutte le reazioni in cui si ha uno scambio di elettroni da una
specie chimica ad un'altra.
Questo tipo di reazione può variare da un semplice processo redox, come
l'ossidazione del carbonio che genera diossido di carbonio o la riduzione
del carbonio dall'idrogeno che produce metano (CH4), fino alla più
complessa ossidazione degli zuccheri nel corpo umano, attraverso una
serie di complicati processi di trasferimento degli elettroni.
ossidazione: si manifesta come aumento del numero di ossidazione di
una specie chimica (ad esempio molecola, atomo o ione), in genere
dovuto ad una cessione di elettroni da parte della specie considerata. La
specie chimica perde elettroni ed è detta "riducente".
riduzione: si manifesta come una diminuzione del numero di ossidazione
di una specie chimica, in genere dovuta ad un'acquisizione di elettroni da
parte della specie. La specie chimica acquista elettroni ed è detta
"ossidante".
Il nome ossidazione è stato inizialmente dato alla reazione tra un metallo
che si combina con l'ossigeno per dare il corrispondente ossido: il metallo
subisce una sottrazione di elettroni da parte dell'ossigeno, poiché
quest'ultimo è più elettronegativo di qualsiasi metallo.
Quindi possiamo dire che l’ossigeno è ossidante per eccellenza.
Per esempio La mela, una volta tolta la buccia, appare più scura. Questo
fenomeno non riguarda solo la mela, ma anche tanti altri frutti e ortaggi
che, a contatto con l’aria, reagiscono allo stesso modo. Ma che cosa causa
l’alterazione del colore?
Il cambiamento di colore si spiega in parte dall’ossidazione della polpa a
contatto con l’aria che reagisce con l’ossigeno e in parte a causa di un
enzima contenuto nel frutto, la tirosinasi o polifenolossidas. Infatti,
quando si taglia la mela, le pareti cellulari vengono strappate
promuovendo così la dispersione degli enzimi e la loro reazione.
L‘ossigeno nell’aria viene a contatto con le proteine della polpa
(carboidrati, lipidi, amminoacidi) che diventa scura per ossidazione, vale a
dire per reazione diretta con l’ossigeno.
La caratteristica principale delle redox consiste nella variazione del
numero di ossidazione degli elementi che partecipano ad esse. Il numero
di ossidazione degli elementi legati a formare una molecola corrisponde
alla carica che ogni atomo avrebbe se nella molecola gli elettroni di
legame fossero assegnati all'elemento più elettronegativo.
Di solito per ossidazione si intende la perdita, da parte di un elemento, di
uno o più elettroni, mentre la riduzione viene definita come l'acquisto di
uno o più elettroni.
Visto dall'ottica del numero di ossidazione, la riduzione può essere
definita come una diminuzione del numero di ossidazione, mentre
l'ossidazione può essere definita come un aumento del numero di
ossidazione. A questo punto ci può aiutare una rappresentazione grafica:
Redox in forma molecolare: In esse sono
descritti tutti gli atomi, per lo più in forma di
molecole indissociate, che partecipano alla
reazione complessiva, anche quelli che non
entrano nella redox, in quanto non subiscono
variazioni del n.o. .
COME SI BILANCIANO LE REAZIONI REDOX?
Esistono due modi per bilanciare le reazioni di ossidoriduzione:
1) metodo del numero di ossidazione;
2) metodo delle semireazioni;
METODO DELLA VARIAZIONE DEL NUMERO DI
OSSIDAZIONE
Si assegnano i n.o. alle specie chimiche nella reazione
Si individuano la specie che si ossida e quella che si
riduce
Eventualmente si bilanciano le masse di questi due
elementi in modo che figurino nello stesso numero ad
entrambi i membri dell’espressione chimica
Si calcolano le variazioni dei n.o. (Δn.o.) dell’ossidante
e del riducente
Se il Δn.o.riducente è diverso dal Δn.o.ossidante si
procede ad eguagliarli, moltiplicandoli per opportuni
fattori in modo da ottenere come prodotti delle due
moltiplicazioni il loro minimo comune multiplo (m.c.m.
Si moltiplicano i coefficienti stechiometrici della specie
che si ossida e di quella che si riduce per i fattori
trovati al punto e)
Si bilanciano tutte le altre specie atomiche bilanciando
in sequenza i metalli, i non metalli, gli eventuali anioni
poliatomici, l’idrogeno e infine l’ossigeno.