METABOLISMO DEL GLICOGENO E SUA REGOLAZIONE
La regolazione del metabolismo del glic. segue 2 vie. La prima, immediata, è di tipo allosterico. I
due enzimi responsabili del metabolismo sono regolati in base alle concentrazioni di diverse
molecole del metabolismo del glucosio.
• Glicogeno fosforilasi attiva: [Glc 6-P] [AMP] [ATP] [Ca2+] *(vedi: Glicogenolisi)
• Glicogeno sintetasi attiva: [ATP]; [Glc 6-P];
Bisogna tener presente che gli enzimi hanno azione contraria, per cui, se 1 è attivo, l’altro è inattivo
e viceversa.
Il secondo tipo di regolazione è quella covalente determinata dalla formazione di legami covalenti
sugli enzimi. La fosforilazione (e la defosforilazione) determinano l’attivazione di 1 enzima e
l’inattivazione dell’altro. In dettaglio, la glic.fosfrilasi è attiva se fosforilata (glic. fosforilasi a) e
inattiva se defosforilata (glic.fosforilasi b). Al contrario, la glic.sintetasi è attiva se defosforilata
(glic.sintasi a) e inattiva se fosforilata (glic.sintasi b). La fosforilazione avviene a carico di residui
di Ser. Questi due enzimi, regolati in maniera covalente, sono definiti interconvertibili.
La regolazione covalente è di origine ormonale.
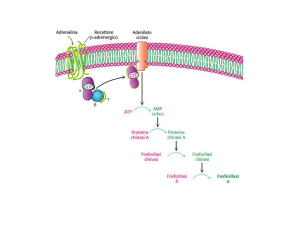
L’adrenalina e il glucagone sono ormoni iperglicemizzanti, ovvero tendono a mobilitare il Glc
dalle cellule epatiche e renali. L’adrenalina è secreta dalla midollare del surrene, mentre il
glucagone è secreto dalle cellule A delle isole pancreatiche. Questi ormoni raggiungono le cellule
bersaglio e il cambiamento tridimensionale indotto al recettoe determina l’attivazione della proteina
G. La subunità alpha delle proteine G attiva l’enzima adenilato ciclasi, situato sul lato interno della
membrana cellulare, che trasforma AMP in cAMP. 4 molecole di cAMP attivano la Proteina
Chinasi (C2R2 + 4cAMP
C2 + R2-cAMP4). Questo attiva la Fosforilasi Chinasi che fosforila la
Glic.Fosforilasi b in Glic.Fosforilasi a. Parallelamente la Glic.sintasi a è fosforilata a Glic.sintasi
b inattiva. Il Glucagone, oltre a questi effetti, mediante la proteina kinasi cAMP dipendente,
inattiva la PFK2 (diminuendo [Fru 2,6BP]) e attivando Fru 2,6 Difosfatasi (aumentando [Fru 6P]).
Si ha, così, inibizione della Glicolisi e attivazione della Gluconeogenesi. Il Glucagone, inoltre,
inibisce la Piruvato Kinasi.
La Proteina Chinasi cAMP dipendente, tra i suoi substrati, fosforila ed attiva anche la Proteina
inibitrice della Fosforilasi Fosfatasi. Quando il segnale ormonale scompare, si ha defosforilazione
della Proteina inibitrice della Fosforilasi Fosfatasi mediante defosforilazione ed inattivazione. Così
la Fosforilasi Fosfatasi, di nuovo attiva, può andare a defosforilare tutti i siti con P, attivando la
Glicogeno Sintasi a. cAMP, infine, è riportato a AMP mediante l’enzima fosfodiesterasi.
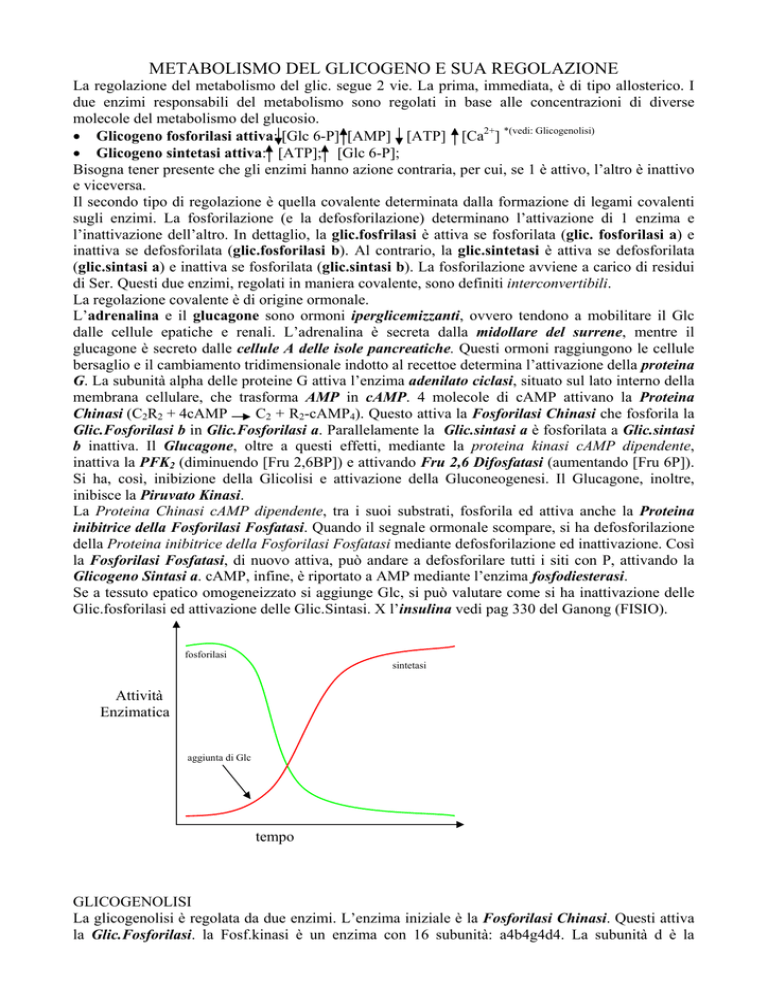
Se a tessuto epatico omogeneizzato si aggiunge Glc, si può valutare come si ha inattivazione delle
Glic.fosforilasi ed attivazione delle Glic.Sintasi. X l’insulina vedi pag 330 del Ganong (FISIO).
fosforilasi
sintetasi
Attività
Enzimatica
aggiunta di Glc
tempo
GLICOGENOLISI
La glicogenolisi è regolata da due enzimi. L’enzima iniziale è la Fosforilasi Chinasi. Questi attiva
la Glic.Fosforilasi. la Fosf.kinasi è un enzima con 16 subunità: a4b4g4d4. La subunità d è la
calmodulina che lega 4Ca2+. Sono necessari 8 Pi per far funzionare la Fosforilasi kinasi. Questa,
però, tende molto più facilmente alla forma attiva se CAM è legata al Ca2+, ma solo inizialmente,
quando pH>6,8. Quando la contrazione muscolare produce lattato, il ruolo del Ca2+ diminuisce per
l’acidità del pH e scatta l’attivazione ormonale, che tende ad attivare la Glicogeno fosforilasi.
Questa ha 2 subunità con 2 siti di legame per il Glicogeno. Il glicogeno che sarà demolito è legato
alla superficie concava. Nel sito catalitico è presente una molecola di Piridossal Fosfato, legato a
Lys. Sulla superficie esterna ci sono siti di legame per ATP e AMP. La presenza di ATP tende a
conservare la forma tesa, ovvero non attiva. Se aumenta la concentrazione di AMP, si tende alla
forma rilasciata, ovvero quella attiva.
La Glicogeno fosforilasi fsi lega alle estremità non riducenti del Glicogeno. Rompe i legami alpha14 con meccanismo fosforolitico (con aggiunta di Pi). Questo enzima è specifico solo per i legami
alpha1-4, fino a 4 momomeri prima di una ramificazione. Per scindere la destrina limite entra in
gioco l’enzima deramificante, che si comporta come una Glc 4-4 Transferasi. Questo scinde 3
monomeri di una ramificazione e li lega ad un’altra estremità non riducente ove potrà continuare a
lavorare la gli.fosforilasi. L’ultimo monomero è scisso e forma Glc libero, senza Pi. In questo caso
l’enzima ramificante agisce come amilo 1-6 Glicosidasi. Di tutti i monomeri liberati quelli fosfatati
sono Glc 1-P e sono trasformati a Glc 6-P mediante l’enzima fosfoglucomutasi. Nel fegato e nei
remi è anche presente la Glucosio Fosfatasi che ne permette la mobilitazione. Nei muscoli no!
GLICOGENOSINTESI
La regolazione della Glic.Sintasi avviene inversamente alla Glic.Fosforilasi, esistendo anch’essa
nella forma attiva ed inattiva, presentando regolazione allosterica e covalente. La Glic.Sintasi a
deve essere legata a 2 Pi per essere inattivata.
Il Glc che entra nelle cellule epatiche e renali è fosfatato a Glc 6-P dall’enzima esokinasi; Glc 6-P è
trasformato a Glc 1-P dalla fosfoglucomutasi. Glc1-P è traformato in UDP-Glc (urdina difosfato
glucoso) mediante l’enzima Glc 1-P fosfato uridiltrasferasi.
UTP + Glc1-P
UDP-Glc + Ppi. Questa reazione procede sempre verso dx perché nel citosol il
gruppo Pirofosfato è trasformato in Ortofosfato.
La Glic.Sintetasi lega Glc di UDP-Glc alle estremità non riducenti del Glicogeno con legame
alpha1-4. Parallelamente UDP+ATP
UTP + ADP, quindi si ha spesa di ATP.
La Glic.sintasi non è in grado di formare legami alpha1-6, quindi è necessari l’aiuto di un enzima
ramificante che leghi i vari monomeri, ma almeno 4 monomeri dopo una ramificazione già
esistente. Questo enzima svolge la funzione di Glicosil 4-6 Transferasi.
Esiste nelle cellule neonate una proteina, detta Glucogenina, che è 1 enzima che ha la capacità di
autoglicosidarsi a residui di Tyr. Quando il nucleo glicogenico è consistente, si stacca, permettendo
il lavoro degli altri due enzimi.
CICLO FUTILE
• glicogenosintesi:
Glc 1-P + UTP– UDP-Glc + PPi
PPi + H2O – Pi
UDP-Glc + Glicogeno(n) – Glicogeno (n+1) + UDP
UDP + ATP – UTP + ADP
• bilancio energetico della glicogenosintesi:
Glicogeno (n) + Glc1-P + ATP + H2O – Glicogeno (n+1) + Pi + ADP
• glicogenolisi:
Glicogeno(n+1) + Pi – Glicogeno (n) + Glc 1-P
Se avvenissero contemporaneamente si avrebbe solo 1 spesa di energia
• somma e bilancio energetico:
ATP + H2O – ADP + Pi
Questo corrisponderebbe ad un ciclo futile, ed è per questo che gli enzimi di regolazione rispondono
in maniera differente allo stesso stimolo.