Casi più complicati
• inibizione mista (competitiva e non competitiva)
• reazioni reversibili
•reazioni a più substrati
•effetto del pH
inibizione mista (competitiva e non competitiva)
E+I
KI< KI’
KI
EI
ES + I
KI’
IES
KI > KI’
Sia Km che Vmax sono influenzati dalla presenza dell’inibitore
•ENZIMI ALLOSTERICI: non seguono la cinetica Michaelis-Menten
il legame del substrato all’enzima
modifica il legame ad altri siti
Forme T ed R
+attivatore
• inibitore allosterico si lega
fES
preferibilmente a T
• attivatore allosterico si lega
• preferibilmente a R
solo substrato
+ inibitore
fES=[ES]/Etot=V/Vmax
[S] mM
Sviluppo di farmaci
Acido
acetilsalicilico
Un farmaco ha spesso come bersaglio un enzima o un recettore
IC50=concentrazione di farmaco
(=inibitore) che riduce la risposta di
attività del 50%
La concentrazione di un farmaco nel suo sito bersaglio
è funzione della velocità di assorbimento (biodisponibilità orale),
di distribuzione (compartimento bersaglio), di metabolismo e di
escrezione
Regolazione dell’attività enzimatica
• Controllo dell’attività
1. Inibitori
2. Regolazione Allosterica
3. Modificazione Covalente reversibile
4. Attivazione proteolitica
• Controllo della disponibilità dell’enzima
• Controllo a livello del substrato
Controllo della disponibilità dell’enzima
La quantità di un dato enzima nella cellula dipende sia dalla sua
velocità di sintesi, sia dalla sua velocità di degradazione.
Queste velocità sono controllate dalla cellula
Controllo a livello del substrato
esochinasi
D-glucosio + ATP
D-glucosio-6-fosfato + ADP
La velocità di reazione di D-glucosio è proporzionale [D-glucosio], una
elevata concentrazione di substrato tende a far avvenire la reazione. Una
elevata concentrazione di prodotto favorisce invece la reazione inversa
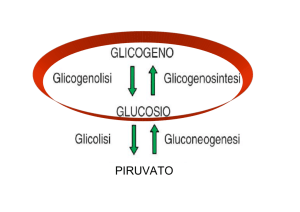
Controllo dell’attività catalitica
• regolazione a feedback
Le vie metaboliche assomigliano a catene di montaggio
Feedback negativo
Substrato
iniziale
metaboliti intermedi
Prodotto
finale
Attivazione del precursore
Feedback positivo
Un aumento del prodotto E ha come conseguenza una diminuzione della sua
formazione. Bloccando il primo step si evita l’accumulo di intermedi
Feedback negativo
Controllo dell’attività
• modificazioni covalenti: alcuni enzimi rimangono inattivi fino a
quando vengono “trasformati” in forme attive
altri vengono “inattivati” da trasformazioni
Ex. fosforilazione
di una serina
• per la cellula una glicogeno fosforilasi continuamente attiva non
sarebbe vantaggiosa
consumo riserve glucosio!!
• La possibilità di mobilitare glucosio da glicogeno deve essere
a risposta veloce
fosforilasi b (poco attiva)
fosfatasi
fosforilasi chinasi
fosforilasi a (attiva)
• risposta a cascata in seguito allo stimolo ormonale (adrenalina e glucagone)
• la fosforolasi b è potenzialmente attiva ed è regolata allostericamente
da ATP e glucosio (inibitori) e AMP (attivatore)
glicogeno fosforilasi
glicogeno fosforilasi
regolazione con modificazione
covalente
Fosforilasi a +P
Fosforilasi b -P
regolazione con effettori allosterici
• inibitori: ATP, G6P,
glucosio;
• attivatore AMP)
dimero della
fosforilasi a
Ser-14
fosforilata
fosforilasi b
AMP
Sito attivo più accessibile
Ansa che impedisce
l’ingresso al sito attivo
controllo allosterico diretto della glicogeno fosforilasi
ATP, G6P, AMP, glucosio: effettori allosterici
ATP, G6P inibiscono la fosforilasi b
AMP attiva la fosforilasi b
glucosio inibisce la fosforilasi a
MODIFICAZIONE
COVALENTE
Proteina-chinasi
cAMP-dipendente
fosforilasi
chinasi meno attiva
fosforilasi
chinasi più attiva
glicogeno
fosforilasi b
Fosfoproteina
fosfatasi-1
glicogeno
fosforilasi a
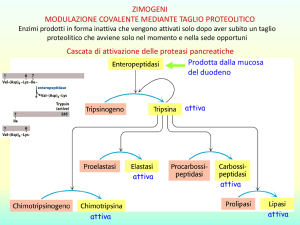
Zimogeni: forme neo-sintetizzate delle proteasi
Scissioni autocatalitiche
Asp 194 interagisce con il nuovo
N-terminale della Ile 16 dopo la
scissione proteolitica
Negli zimogeni la
stabilizzazione dello stato
di transizione è ridotta.
L’attivazione comporta la
corretta formazione della
tasca e del sito relativo allo
stato di transizione
tetraedrico (legami a H nel
buco ossianionico)
1) Un enzima dei primi stadi nell’ossidazione dell’acido palmitico è il palmitoil-CoA-deidrogenasi (PCDH). Hai isolato e purificato l’enzima da
fegato di topo e hai fatto uno studio cinetico utilizzando come substrato il palmitoil-CoA e una concentrazione di enzima pari a 0.01 mM. I risultati
che hai ottenuto per la misura della velocità iniziale in funzione della concentrazione di substrato sono riportati nella tabella:
[Palmitoil-CoA, mM]
0.5
1.0
1.5
2.0
3.0
4.0
6.0
8.0
Stimare il valore di k cat e KM.
Velocità (mM min-1)
2.336
4.00
5.025
5.88
7.30
8.06
9.09
9.90
1/[S]
2.00
1.00
0.67
0.50
0.33
0.25
0.167
0.125
1/vo
0.428
0.250
0.199
0.170
0.137
0.124
0.110
0.101
1. Quale dei due enzimi riportati in tabella come A e B catalizza la reazione a
velocità maggiori a bassa concentrazione del substrato e quale alle più elevate
concentrazioni?
Enzima
A
A
B
B
[Substrato] Vmax
KM
-1
mM
mMsec mM
1.0
10.0
1.00
100.
10.0
1.00
1.0
50.0
20.0
100.
50.0
20.0
1) La seguente tabella presenta le velocità v0 (µ M/sec), alle quali un enzima converte il suo
substrato a prodotto. La reazione 1 (R1) è la reazione non inibita e le R2 e R3 rappresentano i
dati raccolti in presenza di due inibitori differenti, ciascuno presente in concentrazione 10 mM.
Assumendo che la concentrazione di enzima sia la stessa nelle tre reazioni, determinare Km e Vm
per l’enzima e per ciascun inibitore determinare Ki e il tipo di inibizione.
[S] mM
1
2
5
10
20
v, R1
2.5
4.0
6.3
7.6
9.0
v, R2
1.17
2.1
4.0
5.7
7.2
v, R3
0.77
1.25
2.0
2.5
2.86