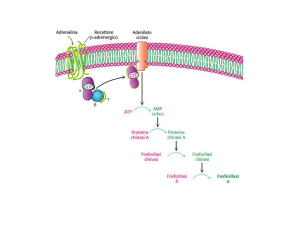
La sintesi del glicogeno prevede inoltre l’intervento:
a) della glicogenina (proteintirosina-glucosiltransferasi) per innescare la
sintesi del glicogeno
ramificante per la formazione di ramificazioni nel glicogeno:
b) dell’enzima
del
l’enzima ramificante,
ramificante, amiloamilo-α (1
(14)
4)α(1
(16) transglicosidasi (fig.
11.5) trasferisce una catena di 55-7 residui glicosidici dall’
dall’estremità
estremità
alla
a quarta
non riducente di una catena di circa 11 residui di glicogeno all
unità
unità glicosidica di un’
un’altra catena alla quale la breve catena viene
unita mediante un legame α(1
(16).
La glicogenina serve da innesco
per la sintesi delle molecole di
glicogeno in mancanza di scorte di
glicogeno:
glicogeno
la glicogenina catalizza la sintesi
dei primi 7-8 residui di glicogeno
restando legata al glicogeno.
glicogenina : glicogeno sintasi
rapporto 1:1
4) amiloamilo-(1,4
1,6)1,6)-transglicosilasi (enzima ramificante)
ramificante)
Figura 11.5
La
sintesi
del
glicogeno (citosol).
Estremità “non riducente” di una catena polisaccaridica è quella in cui il
residuo monosaccaridico teminale ha il suo CC-1 anomerico impegnato in
un legame glicosidico: ciò rende lo zucchero terminale “non riducente”.
riducente”.
Le ramificazioni :
• accrescono il numero di estremità non
riducenti alle quali la glicogenosintasi può
aggiungere ulteriori residui glucosidici
velocizzando la formazione di glicogeno;
• rendono il glicogeno più solubile.
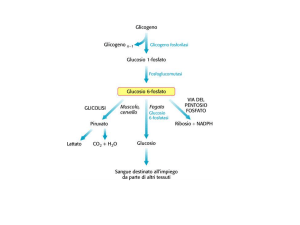
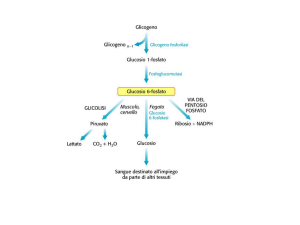
GLICOGENOLISI
ha luogo nel citosol
1)
reazione di
fosforolisi
+ PLP
∆G°’=+3,1 Kj.mol -1
In vivo Pi/Glu-1P=100.Pertanto ∆G = da -5 a 8Kj/mol La glicogenolisi procede spontaneamente
La glicogenofosforilasi ha come coenzima il PLP.
M.N. Gadaleta
Il 50% del PLP (B6) corporeo dei
mammiferi è contenuto nella
Glicogenofosforilasi epatica
e muscolare.
Esempio di catalisi acido-base con
PLP a dare H invece di H2O per
evitare idrolisi e favorire pirofosforolisi
con guadagno di 1 P
E-Pi -glicogeno
1)
fosforolisi
2)
deramifica
zione
Prodotto primario della glicogenolisi è il
Glu 1P che deriva dalla rottura di un
legame a(1
4). Da a(1
6) deriva Glu
semplice.
M.N. Gadaleta
Enzima deramificante: enzima tandem,
tandem, singola catena polipeptidica con 2
domini catalitici oligooligo-α(1
(14)
4)α(1
(16) glucosio transferasi e amiloamiloα(1
(16) glucosidasi.
glucosidasi.
La glicogenofosforilasi rompe i legami α(1
(14) glicosidici fino a un
punto di blocco che è a 3 residui da un punto di ramificazione
(α16).
La transferasi rimuove i 3 residui glicosidici più
più distali dei 4 del
punto di ramificazione e li trasferisce alla estremità
estremità non riducente
di un’
un’altra catena allungandola. Interviene, poi, la amiloamilo-α(1
(16)
glucosidasi per idrolizzare il Glu.
Glu.
3) conversione del Glufosfoglucomutasi)
Glu-1P in GluGlu-6P (fosfoglucomutasi
fosfoglucomutasi
L’enzima fornisce il fosfato per
formare l’intermedio Glu-1,6
bis-fosfato
4) Destino del GluGlu-6-Pi:
nel fegato deve normalizzare la glicemia,
nel muscolo deve fornire energia.
energia
Nel fegato il GluGlu-6P è trasferito al reticolo endoplasmico da una
translocasi.
translocasi. Qui la GluGlu-6fosfatasi libera Glu (vedi gluconeogenesi)
gluconeogenesi)
per normalizzare la glicemia.
glicemia.
Nel muscolo la GluGlu-6fosfatasi non esiste,
esiste, il GluGlu-6P entra
direttamente nella glicolisi.
La sintesi e la demolizione del glicogeno
subiscono una:
•
regolazione ormonale e covalente (glucagone,
adrenalina, insulina)
•
regolazione allosterica (glicogeno sintasi e
glicogeno fosforilasi);
La regolazione risponde in parte a segnali diversi nel
fegato e nel muscolo perché il fegato deve regolare
la glicemia, il muscolo deve rispondere alle
richieste dell’esercizio fisico.