LEZIONE DEL 04/05/2017
IL CONTROLLO DELLA VIA DEI PENTOSI FOSFATO
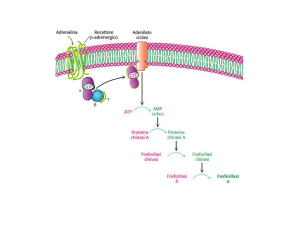
Glc-6P <===> 6P gluconolattone
il verso favorito della reazione è dipendente dal
rapporto tra concentrazioni [NADPH]/[NADP+]. La
Glc-6P DEIDROGENASI è inibita da alte concentrazioni
di NADPH; si tratta di un'inibizione retroattiva, un
controllo a feedback in cui la strada è inibita a
monte.
NADPH E GLUTATIONE
Il glutatione è un tripeptide (Glu-Cys-Gly) non
legato nel modo consueto: tra Glu e Cys si instaura
un LEGAME ISOPEPTIDICO.
Scatenanti dell'ossigeno:
- divicina (nelle fave);
- radiazioni;
- sulfamidici;
- farmaci antimalaria.
La divicina, anch'essa un farmaco antimalaria,
scatena l'ossigeno e lo trasforma in 'O2- --->(2H+)
H2O2 (perossido di idrogeno, acqua ossigenata) --->
'OH + H2O
'O2- cattura un elettrone e diventa radicale
superossido, con un radicale e un eletrone
rispettivamente spaiati, reagisce con due protoni
dell'acqua, che è un potente ossidante. Si va ad
attaccare alle membrane permeabili.
L'enzima GLUTATIONE PEROSSIDASI ossida il monomero
1
tripeptidico ad un dimero, che si può nuovamente
ridurre col ruolo di eccellente scambiatore di
protoni e conseguente trasformatore di un perossido
in acqua. Se invece resta nella sua forma ossidata, e
interviene altro perossido, non può reagire, perché
serve qualcosa che lo ricarichi: la riduzione sarà
rifatta a carico di NADPH.
La via dei pentosi fosfato è la principale sorgente
di NADPH. Abbiamo visto che se manca la GLUCOSIO-6P
DEIDROGENASI questo può tornare letale, dato che non
si avvia la produzione di NADPH. Ciò può avvenire a
causa di difetti genetici (varie mutazioni). Il
rischio aumenta con l'uso dei farmaci (tipo quelli
contenenti divicina). Tuttavia, nei paesi in cui c'è
il rischio della malaria, avere poco Glc-6P
DEIDROGENASI funziona come un bene. Il plasmodio
della malaria infatti, quando attacca gli eritrocici
ha bisogno di qualcosa che hanno solo in presenza
solo della deidrogenasi sopra citata.
Abbiamo già parlato con Rosato di una patologia che
andava a favore dell'organismo nelle zone affette da
malaria, un mese fa preciso (LEZIONE DEL 04/04/2017):
[Protegge da altro? Nelle zone con la malaria,
l'anemia falciforme ci protegge dalla persistenza del
ciclo dei parassiti. ]
LA VIA DEL RIBULOSIO (IL GIOCO DEL 10) FASE NON
OSSIDATIVA DELLA VIA DEI PENTOSI FOSFATI
Nella fase non ossidativa della via metabolica dei
pentoso fosfati avvengono diverse reazioni che hanno
lo scopo di produrre NAD ridotto.
2
Reazione 5: attività transchetolasica
Reagenti: Ribosio-5-fosfato, Xilulosio-5-fosfato
Prodotto: Sedoeptulosio-7-fosfato, Gliceraldeide-3fosfato
Tipo di reazione: Transchetolazione
Enzima coinvolto: Transchetolasi
Cofattore: Nessuno
Nela prima reazione non ossidativa, il ribosio-5fosfato reagisce con lo xilulosio-5-fosfato mediante
l'azione dell'enzima transchetolasi che, a sua volta,
è coadiuvato dalla tiamina. La reazione produce
sedoeptulosio-7-fosfato e gliceraldeide tre fosfato.
Lo xilulosio-5-fosfato è l'epimero del ribulosio-5fosfato.
Reazione 6: attività transaldolasica
Reagenti: Sedoeptulosio-7-fosfato, Gliceraldeide-3fosfato
Prodotto: Fruttosio-6-fosfato, Eritrosio-4-fosfato
Tipo di reazione: Transaldolasica
Enzima coinvolto: Transaldolasi
Cofattore: Nessuno
Nella seconda reazione non ossidativa, il
sedoeptulosio-7-fosfato reagisce con la
gliceraldeide-3-fosfato per mezzo dell'enzima
transaldolasi. Si forma il fruttosio-6-fosfato e
l'eritrosio-4-fosfato mediante una reazione
3
reversibile che può formare i reagenti di partenza
Reazione 7: formazione del fruttosio-6-fosfato
Reagenti: Eritrosio-4-fosfato, Xilulosio-5-fosfato
Prodotto: Fruttosio-6-fosfato, Gliceraldeide-3fosfato
Tipo di reazione: Transchetolasi
Enzima coinvolto: Transchetolasi
Cofattore: Nessuno
L'ultima reazione della via dei pentoso fosfati porta
alla transchetolazione degli zuccheri eritrosio-4fosfato e xilulosio-5-fosfato mediante l'enzima
transchetolasi, che è coadiuvato dalla tiamina, per
formare fruttosio-6-fosfatoo e gliceraldeide-3fosfato.
Bilancio energetico globale
La via dei pentoso fosfati ha due scopi. Nella parte
ossidativa la cellula sintetizza il ribosio-5fosfato, precursore dei nucleotidi, mentre nella
parte non ossidativa avvengono delle trasformazioni
che rimettono in ciclo il fruttosio-6-fosfato,
convertito facilmente in glucosio-6-fosfato. Questa
seconda parte avviene perlopiù quando la cellula, e
di conseguenza il tessuto, si trova in uno stato di
maggiore necessità di potere riducente sotto forma di
NADPH rispetto alla richiesta dello zuccherio
ribosio-6-fosfato.
Regolazione della via dei pentoso fosfati
La via dei pentoso fosfati è finemente regolata.
L'enzima di controllo è il glucosio-6-fosfato
deidrogensi che è fortemente inibito dalla presenza
di NADPH; per quanto riguarda la posizione è da
osservare che, al pari di altre vie metaboliche,
l'enzima si trova"monte" di tutte le reazioni. In
altre parole, se in un determinato momento la cellula
possiede un buon quantitativo di NADPH, l'enzima non
4
è attivo e -di conseguenza-, la via dei pentoso
fosfati si blocca.
TRANSCHETOLASI E TRANSALDOLASI
(meccanismi a confronto)
TRANSCHETOLASI
Funziona come gli enzimi che decarbossilano, usa la
vitamina B1, la TPP, che agisce da cofattore.
L'anello tiazolico (già detto nella lezione
precedente) lega gli α-chetoacidi, si immette nel Cα.
- stacca due unità carboniose;
- in prossimità di un grppo chetonico stabilizza per
risonanza il carbanione C-.
TRANSALDOLASALDOLASI
Azione esercitata da un residuo di Lys, il cui gruppo
amminico terminale dentro il sito attivo riesce a
formare una base di Shiff (il cui tratto tipico è
un'interazione tra carbonio e azoto); la
transaldolasi stacca quel che le serve senza vitamine
5
- stacca tre unità carboniose;
- in prossimità di un gruppo aldeidico stabilizza per
risonanza il carbanione C- formando una base di Shiff
con una lisina.
FORMA GENERICA DI UNA BASE DI SHIFF
METABOLISMO DEL GLICOGENO
I. INTRODUZIONE AL METABOLISMO;
II. CATABOLISMO;
III. SINTESI;
IV. RAMIFICAZIONE;
V. CONTROLLO.
I. INTRODUZIONE
Il glicogeno costituisce una riserva energetica
istantanea nei vertebrati. Il suo metabolismo si
svolge nel citosol delle cellule epatocite e nelle
cellule del muscolo scheletrico. Si trova nel corpo
sotto forma di granuli contenenti fino a 5.5*104
residui di glucosio. Negli epatociti si trovano nel
6
reticolo endoplasmatico liscio. L'accumulo come
energia di rapido impiego implica dei vantaggi:
1) a differenza dei lipidi, il glicogeno è utilizzato
come fonte energetica in anaerobiosi;
2) se si accumulasse come singole molecole di
glucosio, ciò comporterebbe un'enorme pressione
osmotica; essendo il glicogeno aggregato di
componenti, riduce tale pressione;
3) il fatto di essere ramificato con molte estremità
non riducenti permette la mobilitazione molto rapida
delle estremità dei lipidi (che si mangiano glucosio
tipo PAC-MAN);
4) il numero e la ripetizione delle ramificazioni è
ottimizzabile.
II. IL CATABOLISMO DEL GLICOGENO
(per azione della GLICOGENO FOSFORILASI)
DERAMIFICAZIONE
7
Ci possono essere al massimo 4 molecole di glucosio
per ramificazione; se vi è un incastro dell'enzima,
sorgono problemi sulle ramificazioni.
La GLICOGENO FOSFORILASI mi dà dunque Glc-6P.
Interviene in una ramificazione completa una
TRANSFERASI che achiappa i tre residui esterni e li
attacca sulla principale, in coda, a questo punto
agisce la GLICOGENO FOSFORILASI. Il Glc della
ramificazione rimanente si libera e si trasforma
semplicemente in glucosio libero. Quest'ultimo
dev'essere fosforilato, per non uscire dalla cellule
(siamo nel fegato, può farlo!). La degradazione del
glicogeno è favorita da condizioni fisiologiche
(siamo nel fegato, che è un ottimo donatore. La
reazione ha un ΔG°' = + 3 kJ/mol, ma in condizioni
fisiologiche ΔGTOT vale circa 5/8 kJ/mol.
Che le due vie, di catabolismo e sintesi, si sapeva
dalla scoperta della malattia di McArdle. Pazienti
con la fosforilasi muscolare malfunzionante non
riescono a demolire il glicogeno ma possono
sintetizzarlo: i due processi devono essere
caratterizzati da enzimi diversi!
III. SINTESI GLICOGENO
La sintesi del glicogeno, la reazione inversa,
richiede una strategia diversa perché sfavorita
termodinamicamente.
UDP-GLUCOSIO PPi FOSFORILASI
8
Per sintetizzare glicogeno il Glc-1P dev'essere
"attivato"; l'attivazione viene effettuata a spese di
UTP tramite UDP PIROFOSFORILASI, che attacca il
Glc-1P per attivarlo.
Glc-1P + UTP (---> UMP + Glc-1P + PPi) ---> UDP-Glc +
PPi ---> (idrolisi del pirofosfato che trasforma
un'endoergonica in un'esoergonica per mezzo della
PIROFOSFATASI INORGANICA) Pi + Pi.
RAMIFICAZIONE
Una alla volta, le unità di Glc donate dall'UDp-Glc
vengono attaccate ad una molecola di glicogeno
preesistente (dalla GLICOGENO SINTASI) con un legame
α-1,4. La GLICOGENO SINTASI non è in grado di formare
legami α-1,6. Interviene allora la
AMILO-(1,4)-(1,6) TRANS-GLICOLICASI. Quest'enzima
ramificante trasferisce 6 o 7 residui di Glc per
volta; prendendoli da un'estremità non riducente di
una catena lineare di glicogeno lunga almeno 11
residui e mettendoli su una ramificazione della
stessa, o di un'altra molecola di glicogeno.
Funziona solo se c'è glicogeno; se questo è terminato
siamo in una situazione paradossale (un'ipoglicemia
negli epatociti). Intanto è molto difficile che tutto
il glicogeno venga degradato (a meno che non ci si
trovi in condizioni di digiuno forzato e prolungato).
Se questo dovesse succedere, entra in funzione la
9
sintesi de novo da parte di un PRIMER: la GLICOGENINA
(promuove l'attacco su OH di zuccheri). La
glicogenina è un dimero, presente sia nel muscolo che
nel fegato e contiene nel sito di legame dell'UDP-GLU
un residuo di Tyr, che lega con UDP-Glc e forma
sintesi su se stessa. La SINTASI agisce e si inizia
la catena principale, la GLICOGENINA si sacrfica.
COSTO SINTESI
Si ottiene sommando le prime reazioni:
(1) Glc-1P + UTP ---> UDP-Glc + PPi
Enzima: UDP PIROFOSFORILASI
+
(2) Glicogeno(n) + UDP-Glc ---> Glicogeno(n+1) + UDP
Enzima: GLICOGENO SINTESI
=
Glicogeno(n) + Glc-1P + UTP ---> Glicogeno(n+1) + UDP
+ 2Pi
Avendo incluso l'azione della PIROFOSFATASI
INORGANICA
C'è un consumo netto di una molecola ricca di energia
(UTP) che viene ricostituita dall'enzima NUCLEOTIDE
10
DIFOSFATO CHINASI:
UDP + ATP ---> UTP + ADP
PROBLEMA
0.15*10-3 moli di glicogeno come in figura subiscono
l'azione della sola glicogeno fosforilasi. Calcolare
la massa i Glc-1P prodotta sapendo che PAP = 31, PAO
= 16, PAC = 12.
11