JOURNAL CLUB
Maria Elena Conidi
MITOCONDRI
«organelli citoplasmatici presenti nelle cellule eucariotiche»
Molteplici funzioni:
1) metabolismo energetico con la produzione di ATP (ciclo di Krebs e Fosforilazione ossidativa (OXPHOS))
Gli altri processi in cui il mitocondrio interviene sono:
2) Bilancio redox (specie reattive dell’ossigeno (ROS))
3) Regolazione del ciclo cellulare
4) Omeostasi del calcio
5) Termogenesi
Danno mitocondriale:
Dismetabolismo energetico (necrosi)
Stress ossidativo
Apoptosi
Alterazioni metabolismo del calcio
MITOCONDRI
matrix
Il numero di mitocondri varia ampiamente da un tipo cellulare all’altro.
cristae
La modulazione della numerosità avviene attraverso biogenesi mitocondriale, mitofagia,
inner
membrane
intermembrane
space
mitochondrion
outer
membrane
fissione e fusione !!
La regolazione di questi processi è differente sia dentro le cellule che tra tipi cellulari diversi,
«variabilità di numero, dimensioni e forme» della popolazione mitocondriale!!
«Variabilità di numero» si ha in base al tipo di popolazione cellulare ed alle esigenze energetiche del tessuto:
-
alcuni tipi cellulari hanno da pochi a 4 mitocondri «come piccoli organelli isolati», mentre
-
popolazioni cellulari con alto bisogno energetico «oltre un centinaio di mitocondri» che agiscono come un network dinamico.
Il cervello, organo ad alta attività energetica, è fortemente dipendente dal
metabolismo ossidativo (OXPHOS)
-
I mitocondri sono necessari per una corretta attività neuronale
-
Nei neuroni «elevato numero di mitocondri» + «alto contenuto di mtDNA»
Mitocondri & Radicali liberi
I mitocondri sono il principale sito responsabile della produzione
del 90% di radicali liberi.
Vengono prodotti quando gli elettroni fuoriescono dalla «catena di
trasporto degli elettroni (ETC)» e reagiscono con l’ossigeno.
Circa 1 e 5% di tutto l’ossigeno si liberano come
radicali superossidi (ROS).
In condizioni fisiologiche, i radicali liberi sono prodotti continuamente nelle cellule
devono essere bilanciati dalle «difese antiossidanti»
Sbilanciamento tra i ROS / difese antiossidanti
«equilibrio di ossidoriduzione»
«stress ossidativo»
danno ossidativo
Mitocondri & Radicali liberi
La progressiva alterazione delle funzioni mitocondriali è coinvolta nei normali processi di invecchiamento ma anche in malattie neurodegenerative
(es. Alzheimer).
Significativa riduzione del contenuto proteico del complesso OXPHOS, della sua attività e della produzione di energia sono segni caratteristici
della riduzione del metabolismo energetico (aumento di ROS + disfunzione mitocondriale) associati alla malattia di Alzheimer e sono stati
osservati nel cervello post-mortem di pazienti con Alzheimer ad esordio tardivo (LOAD).
«ipotesi della cascata mitocondriale»:
Alterazioni mitocondriali
aumento dei livelli di ROS
Stress ossidativo cellulare
danno su componenti
cellulari e mitocondriali
(1) Dinamica mitocondriale & Stress ossidativo
Due importanti meccanismi:
1) FUSIONE_ consente ai mitocondri di combinarsi ed interagire tra loro
_ mantenimento di organelli funzionali.
2) FISSIONE_ facilita il riarrangiamento, rimodellamento e
proliferazione mitocondriale.
_ gioca un importante ruolo nel corretto
assemblaggio dei complessi di trasporto degli
elettroni transmembrana (ETCs).
(1) Dinamica mitocondriale & Stress ossidativo & malattia di Alzheimer
Alterazioni nell’espressione delle proteine di fissione-fusione possono risultare in una “distribuzione mitocondriale alterata”.
Cambiamenti nella dinamica mitocondriale ha un impatto significativo sulla funzionalità mitocondriale.
Nei cervelli post-mortem con AD è stata osservata “un’eccessiva frammentazione” in associazione ad una riduzione di proteine di fusione ed
aumento di proteine di fissione ( sbilanciamento fissione/fusione)
mitocondri mal funzionanti nei neuroni danneggiati.
Le dinamiche mitocondriali sono critiche per l’integrità
mitocondriale e suoi cambiamenti hanno un impatto
negativo su tutte le funzioni mitocondriali:
- metabolismo energetico
- omeostasi del Ca++
- generazione di ROS
- regolazione dell’apoptosi
Una eccessiva frammentazione, mediata da una eccessiva fissione e sbilanciamento dell’equilibrio fusione/fissione, può essere dovuta a stress
ossidativo ed eccessiva produzione di ROS, anche perché la fissione gioca un ruolo importante nell’assemblaggio dei complessi ETC.
(1) Dinamica mitocondriale & Alzheimer
Evidenze sperimentali:
Saggi di immunoblotting hanno evidenziato che la presenza di APP altera il rapporto
fusione/fissione, con riduzione di Mfn1 e 2, DRP1 e OPA1 e aumento di hFis1.
Studi su fibroblasti umani da pazienti con AD sporadici hanno messo in luce
un’alterata distribuzione dei mitocondri e dimostrato che elevato stress ossidativo ed
elevata produzione di Aβ sono fattori che causano riduzione di Drp1.
pTau e Aβ stimolano la nitrosilazione di Drp1 con conseguente aumento della
fissione e neurodegenerazione.
Cellule con deficit di fusione mitocondriale mostrano riduzione del potenziale di
membrana mitocondriale e ridotta respirazione. Infatti la diminuzione di OPA1 induce
il rilascio di cyt c e lo accelera tramite stimoli apoptotici.
Aumento del processo di fissione + riduzione della fusione + aumento delle interazioni di pTau e Aβ con
Drp1
eccessiva frammentazione mitocondriale + alterato trasporto assonale dei mitocondri +
conseguente degenerazione sinaptica nei neuroni affetti da AD.
Distruzione delle dinamiche mitocondriali può essere considerato evento iniziale della morte cellulare ROS-mediata!!
(2) ROS mit + Apoptosi & malattia di Alzheimer
Sbilanciamento radicali liberi / meccanismi di difese antiossidanti
«stress ossidativo»
danno ossidativo
necrosi cellulare ed apoptosi.
Stress Ossidativo è legato al processo di invecchiamento e neurodegenerazione.
Nel cervello, alterata respirazione mitocondriale + aumento di ROS = cambiamenti funzionali e
danno cellulare.
Mitocondri difettosi rilasciano grandi quantità di ROS
Declino dell’attività degli enzimi antiossidanti (es nella senilità) incrementano la formazione degli
stessi con conseguente danno alla catena respiratoria, in particolare dei complessi I e III e COX.
Nella malattia di Alzheimer
Alterazioni della OXPHOS (per inibizione da parte di Aβ)
Modificazione del metabolismo energetico +
riduzione di ATP + aumento di ROS.
Sono stati osservati:
- stress ossidativo associato alla membrane (riduzione della dpm)+ aumentata produzione di ROS + perturbazione dell’omeostasi del Ca++.
- aumentata permeabilità di membrana e rilascio di cyt c e fattori proapoptotici, indotti da oligomerizzazione e polimerizzazione di Aβ, portano
all’apertura dei pori MPTP con conseguente apoptosi.
Inoltre l’attività della citocromo ossidasi (COX) è ridotta e i neuroni mostrano danno mitocondriale ed apoptosi !!
(3) Complesso di trasporto degli Elettroni (ETC) + stress ossidativo & Alzheimer
Alterazioni a livello dei complessi ETC culminano nello stress ossidativo con sovrapproduzione
di ROS, alterazione dell’energia, omeostasi aberrante del Ca++, riduzione del dpm, alterazione
della permeabilità dei pori MPTP
morte cellulare per necrosi o apoptosi.
La riduzione del trasferimento di elettroni = meccanismo di disfunzione mitocondriale
caratteristico dell’invecchiamento.
I complessi I COX sono ridotti nell’invecchiamento
Riduzione significativa dell’attività della citocromo ossidasi (cyt c e complesso IV) è stata osservata
nelle piastrine, nella corteccia ed ippocampo di pazienti con Alzheimer.
Nelle piastrine è stato osservato un deficit mitocondriale che sta ad indicare una alterazione
dell’attività del complesso III e COX.
(4) DNA mitocondriale (mtDNA)
Struttura circolare a doppio filamento; circa 16,6kb
13 geni codificanti proteine del complrsso OXPHOS:
7subunità del complesso I; 1 del complesso III; 3 del
complesso IV; 2 del complesso V;
22 geni per i tRNAs; 2 geni per rRNAs; una regione
di controllo non codificante (CR)
(4) Caratteristiche del mtDNA
POLIPLASMIA: ogni cellula presenta molti mitocondri ed ogni mitocondrio
contiene multiple copia del suo genoma (eccetto piastrine e ovulo non
fertilizzato) migliaia di copie mtDNA / cell.
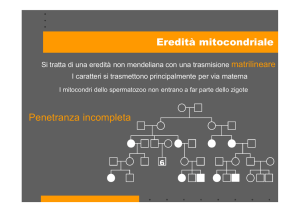
Durante la divisione cellulare i mitocondri vengono distribuiti casualmente alle
cellule figlie e quindi la genetica mitocondriale è più simile alla genetica di
popolazione che alla genetica mendeliana.
ETEROPLASMIA: Nel caso di una mutazione del mtDNA questa può
colpire tutte le copie, poiché può essere ereditata a livello della linea
germinale oppure essere presente solo in una percentuale di genomi come
mutazione de novo a livello delle cellule somatiche.
(4) Caratteristiche del mtDNA
EFFETTO SOGLIA: espressione clinica delle mutazioni del mtDNA è determinata
dalla relativa proporzione wild type/mutato in un determinato tessuto;
E’ necessario un numero minimo di copie per danneggiare il metabolismo
energetico di un determinato organo o tessuto (valore relativo e non assoluto)
(SNC, cuore, muscolo, rene e ghiandole esocrine) (bilancio energetico).
EREDITA’ MATERNA: tutti i mitocondri dello zigote derivano dall’oocita e
perciò la modalità di trasmissione delle mutazioni mtDNA differisce dalla
trasmissione mendeliana classica:
madre portatrice trasmissione a tutta la progenie, ma solo le figlie femmine
possono trasmettere la mutazione ai loro figli.
Eteroplasmia + effetto dose eccezioni fenotipiche all’eredità matrilineare.
DNA mitocondriale + stress ossidativo & malattia di Alzheimer
Le mutazioni a livello del mtDNA si possono propagare per espansione clonale
Mutazioni somatiche nel mtDNA possono così influenzare il fenotipo (effetto soglia)
Accumulo graduale di mutazioni somatiche del mtDNA possono implementare il loro effetto deleterio nel tempo
Difetti nel mtDNA sono stati trovati anche in soggetti anziani non affetti da demenza
Numerosi studi hanno dimostrato che mutazioni nel mtDNA si accumulano progressivamente con l’età in vari tessuti, in
particolare nei tessuti ad elevata attività metabolica (cervello) si accumulano livelli più elevati di mtDNA mutato durante il
processo di invecchiamento!!
DNA mitocondriale + stress ossidativo & malattia di Alzheimer
L’età è da considerare il principale fattore di rischio per l’Alzheimer e altre malattie neurodegenerative
L’ipotesi della cascata mitocondriale ha dato il via a numerosi studi sulle alterazione del DNA mitocondriale associate
ad eccessivo stress ossidativo
Vulnerabilità del mtDNA al danno ossidativo:
È localizzato in regioni prossime ad alte
Nella CR: T414G,
T414C,T477C
concentrazioni di ROS;
Assenza di efficienti meccanismi di riparazione del
DNA;
Assenza di istoni protettivi della struttura del DNA;
5-kb mtDNA
DNA mitocondriale + stress ossidativo & malattia di Alzheimer
Nel cervello post-mortem di pazienti AD è stato osservato un maggior danno ossidativo a livello del mtDNA, rispetto all’età, che porta ad un
maggior numero di mutazioni/delezioni e problemi post genomici di regolazione dell’espressione.
Cambiamenti dell'espressione di geni mitocondriali e nucleari, codificanti le proteine dei complessi OXPHOS contribuiscono ad alterare il
metabolismo ossidativo nell’Alzheimer!!
Comunque il mtDNA non gioca un ruolo primario nella patogenesi dell’Alzheimer ma è coinvolto successivamente!!
Dati sperimentali:
ridotta attività del complesso I, in particolare della subunità ND4 nella corteccia temporale;
Espressione differente dei geni mitocondriali codificanti il complesso I, COX e complesso V;
Lo studio dell’espressione dei geni mitocondriali e nucleari in aree differenti del cervello ha altresì mostrato una diversa proporzione tra i vari
componenti, contribuendo così a perturbazioni del metabolismo ossidativo.
morte
cellulare
accumulo
mutazioni
mtDNA
Accumulo
mutazioni mtDNA
ANELLO A
FEEDBACK
POSITIVO
Riduzione ATP +
aumento di ROS
riduzione
dell’efficienza
dell’ETC
CONCLUSIONI (1)
1) La patologia mitocondriale può essere considerata un importante fattore nella manifestazione dei sintomi
clinici delle neurodegenerative;
2) Alterazioni mitocondriali, coinvolte nella patofisiologia di diverse malattie neurodegenerative, includono:
- alterazioni del OXPHOS;
- aumento del numero di mutazioni, delezioni o polimorfismi,
-alterazioni dell’omeostasi del calcio,
- alterazione del metabolismo energetico così come l’interazione con proteine malattia-specifiche (Aβ amiloide)
3) Approcci terapeutici finalizzati al rafforzamento delle funzioni mitocondriali potrebbero avere un significato
per la cura o il contenimento delle malattie neurodegenerative !!
CONCLUSIONI (2)
1) Nella malattia di Alzheimer abbiamo visto che l’alterazione della dinamica mitocondriale (shift verso la
fissione) impatta negativamente su tutta l’attività mitocondriale
punto critico nella patogenesi
dell’Alzheimer.
2) Strategie in grado di modificare l’anormale dinamica mitocondriale potrebbero essere un interessante
intervento terapeutico per l’Alzheimer.
3) Farmaci mirati a ridurre l’espressione delle proteine di fissione mitocondriale (Drp1, Aβ e pTau) potrebbero
proteggere i neuroni dall’effetto tossico di questi fattori e dalle loro interazioni.