STUDIARE SUI PDF ALLEGATI
Con il termine disordini mitocondriali si intende un gruppo eterogeneo di
disturbi che si originano per un malfunzionamento della catena respiratoria
mitocondriale: cioe’ quell’insieme di reazioni che costituiscono la catena
respiratoria, essenziale per il corretto svolgersi del metabolismo aerobico.
Malfunzionamento dei mitocondri si ritrova anche in malattie originate
da mutazioni nel genoma nucleare, i cui prodotti entrano nella catena
respiratoria e nel mitocondrio, quindi dal punto di vista genetico bisognera’
sempre sapere di quale DNA si sta parlando perche’ i modelli di trasmissione
sono diversi.
(Ritengo necessario aprire una parentesi sull’ origine della cellula eucariotica e la sua
evoluzione. Si ritiene che la cellula eucariotica dotata di nucleo, organelli vari (reticolo
endoplasmatico, mitocondri, vacuoli....), in grado di svolgere la maturazione degli RNA......
cioe’ come la conosciamo oggi (e come voi dovreste conoscere a perfezione e se non
conoscete le differenze fra eucarioti e procarioti andate a studiarle!!!) derivi da un
processo di fusione tra due organismi primordiali: un proeucariote anaerobico (Archea) e
un procariote ancestrale endosimbionte. La presenza del simbionte aerobico ha fornito un
grande vantaggio evolutivo alla cellula ”parassitata”: era, infatti, in grado di produrre
energia in modo piu’ efficiente, anche se ha dovuto modificare la propria organizzazione
per esempio per proteggere il DNA dai radicali liberi che si originano dalla carena
respiratoria (formazione del nucleo), il batterio parassita ha acquisito funzioni legate ai
geni presenti nel DNA dell’Archea ( noi deriviamo da questa cellula, l’evoluzione parte
da li’ e per capire la genetica umana e non, bisogna avere delle informazioni anche
sui microorganismi! Percio’ leggetevi, interiorizzate in una parola studiate almeno il
pdf allegato (origine del mitocondrio.pdf) che viene dal sito:
http://knol.google.com/k/l6-all-origine-degli-eucarioti-e-dei-mitocondri# by Mauro
Mandrioli)
Dopo aver rinfrescato le nostre (soprattutto le vostre) conoscenze
generali, torniamo ai disordini mitocondriali.
Dal momento che tutto il nostro organismo dipende dall’insieme del
metabolismo aerobico, non dovrebbe stupire che praticamene tutti i nostri
organi, tessuti, cellule, funzioni siano coinvolti nelle manifestazioni di questi
disordini.
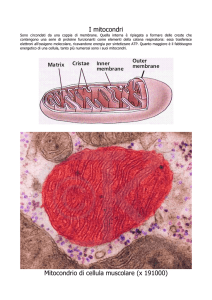
Credo sappiate come e’ organizzato il mitocondrio e come funziona (se
non ve lo ricordate andate a riguardarvelo) quindi ricorderete che oltre 70
polipeptidi interagiscono con la membrana interna e originano la catena
respiratoria. Dal momento che il DNA mitocondriale e’ piccolo (16,5 kb), non
puo’ contenere l’informazione per tutte, anche perche’ una parte del mtDNA
e’ necessaria per regolare la replicazione e la trascrizione delle molecole
codificate direttamente. La maggior parte delle subunita’ sono il prodotto di
geni nucleari, solo 13 di loro sono prodotte dal mtDNA, oltre ai 22 tRNA e due
rDNA 12S e16S specifici del mitocondrio.
Le cellule eucariotiche contengono migliaia di copie di mtDNA, di solito
sono identiche fra loro (omoplasmia), le eventali mutazioni somatiche
difficilmente originano una eteroplasmia che conduce alle malattie. Il collo di
bottiglia che puo’ far aumentare la percentuale di mtDNA mutante, fino ad
arrivare alla soglia critica e’ negli oociti dove la quantita’ di mitocondri e’
elevatissima, ma viene ridotta drasticamente durante la maturazione. Ne
consegue che se inizialmente i mitocondri mutanti erano pochi in termini
percentuali, per effetto della casualita’ potrebbero dare origine a popolazioni
di oociti con un elevato numero di mitocondri mutanti e quindi ad un embrione
malato nella generazione successiva. (vedi PDF: The inheritance of
pathogenic mitochondrial DNA mutations)
Questo collo di bottiglia e’ all’origine sia dell’insorgenza dei casi
sporadici che della variabilita’ di espressione fra gli affetti anche della stessa
famiglia. Infatti la comparsa del fenotipo patologico e’ legata alla percentuale
di mitocondri alterata nei singoli tessuti, organi: esiste l’effetto soglia per cui
solo quando si supera una certa percentuale di mitocondri mutati il difetto
biochimico e funzionale diventa evidente. Questo fenomeno spiega anche la
variabilita’ fenotipica degli affetti. Per esempio la mutazione del codone 8937
(indicata come m.8993T>G): i soggetti affetti da sindrome di Leigh
presentano una piu’ alta percentuale di mitocondri mutati, rispetto a quelli che
hanno debolezza muscolare, atassia e retinite pigmentosa (NARP), da notare
che entrambi i gruppi di pazienti hanno la stessa mutazione.
Questo introduce il grosso problema dal punto di vista genetico di
questo gruppo di malattie: per i disordini mitocondriali non si puo’ fare una
relazione genotipo fenotipo, infatti il fenotipo clinico non sempre corrisponde
a mutazioni dello stesso locus (non stiamo parlando di allelia multipla:
riguardatevi le definizioni) e a parita’ di mutazione il fenotipo puo’essere
diverso. Se consideriamo il fenotipo produzione di energia per via aerobica
uniformiamo tutti, ma dovremmo considerare il mtDNA nel suo insieme come
unico locus, comunque non servirebbe lo stesso a riportare a modelli
matematici l’ereditarieta’ mitocondriale.
Ereditarieta’. Credo sappiate che i mitocondri si ereditano solo per via
materna, da questo ne consegue che nei casi familiari da mutazione del
mtDNA tutti i figli di una donna portatrice di un disordine mitocondriale
saranno a rischio, anche se non si puo’ tradurre questo rischio in
percentuale. Il motivo di questa difficolta’ risiede in quanto detto prima
sull’eteroplasmia e l’effetto soglia. Comunque la statistica ci aiuta a dare delle
percentuali di rischio.
In primis quanti sono gli alleli patogenetici? Si ritiene che siano
presente in oltre l’0,5% dei nati vivi e che si verifichino de novo ogni 1000
nasciti, sempre gli studi epidemiologici ci dicono che almeno 1 persona su
5000 e’ colpita con vari livelli di gravita’ da patologie riconducibili al mtDNA.
Quindi e’ un’insieme di patologie importante a livello sociale.
Quale e’ il rischio di ricorrenza nei casi di famiglie con donne affette?
Studi familiari (cfr. PDF mitochondrial dna mutations in human disease)
indicano una ricorrenza nella progenie di una madre affetta di circa 4,11%.
Per comprendere queste cifre bisogna considerare che i dati sulle famiglie
indicano anche un altro fenomeno apparentemente strano: in famiglie con
sindrome di LHON, e nel caso di una mutazione nel gene del RNA
ribosomale 12S (cfr il PDF di prima) vi e’ indicazione di omoplasmia nelle
madri affette, tuttavia i figli che hanno ereditato necessariamente la
mutazione presentano penetranza ridotta: circa il 50% dei maschi ma solo il
10% delle femmine. Questo dato statistico segnala che il background
nucleare e’ importante.
E’ quindi come si fa prevenzione? Bella domanda uno spiraglio viene dalla
fecondazione assistita utilizzando uova con mitocondri normali, prive di
nucleo.