Master in Terapia intensiva Neonatale e Pediatrica 2011
ENCEFALOPATIA POST-ASFITTICA E TRATTAMENTO CON IPOTERMIA.
ESPERIENZA DELLA TIN DELLA CLINICA PEDIATRICA
DELL’UNIVERSITA’ DEGLI STUDI DI PERUGIA.
Diletta de Benedictis
Terapia Intensiva Neonatale Perugia
ENCEFALOPATIA IPOSSICO ISCHEMICA
Si instaura quando ad un evento asfittico
perinatale segue un interessamento del
sistema nervoso centrale a seguito di un
ridotto apporto di ossigeno (ipossiemia)
e/o per una ridotta perfusione (ischemia)
cerebrale.
Si presenta con necessità di
rianimazione
alla nascita, depressione neurologica,
convulsioni ed anomalie EEG
ENCEFALOPATIA IPOSSICO ISCHEMICA
L’incidenza dell’asfissia perinatale è di 2-4 ogni 1000
neonati a termine.
L’asfissia moderata determina sequele neurologiche
permanenti nel 20% dei neonati, tale percentuale sale
fino al 100% se l’asfissia è severa.
Il 30% dei casi di paralisi cerebrale sono
conseguenza di un danno ipossico-ischemico
perinatale.
Oltre alle disfunzioni neurologiche, nel 50 % dei casi
l’asfissia determina alterazioni multiorgano, con
conseguenti alterazioni metaboliche e sistemiche
che contribuiscono ad aggravare le condizioni di un
sistema nervoso già compromesso.
SEGNI CLINICI DI ENCEFALOPATIA
IPOSSICO-ISCHEMICA
Convulsioni
Alterazioni dello stato di coscienza
(1: ipereccitabilità, 2: letargia, 3: coma)
Anomalie
posturali
Scomparsa dei riflessi arcaici
Anomalie del ritmo cardiorespiratorio
(apnee, bradicardia)
Tensione
della fontanella anteriore
ENCEFALOPATIA IPOSSICO-ISCHEMICA
SECONDO SARNAT
STADIO
CLINICA
I
LIEVE
Ipereccitabilità, esame neurologico ed EEG
normali, veglia protratta, riflessi vivaci, tono
normale o aumentato, midriasi, tachicardia
II
MODERATA
Letargia, apatia, ipotonia, riflessi neonatali
torpidi, convulsioni, miosi, bradicardia, EEG
con punte/onde
III
GRAVE
Coma, riduzione/assenza riflessi,
flaccidità, rare convulsioni, variabilità
di dilatazione pupillare, variabilità
di frequenza cardiaca, EEG inattivo
o abnorme
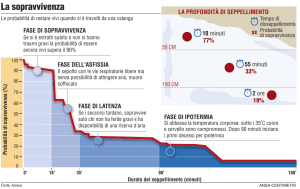
FASI DEL DANNO CEREBRALE
PRIMA
FASE: morte di una quota di cellule
nervose per il primitivo esaurimento di riserve di
energia.
SECONDA
FASE: necrosi neuronale (apoptosi)
a seguito di una serie di eventi biochimici a
cascata.
Esiste pertanto una finestra temporale che separa
il danno acuto dal danno mediato dalla liberazione
di sostanze tossiche che potrebbe offrire una
possibilità terapeutica.
FINO A POCO TEMPO FA …
SUPPORTO
GESTIONE
PARAMETRI VITALI
SINDROME MULTIORGANO
TRATTAMENTO
FARMACOLOGICO DELLE
CONVULSIONI
TERAPIA DEGLI ESITI
Tuttavia nessuna azione diretta a ridurre il
danno neurologico …
L’Ipotermia Terapeutica è un trattamento medico
volto ad ottenere una riduzione della temperatura
corporea centrale.
La raccomandazione attuale è quella di utilizzare
temperature comprese fra 32 e 34°C (ipotermia postarresto cardiaco e post-asfissia perinatale).
LA STORIA DELL’IPOTERMIA
Prime notizie aneddotiche dagli Egizi
Ippocrate (460-370 a.c.)
Celsio “De Medicina”
Galeno “Opera Omnia”
Generale Larrey, chirurgo delle armate napoleoniche nella Grande
Armée in Russia (1800)
Temple Fay neurochirurgo, primo studio scientifico con ipotermia
terapeutica nei traumi cranici (1945)
Botterell in interventi di neurochirurgia (Anni ’50)
Bigelow in cardiochirurgia (Anni ’50)
Rosomoff: studi in animali e poi con Safar in pazienti con ischemia
cerebrale e danno cerebrale traumatico trattati con ipotermia
profonda (Anni ’50-60)
Benson: 12 pazienti con arresto cardiaco, sopravvivenza nel gruppo
di intervento del 50% senza deficit residui (1959)
Williams sopravvivenza nei soggetti trattati pari all’83% vs 25% dei
non trattati (1959)
Nonostante risultati promettenti gli esperimenti vennero sospesi per i
marcati effetti collaterali ed i problemi di gestione del paziente.
NEGLI ’80 SI RIACCENDE L’INTERESSE:
Studi sperimentali dimostrano benefici anche a
temperature meno estreme (ipotermia lieve/moderata
32-35°C),con effetti collaterali minori e meno gravi.
Progressi in terapia intensiva con aumentata capacità di
prevenire e/o trattare gli effetti collaterali.
Nel 2002 nel New England Journal of Medicine due
grandi studi clinici controllati e randomizzati sull’ipotermia
terapeutica in pazienti sopravvissuti ad arresto cardiaco.
Studi in animali neonati tra il 1998 ed il 2002 dimostrano
che una lieve ipotermia dopo insulti cerebrali si associa
ad un migliore outcome istologico e comportamentale.
Al momento le evidenze più importanti riguardano:
Encefalopatia postanossica, Trauma Cranico, Asfissia Perinatale.
PUNTI FERMI DELL’IPOTERMIA DI OGGI
La
temperatura cerebrale ottimale per la
neuroprotezione è compresa tra 32 e 34°C
Affinché
tale intervento produca benefici
massimi, il trattamento deve essere
immediato o precoce (entro 6 ore dall’insulto)
Un
trattamento prolungato, fino a 72 ore
appare essere migliore
L’impatto
neuroprotettivo dell’ipotermia è
maggiore nel danno neuronale moderato
rispetto al severo.
EFFETTI SISTEMICI DELL’IPOTERMIA
EFFETTI CARDIOVASCOLARI ED EMODINAMICI
Comuni variazioni di ECG
Rischio di aritmia con Temperature < 30°C
Nell’induzione aumento di gittata cardiaca e consumo miocardico di
ossigeno per incremento di adrenalina e noradrenalina
Successivamente diminuzione della F.C. per riduzione del metabolismo
con diminuzione del 25% della gittata cardiaca.
EFFETTI SULLA COAGULAZIONE
Riduzione conta e funzionalità piastrinica e alterazioni della cinetica
degli enzimi della cascata coagulativa.
INFEZIONI
Inibizione funzione chemotattica dei neutrofili, fagocitosi e rilascio di
citochine proinfiammatorie.
EFFETTI METABOLICI
Riduzione della sensibilità all’insulina e la sua secrezione
determinando iperglicemia
Lieve acidosi in conseguenza dell’aumento del metabolismo lipidico e
di chetoni e lattati.
METABOLISMO DEI FARMACI
Molti enzimi sono termosensibili e pertanto la clearance di alcuni
farmaci è ridotta in corso di ipotermia
E NEL NEONATO?
L’IPOTERMIA NEL NEONATO
Sinora sono stati pubblicati tre importanti
trials multicentrici randomizzati
sull’ipotermia per il trattamento della
encefalopatia neonatale, uno con ipotermia
cerebrale selettiva e due con ipotermia
generalizzata.
Gluckman PD Selective head cooling with mild systemic hypothermia after
neonatal encephalopathy: multicentre randomised trial. Lancet
2005;365:663-70.
Eicher DJ Moderate hypothermia in neonatal encephalopathy: efficacy
outcomes. Pediatr Neurol 2005;32:11-7.
Shankaran S. National Institute of Child Health and Human Development
Neonatal Research Network. Whole-body hypothermia for neonates with
hypoxic-ischemic encephalopathy. N Engl J Med. 2005;353:1574-84.
Il controllo della omeostasi termica è un dogma
irrinunciabile in TIN.
Raffreddare attivamente un neonato comporta
quindi un profondo cambiamento di pensiero e
della normale pratica assistenziale.
LA NOSTRA ESPERIENZA
PZ
SEX
EG
KG
INBORN
PH
BE
1°
5°
10°
1
F
38
2,84
NO
6,88
28
6
6
6
2
M
39
3,00
NO
7,10
15
0
5
8
3
M
40
3,88
NO
7,21
19
4
7
4
M
40
2,92
NO
6,79
18,3
2
5
5
M
37
3,13
SI
6,92
16,9
1
5
6
IDENTIFICAZIONE DEL NEONATO
EVIDENZA DI ASFISSIA PERINATALE
IDENTIFICAZIONE DEL NEONATO
EVIDENZA DI HIE MODERATA-SEVERA
IDENTIFICAZIONE DEL NEONATO
EEG PATOLOGICO
LA NOSTRA ESPERIENZA
PZ
ESITO
EEG
RMN
1
VIVO
Ipovoltato
Burst
RMN controllo
ABR
FOLLOW-UP
HIE corona
radiata
OK
Normale
Normale
OK
Normale
Suppression
2
VIVO
Ipovoltato
Monomorfo
3
VIVO
Ipovoltato
HIE grave
Netto
miglioramento
OK
Ritardo
motorio con
lieve
disorganizzazi
one in
trattamento
con
fisioterapia
ICH
ICH in
riassorbimento
SPB
Normale
OK
Normale
Burst
Suppression
4
VIVO
Burst
Suppression
Trombosi
SLS
5
VIVO
Burst
Suppression
Normale
SLS in
ricanalizzazione
IL CASO CLINICO
Neonato: E.G. 40 s, PC urgente asfissia perinatale, Apgar 4-7, rianimazione
All’ingesso: Proteina C-Reattiva (215 mg/dl, VN:< 8 mg/dl); (ALT 156 UI/ml,
VN:< 45 UI/mL); (AST 381 UI/mL, VN:< 45 UI/m); (Troponina 0.48 ng/
ml,VN:< 0.04 ng/ml)
Ecocardiografia: lieve ipertensione polmonare con rigurgito tricuspidale
(peak velocity 3.0 m/s) (PAP stimata di 41 mmHg rispetto ad una PA sistolica
di 87 mmHg)
EEG: Burst Suppression.
Trattamenti: ipotermia lieve, antibiotici ed Ossido Nitrico Inalatorio (iNO) a 20
ppm.
Dopo l’inizio del raffreddamento ipotensione trattata con espansione di
volume e Dopamina. Ipotensione di difficile trattamento peggiorata in terza
giornata al momento di effettuare il riscaldamento (41/17 mmHg, MAP 32
mmHg).
Dopamina sostituita con Adrenalina e Noradrenalina in infusione.
Ecocardiografia prima del riscaldamento: incremento del rigurgito tricuspide
(peak velocity 4.6 m/s) e PAP a livelli soprasistemici (PAP > 85 mmHg vs
PAS = 80 mmHg). Output ventricolare Sx e Dx (256 e 430 ml/kg/min,) e
flusso in VCS (55 ml/kg/min).
Incremento della richiesta di O2, iniziata HFOV ed incremento di iNO a 35
ppm.
Dopo riscaldamento ipotensione (51/23 mmHg, MAP 30 mmHg) ed oliguria
(0.7 ml/kg/h) non responsive all’espansione di volume ed alla Furosemide.
IL CASO CLINICO
Intrapreso trattamento con Terlipressina (TP) alla dose di 0.02 mg/kg
ogni 6 ore.
Dopo 10 minuti la Pressione Arteriosa è aumentata drammaticamente
(116/66 mmHg, MAP 79 mmHg) rimanendo stabile ai controlli
successivi. La diuresi è ripresa dopo circa 60 minuti. La richiesta di O2 è
rimasta elevata (FiO2 = 0.9), ma la SatO2 buona e stabile.
Il trattamento con TP è stato mantenuto per 12 ore (3 dosi).
La valutazione Ecocardiografica eseguita dopo 30 minuti dalla seconda
dose di TP ha evidenziato:
Rigurgito tricuspidale invariato (peak velocity 4.5 m/s)
Incremento Cardiac Output Sx e Dx (465 e 688 ml/kg/min)
Incremento flusso in Vena Cava Superiore (80 ml/kg/min)
Le condizioni cliniche sono migliorate e O2 ed iNO sospesi dopo 1
settimana.
Ecocardiografia alla dimissione (a 34 giorni di vita): buona funzione
biventricolare e completa scomparsa dei segni di ipertensione
polmonare.
Non sono stati registrati effetti avversi dopo l’uso di TP fatta eccezione
per un transitorio incremento delle AST (da 68 a 103 UI/ml), ALT (da 21
a 68 UI/ml) e della Troponina (da 1.04 a 2.27 ng/ml)
CASO CLINICO: DISCUSSIONE
L’ipotermia lieve generalizzata normalmente non causa gravi modificazioni
emodinamiche nella circolazione sistemica e polmonare.
Sepsi e asfissia possono compromettere la vasocostrizione termoregolatoria
determinando instabilità cardiovascolare durante il riscaldamento.
La TP è un analogo sintetico della Vasopressina a lunga emivita con una
elevata selettività per i recettori V1 presenti sulla muscolatura liscia vasale
ed è stata usata con successo in vari casi di ipotensione anche in pediatria.
Nel neonato l’esperienza con TP è scarsa e prevalentemente limitata al
trattamento dell’ipotensione nello shock settico, anche se vi è la descrizione
del suo utilizzo nell’Ipertensione Polmonare refrattaria associata ad Ernia
Diaframmatica Congenita e nell’Ipotermia Terapeutica, suggerendo effetti
vasodilatatori sul circolo polmonare.
Sia Vasopressina che Terlipressina sono state efficaci nel trattamento
dell’ipotensione da shock settico e nel ridurre la richiesta di Catecolammine.
Di particolare interesse è sapere se la TP eserciti un effetto vasodilatatorio
sul letto polmonare come è stato descritto per la Vasopressina.
CASO CLINICO : CONCLUSIONI
Paziente con Multiorgan System Failure secondaria ad asfissia
perinatale e sepsi
Severa ipotensione sistemica ed ipertensione polmonare non
responsive al trattamento.
L’Ecocardiografia dopo il secondo bolo di TP ha mostrato incremento
del 60% nell’output ventricolare e nessun cambiamento nel rigurgito
tricuspidale. Pertanto, poichè il flusso è proporzionale al gradiente
pressorio ed inversamente proporzionale alle resistenze, si può
affermare che, dato il rimanere costante della PAP e l’aumento
dell’output cardiaco, le resistenze polmonari sono diminuite di circa il
40%.
Il trattamento è stato ben tollerato anche se l’incremento dei valori di
Troponina sottolinea un rischio di vasocostrizione coronarica,
suggerendo che una infusione venosa a basse dosi sia preferibile in
presenza di trattamento con Catecolammine.
La nostra esperienza suggerisce che la TP possa essere utile nelle
alterazioni cardiocircolatorie complesse, come quella di questo caso,
in cui ha determinato risoluzione dello stato di shock ed un
miglioramento del flusso polmonare probabilmente mediante la
riduzione delle resistenze vascolari polmonari.







![Russo donazione organi e tessuti [modalità compatibilità]](http://s1.studylibit.com/store/data/005200047_1-6387be9468709a7d458463178816a744-300x300.png)