INIBIZIONE ENZIMATICA REVERSIBILE
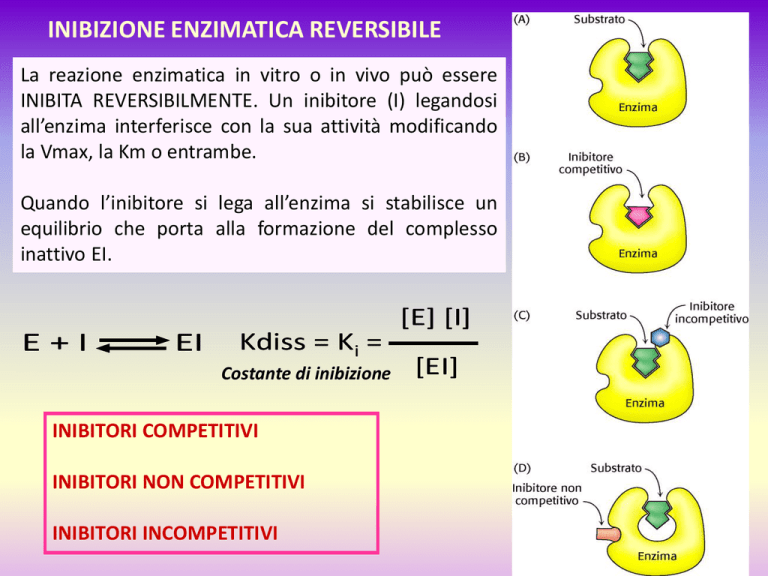
La reazione enzimatica in vitro o in vivo può essere
INIBITA REVERSIBILMENTE. Un inibitore (I) legandosi
all’enzima interferisce con la sua attività modificando
la Vmax, la Km o entrambe.
Quando l’inibitore si lega all’enzima si stabilisce un
equilibrio che porta alla formazione del complesso
inattivo EI.
E+I
EI
Kdiss = Ki =
Costante di inibizione
INIBITORI COMPETITIVI
INIBITORI NON COMPETITIVI
INIBITORI INCOMPETITIVI
[E] [I]
[EI]
INIBITORI COMPETITIVI
Competono con il substrato per il sito attivo.
Sono in genere analoghi strutturali del
substrato. Rimuovono l’enzima dal ciclo
catalitico naturale.
In presenza di Inibitore COMPETITIVO:
Aumenta
la
dissociazione
del
complesso ES e quindi aumenta la k-1
Km =
k-1
k1
v0 =
Km aumenta
(Kmapp)
Vmax [S]
Kmapp + [S]
k1
k-1
CONCENTRAZIONI
SATURANTI DI
SUBSTRATO
Vmax rimane inalterata,
In presenza di [S] saturanti
l’inibitore è scalzato dal sito
attivo.
v0 (μM/min)
Vmax inalterata
In presenza di
Inibitore competitivo
½ Vmax
Km aumenta
(Kmapp)
Km Kmapp1
1/ Vmax =invariato
mM
- 1/Km = diventa meno negativo
Assenza di I comp.
Inibizione competitiva: il trattamento con etanolo dell'avvelenamento
da metanolo
L’Etanolo è il più comune substrato dell’enzima: Alcool deidrogenasi (ADH), presente
nel fegato. Altri alcoli possono essere substrati di quest’enzima: per es. il METANOLO
ALCOOLDEIDROGENASI
Intossicazione da metanolo: è
trasformato in un prodotto
tossico che NON può essere
metabolizzato.
ALCOOLDEIDROGENASI
Può essere metabolizzata: non
è tossica per l’organismo e
viene convertita in acetato che
può essere utilizzato dal fegato
Nei casi di intossicazione da metanolo si può usare un eccesso di etanolo, che va a
competere per l’ADH e rimuove il metanolo dal sito attivo dell’enzima, consente
quindi la rimozione di METOH attraverso i reni.
INIBIZIONE DA PARTE DEL PRODOTTO DELLA REAZIONE
In alcuni casi, in reazioni irreversibili i prodotti della reazione
agiscono da INIBITORI COMPETITIVI REVERSIBILI dell’enzima che
catalizza la loro formazione.
(per es.: esochinasi, glucosio-6-fosfato fosfatasi)
ATP
glucosio
glucosio-6-fosfato
esochinasi
_
Pi
glucosio-6-fosfato
glucosio
glucosio-6-fosfato fosfatasi _
k1
k-1
IN. INCOMPETITIVI
Si legano all’enzima solo dopo che si è
già formato il complesso ES.
ES viene rimosso dal mezzo e quindi la Vmax
diminuisce (Vmax = k [ES] = k [E] )
2
2
tot
v0 (μM/min)
Vmax
A
B
Vmaxapp
½ Vmax
+ In. INCOMP
Kmapp
Se diminuisce [ES] tutto l’equilibrio si
sposta verso la formazione di ES e
quindi di ESI. Dunque, diminuisce anche
la Km. Apparentemente aumenta
l’affinità dell’enzima per il substrato
In presenza di In. INCOMP
aumenta la k1 e quindi:
Km =
Km
in assenza di Inibitori
[S] mM
k-1
k1
Km diminuisce
(Kmapp)
La Vmax è più bassa in presenza
di un inibitore incompetitivo
1/Vmax = aumenta
perché diminuisce Vmax
v0 (μM/min)
Vmax
1/V0
½ Vmax
Inibitore
assente
Vmaxapp
1/Vmax
+ In. INCOMP
- 1/Kmapp
KmappKm
[S] mM
- 1/Km
La Km è più bassa in presenza di
un inibitore incompetitivo
La pendenza della
retta è la stessa
INIBITORI NON COMPETITIVI PURI
Possono legarsi all’enzima libero oppure al complesso ES
Km
diminuisce
v0 (μM/min)
Km
aumenta
Vmax
A
B
Vmaxapp
+ In. NON COMP.
½ Vmax
½ Vmaxapp
Diminuisce la Vmax (perchè il
Complesso ES è sottratto dal mezzo).
La Km rimane invariata (con i NON-competitivi
PURI), perché l’inattivazione dell’enzima libero
(E →EI) e quella del complesso (ES →ESI)
avvengono con la stessa velocità.
Km
[S] mM
Diverse sostanze tossiche sono inibitori non competitivi di enzimi: METALLI PESANTI
(MERCURIO, PIOMBO) inibiscono numerosi enzimi agendo sui gruppi -SH di residui
di cisteina dell’enzima o di cofattori enzimatici.
puro
1/v0
1
Vmaxapp
1
Vmax
-1
Km
INIBIZIONE IRREVERSIBILE
Gli inibitori irreversibili si legano FORTEMENTE (in modo COVALENTE o NONCOVALENTE) all’enzima inattivandolo. Reagiscono con i gruppi funzionali del sito
attivo impedendo al substrato di accedervi o impedendo la sua trasformazione.
Analoghi dello stato di transizione
Bloccano enzimi con residui di Ser nel sito
attivo: Proteasi seriniche (chimotrispina…);
Esterasi a serina (Acetilcolinesterasi)
DFP
addotto inattivo
J. M. Berg et al., BIOCHIMICA, 7/E, Zanichelli editore S.p.A. Copyright © 2012
Es: composti organofosforici (DFP
(diisopropilfluorofosfato), Sarin..),
fisostigmina (alcaloide vegetale)
Sono composti con una struttura
tetraedrica intorno all’atomo di
fosforo che assomiglia allo stato
di transizione della reazione
catalizzata da tali enzimi.
Stabiliscono interazioni col sito
attivo che sono molto più forti di
quelle che si otterrebbero nel
complesso ES.
Sono molto selettivi. Hanno gruppi funzionali che si
Analoghi del substrato legano specificatamente e stabilmente con il sito di
legame per il substrato e che reagiscono con il sito
catalitico.
Es: TPCK (N-tosil-Lfenilalaninaclorometilchetone)
Blocca specificatamente la chimotripsina (proteasi a serina)
Sito attivo della
chimotripsina
Possiede un gruppo
fenilico che va a legarsi nel
sito di legame per il
substrato (tasca idrofobica
dell’enzima) e un atomo di
cloro che si trova nella
giusta posizione per
reagire con l’His-57 del sito
catalitico della
chimotripsina.
ADDOTTO
PERMANENTE
Molecole che si legano al sito attivo dell’enzima, dando inizio
al ciclo catalitico e quando iniziano ad essere trasformate
dall’enzima vi si associano stabilmente inattivandolo.
Es: SERPINE (SERine-Protease-INhibitors) = sono proteine che funzionano da inibitori
di proteasi a serina e ne regolano l’attività proteolitica, possono avere funzione di
difesa nei confronti di proteasi seriniche esogene, hanno un ruolo protettivo nei
processi infiammatori.
Inibitori suicidi
TRIPSINA (PROTEASI A SERINA)
ALFA 1ANTITRIPSINA
(SERPINA)
Si inseriscono nel sito attivo della proteasi
con un’ansa chiamata RCL (= Loop del
centro reattivo).
LA SERPINA VIENE TAGLIATA DALLA
TRIPSINA E UN FRAMMENTO DI SERPINA
RIMANE LEGATO ALL’ENZIMA.
Questo frammento di serpina
subisce un cambiamento
conformazionale e si forma un
complesso proteasi/serpina
inscindibile
MECCANISMI DI CATALISI
Ogni enzima ha un suo specifico meccanismo catalitico ma spesso
più meccanismi si integrano:
1) CATALISI PER EFFETTO DI PROSSIMITA’ E ORIENTAMENTO
2) CATALISI DA LEGAME PREFERENZIALE PER LO STATO DI TRANSIZIONE
3) CATALISI ACIDO-BASE
4) CATALISI COVALENTE
5) CATALISI MEDIANTE IONI METALLICI
I primi due meccanismi sono comuni a tutti gli enzimi
CATALISI favorita dalla PROSSIMITA’ e dall’ORIENTAMENTO:
1) Gli enzimi bloccando il substrato nel sito di legame aumentano la
prossimità dei gruppi funzionali che devono reagire (è come se
aumentassimo la concentrazione dei reagenti nel sito attivo)
2) diminuisce la libertà di movimento e quindi l’entropia dei reagenti,
l’energia necessaria a compensare questo aumento di ordine del sistema
è fornita dalla formazione di legami fra il sito attivo dell’enzima e il
substrato.
CATALISI favorita dal LEGAME PREFERENZIALE PER LO STATO DI
TRANSIZIONE
il sito attivo dell’enzima si adatta perfettamente al substrato quando
viene raggiunto lo stato di transizione:
la complementarietà abbassa la ΔG‡ e accelera la trasformazione
CATALISI ACIDO-BASE
Trasferimento di ioni H+ o OH- dal o al substrato
e comporta la rottura di legami
Favorisce quelle reazioni in cui si forma un intermedio carico instabile
Specifica: quando l’accettore o il donatore di ioni H+ o OH- è l’H2O
Generale: quando sono coinvolte
le catene laterali ionizzabili
di residui amminoacidici del sito
Catalitico. I pKa di tali residui
possono variare molto rispetto
a quelli dei singoli amminoacidi
in soluzione.
CATALISI
COVALENTE
Comporta la formazione di intermedi in cui il substrato è legato
covalentemente con un residuo amminoacidico del sito attivo
dell’enzima.
La catena laterale reattiva dell’enzima può comportarsi sia da nucleofilo che da elettrofilo. La
più comune è la catalisi nucleofila (un gruppo funzionale dell’enzima si comporta da
nucleofilo):
Enz-R-O—
S
Enz-R-O-S
H2O
Enz-R-OH + P
CATALISI TRAMITE IONI METALLICI
quando nel sito attivo sono presenti ioni metallici che servono a:
• stabilizzare lo stato di transizione
• proteggere cariche negative (Mg2+ nelle chinasi scherma le cariche
negative dell’ATP e facilita l’attacco nucleofilo del substrato al fosforo)
• orientare il substrato
• partecipare a reazioni di ossido-riduzione
METALLO-ENZIMI: metallo di transizione legato fortemente all’enzima (Fe,
Cu, Mn, Zn, Co)
ENZIMI ATTIVATI DA METALLI: legano debolmente un metallo alcalino o
alcalino-terroso