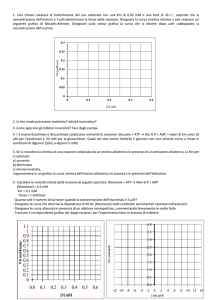
ZIMOGENI
MODULAZIONE COVALENTE MEDIANTE TAGLIO PROTEOLITICO
Enzimi prodotti in forma inattiva che vengono attivati solo dopo aver subito un taglio
proteolitico che avviene solo nel momento e nella sede opportuni
Cascata di attivazione delle proteasi pancreatiche
Prodotta dalla mucosa
del duodeno
attiva
attiva
attiva
attiva
attiva
MODULAZIONE ALLOSTERICA NON-COVALENTE
Enzimi allosterici: attività catalitica influenzata da cambiamenti strutturali
Aggiungendo ancora
substrato:
transizione T > R
completa
1) Hanno più subunità e più siti
attivi per il substrato
2) Legano le molecole di substrato
in modo cooperativo
3) Subiscono una transizione dallo
stato T allo stato R
4) NON seguono la cinetica di
Michaelis-Menten
Assenza di substrato
Enzima
stato T
meno affine
[S] aumenta: Il legame con le prime molecole di S
induce cambiamenti conformazionali che convertono
in modo cooperativo le subunità dell’enzima dallo
stato T allo stato R
Substrato = modulatore omotropico positivo dell’enzima
Gli enzimi allosterici possono essere
regolati controllando la concentrazione di
substrato
S
ET
Il substrato influenza l’equilibrio fra stato
a bassa affinità e stato ad alta affinità.
L’affinità dell’enzima per il
substrato è data dalla K0.5
E RS
S
Vmax
[S] che permette di raggiungere
metà della Velocità massima di
reazione
Equazione cinetica:
v0 =
Vmax [S]n
K0.5n + [S]n
K0.5
Regolazione eteroallosterica
MODULATORI ALLOSTERICI POSITIVI (ATTIVATORI)
MODULARORI ALLOSTERICI NEGATIVI (INIBITORI)
Possono modificare la K0,5 o la Vmax o entrambe
Cambia la K0,5 ma non la Vmax
+ attivatore
Cambia la Vmax ma non la K0,5
+ attivatore
+ inibitore
+ inibitore
Modulatori eteroallosterici
1) Si legano in siti diversi dal sito attivo = SITI REGOLATORI.
2) Il legame con il modulatore altera la struttura dell’enzima che nella nuova
conformazione ha proprietà cinetiche differenti.
3) Il legame modulatore/enzima è sempre NON-covalente e reversibile.
4) Un inibitore allosterico favorisce
la forma dell’enzima con minore
affinità per il substrato
stabilizzandola.
5) Un attivatore allosterico
favorisce la forma R dell’enzima
rendendola molto più affine al
substrato
Sito
catalitico
Sito
regolatore
substrato
Attivatore
Enzima Stato T
inattivo
Legame con attivatore
Enzima Stato R
Complesso Enzima
attivo-substrato
Segnale extracellulare trasdotto attraverso la
membrana plasmatica attiva l’adenilato ciclasi.
PPi
ATP
Adenilato ciclasi
AMP ciclico
(5’3’-adenosina-monofosfato)
Attivatore allosterico della PKA (proteinachinasi A, fosforila varie proteine target)
PKA: 2 domini REGOLATORI (ciascuno con 2 siti di legame per il cAMP)
2 domini CATALITICI
PKA attiva
PKA inattiva
PKA attiva
Berg et al., BIOCHIMICA 6/E, zanichelli editore S.p.A. Copyright © 2007
La modulazione di un enzima allosterico è
utilizzata nel meccanismo della
RETROINIBIZIONE (inibizione a feed back)
In un processo metabolico multistep il primo
enzima della via è un enzima allosterico che viene
inibito allostericamente dal prodotto che si
ottiene nell’ultima reazione della via.
Sintesi di Isoleucina a partire da Treonina:
processo in 5 reazioni.
La prima è catalizzata dalla treonina deidratasi
che è inibita allostericamente dalla Isoleucina