ENZIMI
Gli enzimi sono i catalizzatori dei processi biologici.
Possono essere proteine globulari oppure acidi
nucleici (ribozimi)
Sono in grado di aumentare la velocità dei processi
catalizzati fino a 1015 volte.
Sono molto specifici per un particolare substrato o
classe di substrati
SPECIFICITA’
• assoluta (un solo substrato)
• di gruppo (catalizza la reazione di uno specifico gruppo
funzionale)
• di legame (catalizza la formazione o rottura di un solo tipo
di legame, es. peptidico)
• stereochimica (distingue un enantiomero dall’altro di una
stessa molecola)
MODELLO DELL’ ADATTAMENTO INDOTTO
Il sito attivo non è rigido e
perfettamente complementare alla
forma del substrato (modello
chiave-serratura), il che renderebbe
energeticamente non conveniente la
trasformazione del substrato, ma
viene modificato dall’interazione
con il substrato.
OSSIDOREDUTTASI
reazioni di ossidoriduzione
TRANSFERASI
reazioni di trasferimento di gruppi
funzionali
reazioni di idrolisi
IDROLASI
LIASI
reazioni di rottura di legami
attraverso processi diversi da
ossidazione e idrolisi
ISOMERASI
reazioni di isomerizzazione
LIGASI (SINTETASI)
reazioni di formazione o rottura
di legami C-C, C-S, C-O, C-N.
Un enzima (oloenzima) è costituito dalla parte proteica (apoenzima) e
da cofattori organici (coenzimi) o inorganici (ioni metallici).
Il substrato S si lega al sito attivo dell’enzima formando un complesso
ES, che poi reagisce:
E+S
ES
ES
L’enzima, in quanto catalizzatore, agisce
facendo avvenire il processo per una via con
energia di attivazione più bassa. Nessun
enzima può catalizzare una reazione non
spontanea, ne’ far formare più prodotto di
quanto previsto dalla costante d’equilibrio.
EP
E+P
EFFETTO DELLA TEMPERATURA E DEL pH SULL’ATTIVITA’ DI UN ENZIMA
Perché l’enzima agisca, occorre che si trovi nella conformazione corretta. Tale
conformazione è stabile entro un certo intervallo di temperatura e di pH.
DIPENDENZA DELLA VELOCITA’ DALLA CONCENTRAZIONE DEL SUBSTRATO
SATURAZIONE del sito attivo
dell’enzima
CINETICA ENZIMATICA
E+S
k1
k-1
ES
k2
E+P
v0 = k2 [ES]
[Etot] = [E] + [ES]
La velocità di formazione del complesso ES è data da
mentre la sua velocità di decomposizione risulta da
vform = k1 [E] [S]
vdiss = k-1 [ES] + k2 [ES]
Ipotesi dello stato stazionario: a regime si può supporre [ES] = costante, ossia vform = vdiss.
In tal caso:
k1 [E] [S] = (k-1 + k2) [ES]
k1 [E] [S] = (k-1 + k2) [ES]
ma [Etot] = [E] + [ES] e quindi sostituendo [E] = [Etot] – [ES]
k1 [S] ([Etot] – [ES]) = (k-1 + k2) [ES]
da cui si può ricavare [ES] che risulta:
[ ]
[ES] = k + k
−1
2
k1
Il termine
k−1 + k2
k1
[ ]
= KM è detto COSTANTE DI MICHAELIS-MENTEN, e rappresenta
l’affinità dell’enzima per il suo substrato
e dato che, come si era detto, v0 = k2 [ES], si ha che
[Etot] [S]
v0 = k2
KM + [S]
Quando [Etot] = [ES] l’enzima è saturo
(non è presente enzima libero) e
quindi v = vmax. Se ne ricava
l’EQUAZIONE DI MICHAELIS-MENTEN:
vmax [S]
v0 =
KM + [S]
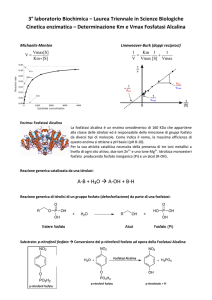
EQUAZIONE DEI DOPPI RECIPROCI O DI LINEWEAVER-BURK
vmax [S]
v0 =
KM + [S]
=
PENDENZA
INTERCETTA
INTERCETTA
[ ]
[ ]
=
[ ]
=
[ ]
[ ]
+
[ ]
+
ENZIMI ALLOSTERICI
Sono enzimi che hanno più di un sito di legame. Legandosi a piccole molecole dette
effettori, questi enzimi cambiano la loro conformazione diventando più attivi
(allosterismo positivo) oppure inattivi (allosterismo negativo) rispetto alla reazione che
devono catalizzare. Il secondo caso comprende l’inibizione a feedback, in cui una via
metabolica come la seguente:
ABCDEF
dove ogni passaggio è catalizzato da un diverso enzima, può essere soppressa quando la
cellula disponga di una sufficiente quantità del prodotto F. Tale prodotto costituisce
infatti un effettore negativo per l’enzima che catalizza la prima reazione, A B. In tal
modo si evita di sprecare risorse per produrre un metabolita non necessario. Quando la
concentrazione di F diminuisce, questo si dissocia dal sito di legame sull’enzima
riattivando la via metabolica.
INIBIZIONE
REVERSIBILE
IRREVERSIBILE
INIBIZIONE REVERSIBILE
COMPETITIVA
ACOMPETITIVA
NON COMPETITIVA
INIBIZIONE REVERSIBILE COMPETITIVA
L’inibitore è un analogo strutturale del substrato
L’inibizione dipende dalla concentrazione relativa di S e di I
Quindi vmax resta costante (basta che ci sia abbastanza S da saturare l’enzima)
mentre KM aumenta (aumenta il valore di [S] per il quale v = ½ vmax.)
INIBIZIONE REVERSIBILE ACOMPETITIVA
L’inibitore si lega al complesso substratoenzima rendendolo inattivo.
vmax diminuisce, dato che [ES] < [ETOT]
KM diminuisce, in quanto l’equilibrio di
formazione di ES viene spostato a destra
dalla sottrazione di ES per reazione con I
INIBIZIONE REVERSIBILE NON COMPETITIVA O MISTA
nell’inibizione mista l’inibitore si può legare
sia a E, formando EI, sia a ES, formando ESI.
vmax diminuisce mentre KM resta uguale.