GLI ATOMI
Particelle Subatomiche
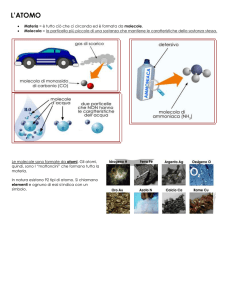
ELEMENTI
• I diversi atomi sono caratterizzati da un
diverso numero di protoni e neutroni; il
numero di elettroni è sempre uguale al
numero dei protoni (negli atomi neutri)
• Gli elementi si identificano con un simbolo.
ELEMENTI
• Il numero di elettroni (o di protoni) viene
detto numero atomico e si indica con Z
• Il numero dei protoni più i neutroni viene
detto numero di massa e si indica con A
Isotopi
Atomi dello stesso elemento che contengono un
diverso numero di neutroni si dicono isotopi.
Abbondanza naturale
N atomi isotopo
100 atomi elemento
Isotopi
Peso atomico
Peso atomico = Massa media
Massa A x Abb. Nat. A + Massa B x Abb. Nat. B
100
Unità di Massa Atomica
1atomo 12 C 1.9926 x 1023 g
Massa
1uma
12
12
C
1.9926 x 1023 g
1uma
1.6605 x 10- 24 g
12
Esempio
35Cl
(75.8%) = 34.97 uma
Peso atomico =
37Cl
(24.2%)= 36.97 uma
Massa A x Abb. Nat. A + Massa B x Abb. Nat. B
100
Peso atomico (Cl)
34.97 uma x 75.8 + 36.97 uma x 24.2
= 35.454 uma
100
La struttura
dell’atomo
L’atomo
• L’atomo è costituito da un nucleo compatto
contenente protoni e neutroni circondato da un
numero di elettroni equivalente al numero di
protoni (l’atomo è neutro) disposti in uno spazio
molto grande.
• Essi sono in perenne movimento intorno al nucleo
ed a causa delle loro piccole dimensioni (principio
di indeterminazione di Heisemberg) è impossibile
conoscere nel medesimo istante sia la posizione
che la velocità di ognuno di essi.
L’ATOMO
Nucleo, formato da
protoni e neutroni
Guscio di elettroni
in movimento
ModelliAtomici.mov
Atomo.mov
NUCLEO
Protoni
Neutroni
mp
mn
Elettroni
me
mp : mn : me 1 : 1 : 0,00054
Equazione di Schrödinger
• Ognuno di questi elettroni è però caratterizzato
da uno stato di energia che viene detto stato
stazionario che può essere descritto per mezzo
dell’equazione generale usata per descrivere il
moto di un'onda.
• Tale equazione d’onda (equazione di Schrödinger)
che descrive lo stato dell’elettrone (stato
stazionario) contiene 4 parametri e può essere
risolta solamente quando tali parametri
fondamentali, detti numeri quantici,
assumono determinati valori.
y(n, l, m)
Numeri quantici
y(n, l, m, ms)
n = 1, 2, 3, 4, 5, .........,
Numero quantico principale
l = 0 (n - 1)
Numero quantico angolare
m = -l +l
Numero quantico magnetico
ms = 1/2
Numero quantico di spin
• Uno studioso, Pauli, enunciò un principio che limita la
variazione dei numeri quantici nella descrizione dello
stato degli elettroni.
• Tale principio detto principio di esclusione di Pauli dice
che considerato un atomo polielettronico, non possono
esistere nello stesso atomo, elettroni che abbiano la
Quanti.avi
stessa quaterna di numeri quantici.
ElectronOrbits.exe
AtomoDiBohr.avi
Stato Stazionario
• Le funzioni d’onda definite da tali parametri,
descrivono lo stato di energia che può assumere un
elettrone in un atomo e quindi la distribuzione
spaziale della sua carica elettrica;
• Tale stato di energia può variare solo per
assorbimento o emissione di quantità discrete di
energia in quanto l’elettrone può trovarsi
solamente in determinati stati di energia descritti
da determinate funzioni d’onda.
Orbitale
• Il quadrato di ognuna di queste funzioni
d’onda viene detto orbitale e descrive la
delocalizzazione, e cioè la probabilità che
l’elettrone si trovi in una determinata
posizione intorno al nucleo
• Ad essa è quindi associata una forma
caratteristica che descrive lo spazio nel
quale si ha una determinata probabilità di
trovare un dato elettrone.
Rappresentazione Orbitali
|y|2 in funzione di r
•
Un modo di descrivere graficamente un orbitale, e quindi la probabilità di trovare un
elettrone in una determinata porzione di spazio, è quella di rappresentarlo con delle
nubi di probabilità o di densità elettronica, dove ad una maggiore probabilità
corrisponde una maggiore densità di puntinatura. Bisogna però tenere presente che
poiché lo spazio in cui può trovarsi un elettrone è infinito, le nubi dovrebbero essere
estese fino all'infinito. Per convenzione, si usa quindi tracciare il limite di ciascuna
nube facendo in modo che il volume di spazio da essa definito contenga il 95% della
densità di carica elettronica: in questo modo avremo una probabilità del 95% di
trovare l'elettrone all'interno della nube elettronica rappresentata.
Funzione d’onda
• Ogni orbitale viene quindi descritto da una
funzione d'onda che viene rappresentata
con il simbolo ψ(n, l, m) e che contiene i
primi tre numeri quantici n, l, m.
• Tali parametri descrivono rispettivamente
la grandezza (n), la forma (l) e
l’orientamento nello spazio (m) dell’orbitale
descritto da un determinato elettrone.
Momento di spin
• Il numero quantico ms non ha invece
influenza sullo spazio occupato
dall’elettrone (l’orbitale) ma si riferisce
solamente al movimento dell’elettrone
intorno a se stesso ed indica il
verso di rotazione.
ElectronSpin.exe
Livelli
• Per designare l'insieme
degli orbitali che hanno lo
stesso valore di n si usa il
termine livello elettronico
o livello energetico,
mentre orbitali aventi la
stessa n e la stessa l si
dicono dello stesso
sottolivello.
Livelli
• Ad ogni numero l corrispondono
orbitali con una determinata forma
che vengono contraddistinti con una
determinata lettera:
• se l = 0 abbiamo orbitali s,
• se l = 1 abbiamo orbitali p,
• se l = 2 abbiamo orbitali d,
• se l = 3 abbiamo orbitali f.
• Per quanto riguarda il numero
quantico m, esso invece descrive la
diversa orientazione degli orbitali di
uno stesso sotto livello: i tre orbitali
2p (n = 2, l = 1, m = -1, 0, +1) ad
esempio sono orientati
rispettivamente lungo i tre assi
cartesiani.
ORBITALI s
Orbitale-s.mov
Orbitale1s.mov
Orbitale2s.mov
Orbitale3s.mov
ORBITALI p
p-OrbitalDiagram.exe
Orbitali2Periodo.mov
ORBITALI p
Orbitals.dir(Flash)
ORBITALI d
Orbitali3Periodo.mov
ORBITALI f
Configurazione atomica
• Ogni atomo è formato da un nucleo, contenente
protoni e neutroni circondato dagli elettroni che si
muovono descrivendo gli orbitali.
• Ognuno di questi orbitali è definito da tre numeri
quantici e per il principio di esclusione di Pauli non
può essere “riempito” da più di due elettroni che
abbiano diverso numero di spin
• Un orbitale può quindi essere:
– non occupato (non esistente),
– monoccupato (formato da un elettrone)
– completamente occupato (formato da due elettroni).
Il verbo “riempire” è usato al posto di “descrivere” per rendere più “reale” la visualizzazione degli orbitali
Energia Relativa Orbitali
• Abbiamo visto che l'energia di un orbitale dipende dal valore
dei numeri quantici n ed l; in quanto gli orbitali aventi la
stessa n e la stessa l sono degeneri in assenza di campo
magnetico.
• Bisogna però considerare che negli atomi polielettronici, tale
energia dipende anche dalla carica nucleare dell'atomo che
andiamo a considerare. Infatti gli elettroni sono sottoposti
ad una forza elettrostatica da parte dei protoni del nucleo,
ma tale forza non è effettivamente proporzionale alla carica
nucleare in quanto viene deschermata dagli elettroni che si
trovano nei livelli energetici più interni; ciò fa si che in ogni
atomo gli orbitali hanno una determinata energia
proporzionale a n, a l e in misura molto piccola alla carica
nucleare effettiva (che tiene conto della schermatura degli
elettroni).
E
5s
4s
3s
2s
1s
5p
4p
3p
2p
5d
4d
3d
5f
4f
Livelli energetici o gusci
Configurazione
fondamentale dell’atomo
• Ora, sulla base delle considerazioni appena fatte,
andiamo a vedere come possiamo stabilire la
configurazione fondamentale di un atomo; tale
configurazione viene determinata in base alle
seguenti regole:
– gli elettroni “riempiono” prima gli orbitali disponibili ad
energia minore.
– ogni orbitale non può essere “riempito” da più di due
elettroni e tali elettroni devono avere spin opposto
(Principio di Pauli).
– se gli elettroni possono “riempire” orbitali degeneri (alla
stessa energia), essi “riempiono” il massimo numero di
orbitali disponibili e ruotano con spin parallelo (Regola di
Hund).
Il verbo “riempire” è usato al posto di “descrivere” per rendere più “reale” la visualizzazione degli orbitali
Configurazione
fondamentale dell’atomo
• Costruendo in questo modo gli atomi dei diversi
elementi si vede che man mano che aggiungiamo
elettroni si ha il “riempimento” successivo degli
orbitali appartenenti ai vari livelli elettronici
contraddistinti da una determinata n.
• Considerando tali livelli come dei gusci ad energia
simile, possiamo dire che nel primo guscio (n = 1, l =
0) possono “stare” 2 elettroni, nel secondo (n = 2, l
= 0, 1) otto elettroni, nel terzo (n = 3, l = 0, 1)
ancora otto perché n = 3, l = 2, fa parte del livello
4 in quanto ha una energia maggiore di n = 4, l = 0,
mentre nei livelli successivi cominciamo ad avere
un numero maggiore di elettroni.
Il verbo “riempire” è usato al posto di “descrivere” per rendere più “reale” la visualizzazione degli orbitali
Ordine di Riempimento
1s
ConfigurazioneElettronica.MOV
2s
DentroL'Atomo.AVI
2p
ALLUMINIO
ALLUMINIO (Al)
3p
3s
2p
2s
1s
Z =13
ARGENTO
ARGENTO (Ag)
Z = 47
5p
4d
5s
4p
3d
4s
3p
3s
2p
2s
1s
Configurazione elettronica
degli elementi