L’ATOMO
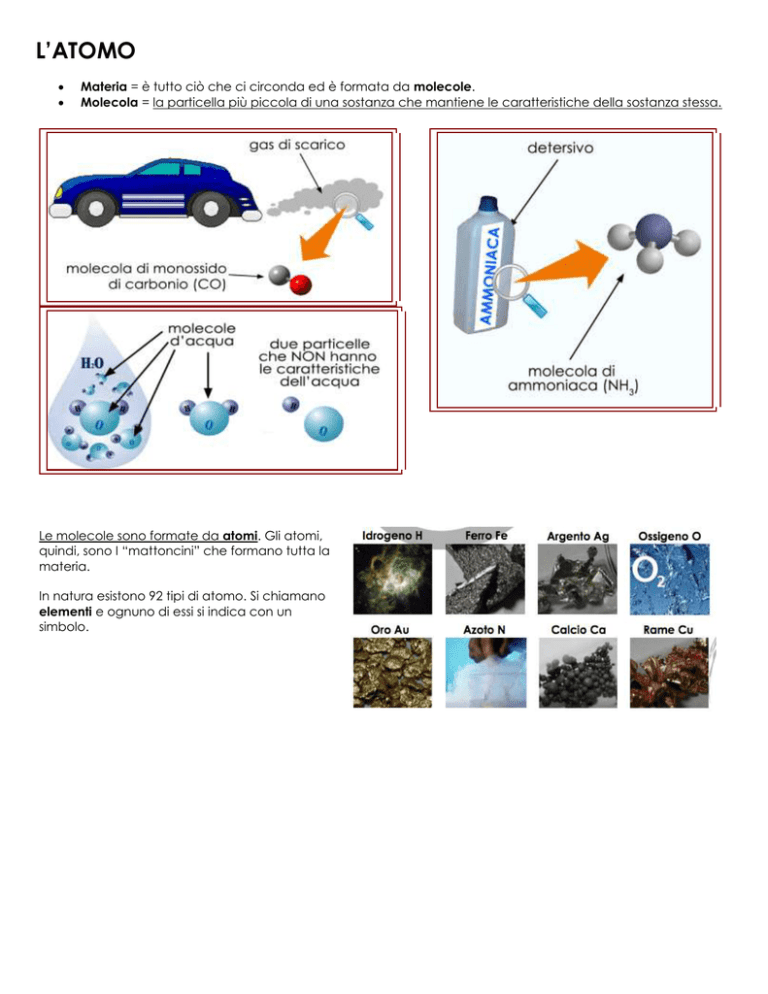
Materia = è tutto ciò che ci circonda ed è formata da molecole.
Molecola = la particella più piccola di una sostanza che mantiene le caratteristiche della sostanza stessa.
Le molecole sono formate da atomi. Gli atomi,
quindi, sono I “mattoncini” che formano tutta la
materia.
In natura esistono 92 tipi di atomo. Si chiamano
elementi e ognuno di essi si indica con un
simbolo.
Com'è fatto l'atomo? Un po' di storia...
I Greci pensavano che l’atomo fosse “indivisibile”, per questo gli diedero questo nome.
La parola “atomo” deriva infatti dal greco “ἄτομος” (àtomos), che significa “indivisibile”.
Ma già nel XVIII secolo si scoprì che l’atomo è formato da particelle più piccole:
Gli ELETTRONI
I PROTONI
Particelle piccole che si respingono tra loro.
Queste particelle sono elettricamente cariche: la loro
Particelle più grandi degli elettroni e da cui gli elettroni
sono attratti.
carica fu detta negativa.
Per questo la loro carica fu detta positiva.
Modello di Thomson (a panettone)
La prima ipotesi su come fosse fatto l’atomo fu fatta alla fine del XIX secolo da Thomson.
Egli paragonò l’atomo a un “panettone”.
Esperimento di Rutherford
In seguito Rutherford utilizzò i raggi alfa (raggi di particelle positive) per fare un esperimento: li utilizzò per
bombardare una lamina d’oro sottilissima.
Osservò che:
la maggior parte delle particelle attraversava la lamina senza essere deviata
alcune particelle cambiavano di poco la loro traiettoria
poche particelle rimbalzavano indietro
Rutherford concluse che:
Siccome la maggior parte delle particelle alfa non veniva deviata, ALLORA l’atomo doveva essere
formato principalmente da spazi vuoti.
Poiché alcune particelle rimbalzano o vengono deviate, devono aver “sbattuto” contro agglomerati di
particelle cariche positivamente: li chiamò nucleo.
poiché la materia nel complesso è neutra, le cariche negative dovevano essere piccolissime
Il modello planetario
Venne introdotto così il modello planetario, dove l’atomo è pensato come il
sistema solare: i protoni stanno al centro (nel nucleo) e gli elettroni girano
intorno al nucleo su orbite ben definite.
Ogni orbita rappresenta un livello energetico: più ci si allontana dal nucleo,
maggiore è l'energia degli elettroni.
Presto, inoltre, si scoprì che nel nucleo non ci sono solo i protoni (carichi
positivamente), ma anche i neutroni (particelle senza carica).
Osservazioni:
siccome la materia, e quindi l'atomo, sono neutri, il numero dei protoni è uguale al numero degli elettroni.
Questo numero si chiama “numero atomico”.
Il numero atomico determina il tipo di elemento chimico e tutte le sue proprietà. (Es: l'idrogeno ha numero
atomico 1, l'elio ha numero atomico 2, l'ossigeno ha numero atomico 8, …)
I neutroni sono di dimensioni simili ai protoni.
Neutroni e protoni definiscono il numero di massa.
Il numero dei neutroni, invece, non è fisso. Atomi di uno stesso elemento possono avere un diverso numero di
neutroni.
Atomi di uno stesso elemento con un diverso numero di neutroni si chiamano isotopi.
Il modello a orbitali
Gli elettroni girano intorno al nucleo in "gusci energetici", chiamati orbitali. Gli orbitali rappresentano la zona dove
è più probabile che si trovi l'elettrone.
Anche in questo caso ci sono i livelli energetici, più ci si allontana dal nucleo, maggiore è l'energia degli elettroni.
In ogni livello ci sono da 1 a 4 tipi di orbitali.
Al 1° livello c'è un orbitale s
Al 2° livello c'è un orbitale s e tre orbitali p
Al 3° livello c'è un orbitale s, tre orbitali p e cinque orbitali d
Dal 4° livello in poi c'è un orbitale s, tre orbitali p, cinque orbitali d e sette orbitali f.












