DISPENSE DI BIOCHIMICA CLINICA
PROF.SSA ELENA ZOCCHI
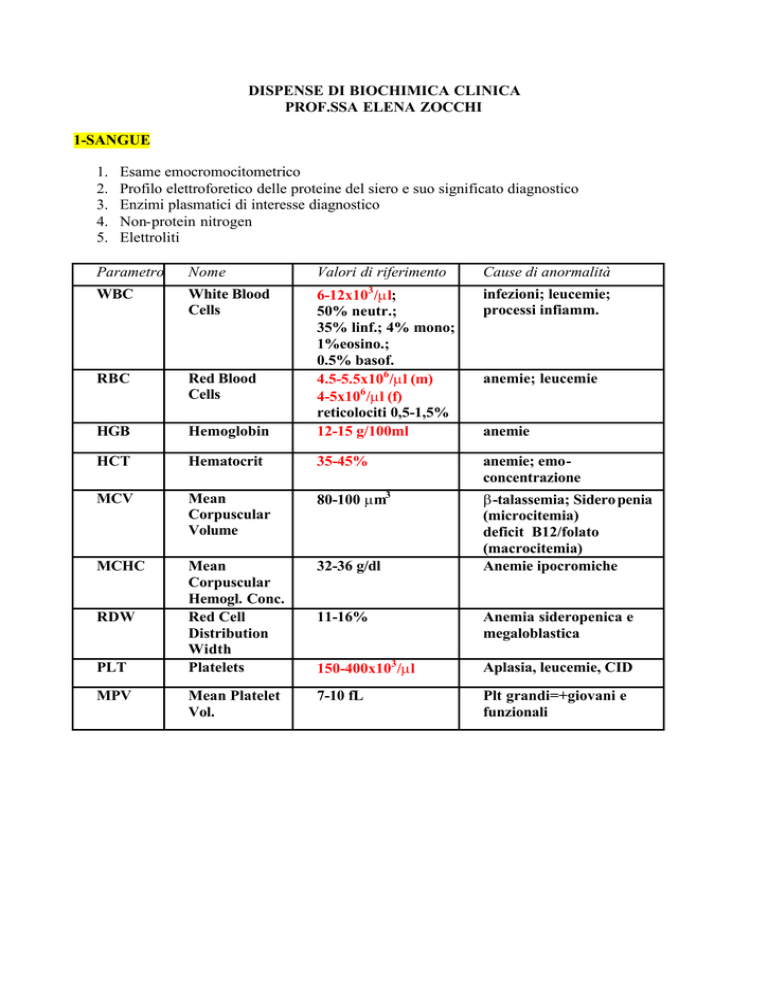
1-SANGUE
1.
2.
3.
4.
5.
Esame emocromocitometrico
Profilo elettroforetico delle proteine del siero e suo significato diagnostico
Enzimi plasmatici di interesse diagnostico
Non-protein nitrogen
Elettroliti
Parametro
Nome
Valori di riferimento
Cause di anormalità
WBC
White Blood
Cells
infezioni; leucemie;
processi infiamm.
RBC
Red Blood
Cells
HGB
Hemoglobin
6-12x103 /µl;
50% neutr.;
35% linf.; 4% mono;
1%eosino.;
0.5% basof.
4.5-5.5x106 /µl (m)
4-5x106 /µl (f)
reticolociti 0,5-1,5%
12-15 g/100ml
HCT
Hematocrit
35-45%
anemie; emoconcentrazione
MCV
Mean
Corpuscular
Volume
80-100 µm3
MCHC
Mean
Corpuscular
Hemogl. Conc.
Red Cell
Distribution
Width
Platelets
32-36 g/dl
β-talassemia; Sidero penia
(microcitemia)
deficit B12/folato
(macrocitemia)
Anemie ipocromiche
Mean Platelet
Vol.
RDW
PLT
MPV
anemie; leucemie
anemie
11-16%
Anemia sideropenica e
megaloblastica
150-400x103 /µl
Aplasia, leucemie, CID
7-10 fL
Plt grandi=+giovani e
funzionali
Elettroforesi pro teine del siero
Proteine tot. siero: 6,5-8,3 g/dL
Migrazione
Proteine
Funzione
Pre-albumina
Pre-albumina
Indicatore nutrizionale
Lega retinolo e ormoni tiroidei
Albumina
Albumina
α1-globuline
α1-antitripsina (90% del
totale!)
Maggiore contributo alla pressione
oncotica (3,5-5g/100ml)
Trasporta bilirubina, steroidi, ac.grassi,
farmaci…
Inibitore proteasi. Aumenta
nell’infiammaz.; deficit congenito
causa cirrosi e enfisema giovanili
α2-globuline
β-globuline
α1-lipoproteine (HDL)
Trasporto lipidi (colesterolo)
α1-antichimotripsina
Inibisce serin-proteasi. Aumenta
nell’infiammaz.
α1-glicoproteina acida
Fase acuta infiammaz.
Aptoglobine
Legano emoglobina. Aumentano
nell’infiammaz.
Ceruloplasmina
Inibitore perossidasi
α2-macroglobulina
Inibitore trombina, pepsina, tripsina.
Aumenta nella nefrosi.
Pre-β lipoproteine (VLDL) Trasporto lipidi (trigliceridi)
Transferrina
Trasporto ferro. Aumenta nell’anemia
sideropenica.
Emopexina
Lega l’eme. Diminuisce nelle anemie
emolitiche.
β-lipoproteine (LDL)
Trasporto lipidi (colesterolo)
β2-microglobulina
Componente antigene HLA I.
Aumenta nell’infiammaz. e diminuita
clearance renale
fibrinogeno
Precursore fibrina
Complemento (C1,3,4)
Risposta immune. Aumenta
nell’infiammaz.
Proteina C reattiva (CRP) Norm. assente, compare in fase acuta
infiammaz. Opsonizza batteri e funghi,
chemoattrattore.
γ-globuline
Ig G-A-M-D-E
Alcuni profili elettroforetici tipici:
Anticorpi. Picco monoclonale nel
mieloma. Aumento policlonale nelle
infezioni/infiammaz. croniche
Principali enzimi di interesse diagnostico presenti nel siero
Enzima
Fosfatasi acida (ACP)
pH 5
Patologia
Carcinoma prostatico (ACP
tartrato-sensibile)
Valori di riferimento
2.5-12 U/L (m) 0.2-5 T.S.
0.3-9 U/L (f)
Alanina transaminasi (ALT Danno epatocellulare
o GPT)
(+ specif. della AST)
enzima citosolico
5-35 U/L
Fosfatasi alcalina (ALP)
pH 9-10
Danno epatobiliare
ostruttivo, danno osseo
(riparaz. fratture,
accrescimento,
osteosarcoma)
30-90 U/L
Amilasi (AMS)
Pancreatite acuta; parotite
90-280 U/L
Aspartico transaminasi
(AST o GOT)
Danno epatocellulare o
muscolare (cardiaco!);
enzima mitocondriale
5-35 U/L
AST/ALT<1 epatite acuta
AST/ALT>1 cirrosi (alcolica)
Creatina cinasi (CK)
Isoenzimi: CK-MM, -MB,
BB
Danno muscolare (trauma,
15-160 U/L
distrofia)/miocardio/cerebrale
γ-glutamil transferasi
(γ-GT)
Patologie epatobiliari
ostruttive; alcolismo;
pancreatite
5-30 U/L
Lattico deidrogenasi (LDH) Infarto miocardio, danno
epatocellulare, carcinoma
Isoenzimi: LDH-1 → 5
L → P 100-225 U/L
P → L 80-280 U/L
Lipasi (LPS)
0-1 U/L
Pancreatite acuta
Dosaggio enzimatico richiede:
eccesso di substrato/coenzima (cinetica di ordine zero → misura nella fase di linearità d.
reazione!)
q pH e temp. costanti
q ev. uso di reazioni accoppiate
q dosaggio “a tempo” o in cinetica
q
q
attività enzimatica espressa in unità internaz. (U) = quantità di enzima che trasforma 1
µMole di substrato al min in condizioni specifiche (temp, pH, [S], ecc.); di solito U/L
q importante: standardizzazione metodo in laboratori di analisi diversi
q dosaggi spettrofotometrici con sistemi automatizzati
Isoenzimi di interesse diagnostico
Isoenzima
Tessuto
Patologia
CK-MM
Cuore e muscolo schel.
Infarto mioc.; traumi muscol
CK-MB
Cuore e muscolo schel.
Infarto mioc.; distrofia muscol
CK-BB
Cervello
Separaz. elettroforetica;
RIA
Accidenti cerebrovascolari, shock,
tumori cerebrali
LDH-1
Cuore; RBC
(emolisi rende campione
inidoneo!)
Infarto mioc.; emolisi
(LD1>LD2)
LDH-2 (norm.
maggioritario)
Rene
Infarto renale
LDH-3
Polmone, linfociti, pancreas Danno polmonare (embolia,
polmonite), linfocitosi,
pancreatite
LDH-4 e -5
Fegato e muscolo
Separaz. elettroforetica
Danno epatocell./muscolare
Quasi sempre si analizza un pannello di enzimi e non un enzima solo!
Es. Time-course attività enzimatica nell’infarto del miocardio (VEDI ANCHE CUORE)
Inizio
Picco di Aumento
Durata
Enzima
aumento
attività rispetto al dell’elevazione
(h)
basale
(gg.)
CK
4-8
12-24
5-10
3-4
CK-MB
4-8
24-38
5-15
2-3
AST
8-12
24
2-3
5
LDH
12-24
72
2-3
10
LDH1>LDH2
(flipped pattern)
12-24
5
Principali componenti dell’azoto non proteico del plasma
Composto
% del
totale
Concentrazione Patologie con aumento
plasmatica
della conc. plasm.
Urea (BUN)
filtrata dal glom.
e non riassorbita
dal tubulo
(riassorb. passivo
→ ricircolo
entero-epatico)
Aminoacidi
45
7-18 mg/100 ml
(2-6 mM)
dosaggio
enzimatico
(ureasi/GluDH)
Acido urico
filtrato dal glom,
riassorbito dal
tubulo prox. e
secreto dal tubulo
dist.
20
Creatinina
filtrata dal glom.
5
Creatina
1-2
Danno muscolare (distrofia, traumi)
Ammoniaca
0.2
20-60 µg/100 ml Insufficienza epatica, sindr. di Reye,
deficit genetico enzimi ciclo urea
(30 µM)
Pre-renali: shock, emorragia,
insuff. cardiaca
Renali: insuff. renale acuta e
cronica
Post-renali: ostruzione vie
urinarie
20
3.5-7 mg/100 ml Dieta, gotta, terapia antiblastica,
glicogenosi*
* acido lattico e corpi chetonici
competono per escrezione tubulare
con ac. urico
0.5-1 mg/100 ml Danno renale glomerulare (clearance
cr.); conc. plasm. aumenta solo se
>50% funzione deteriorata!
METABOLISMO DEL FERRO
q è un metabolismo “a circuito
chiuso”
q contenuto totale c.a. 4g (“un
chiodo”)
q fabbisogno dietetico c.a. 10
mg/die (assorbimento solo 10%!)
q Fe2+/3+ è presente in : eme (Hb,
Mb, citocromi); centri Fe/S;
mieloperossidasi (PMN → ROS
→ killing); perossidasi e catalasi
(radical scavengers); ossidasi cit.
P450-dip. (metab. steroidi,
eicosanoidi, ac. biliari, farmaci)
Valori di riferimento (siero): no citrato/EDTA, no emolisi!
Fe
µg/dl
Transferrina
mg/dl
% saturazione
Ferritina
µg/L
maschi
65-170
200-400
20-55
20-250
femmine
50-170
200-400
10-50
10-120
Carenza di Fe: gravidanza, allattamento, emorragie (occulte!)
Eccesso di Fe (emocromatosi) :
idiopatica, da eccessivo assorbim.
⇓
sec. a trasfusioni ripetute (anemie emol.)
generazione radicali O2 → danno tissutale (epatico, cardiaco, pancreatico)
Modificazioni dei valori rel. al Fe sierico in alcune patologie
Patologia
Fe Transferrina
%
Ferritina
siero
saturaz.
Sideropenia
↓
↑
↓
↓
Emocromatosi
↑
↓
↑
↑
Malnutrizione
Neoplasie
Infez.
croniche
↓
↓
↓
↓
↓
↓
↓
↑
EMOGLOBINA
Embionale :
Gower 1 (zeta2epsilon2)
Gower 2 (alfa2epsilon2)
a
Dopo 8 settimana: Portland (zeta2gamma2)
Alla nascita: 60-70% HbF (alfa2gamma2) e 30% A1
HbF ha maggiore affinità per O2 dell’HbA perché lega meno saldamente 2,3BPG
Entro 9 mesi HbF diventa <1%
Adulto:
HbA1 (alfa2beta2) 95%
HbA2 (alfa2delta2) <3%
HbF (alfa2gamma2) <1%
Le diverse emoglobine normali e patologiche si separano per elettroforesi di emolisato fresco su:
a) acetato di cellulosa a pH 8,4 (screening)
[origine (-)…A2/C/E… S/D/G… F… A1 (+)]
“Accelerated - Fast - Slow - Crawl” or “A Fat Santa Claus”
b) agar-citrato a pH 6,0 (conferma diagnosi; separa C da A)
[ (+) HbC…S… origine... A/D/G/E…..F (-)]
Emoglobinopatie: difetti qualitativi catene globiniche
Geni catene alfa: 4, 2 su ciascun cr. 16
Geni catene beta/gamma/delta: 2, 1 per ciascun cr. 11
Emoglobinopatia
Mutazione
Meccanismo
Sintomatologia
Anemia
falciforme
(HbS)
Mutazione non
estinta perché
eterozigosi
protegge da
infezione da
Plasmodium
falciparum
aa. n°6 catene
beta Glu →Val
africani e afroamericani (1/500
nati HbSS; 10%
popolazione
HbAS)
Possibile
diagnosi
prenatale su
DNA villi coriali
deossi HbS
trombosi piccoli
forma polimeri vasi e infarti
che distorcono il multipli (crisi
GR (falciforme, dolorose)
“sickle cells”) autosplenectomia
Esami lab:
(omozigote)
anemia
normocitica e
normocromica,
reticolocitosi
HbC
aa. n°6 catene
beta (Glu → Lys
Prevalenza: ovest
Africa (18-28%)
(anche in Italia)
HbC
deossigenata
forma pseudocristalli
esagonali nei
GR (a bersaglio,
“target cells”)
Elettroforesi
Hb
Omozigote:
80% HbS (tra HbA1 e A2)
test solubilità Na-ditionito
(tamp fosfato) positivo
2-20% HbF
2-4% HbA2
(solo omozigote): (agar citrato) 90%HbC
anemia lieve,
migra con A2 su acetato
splenomegalia e cell.
dolori addominali
HbSC
Entrambi geni beta
mutati: uno codifica
x HbS, l’altro x
HbC→ no Hb A
simile a HbS
(agar citrato) 50%HbC e
50%HbS
(no HbA)
HbE
aa. n°26 catene beta
(Glu→Lys)
sud-est Asia (20
milioni individui!),
spesso associata a
talassemia
(solo
su acetato cell. HbE migra
omozigote):
con A2; su agar citrato
anemia lieve e migra con A
microcitemia,
presenza di cell.
bersaglio
Talassemie: difetti quantitativi catene globiniche
Talassemia
Alfatalassemie
Africa, India,
MedioOriente
Mutazione
Forme cliniche
di solito, delezione genica
α-Thal 1 2 geni mutati
sullo stesso cromosoma
omozigote→no sintesi
catene alfa
α-Thal 1 omozigote: 4
geni mutati→morte intrauterina: HbBart(γ4)
(alta affinità per O2
→ipossia tessuti)
100% HbBart
α-Thal 2 1 gene mutato
su un cromosoma
omozigote→rimangono 2
geni “buoni”
doppia eterozigosi α-Thal
1 / α-Thal 2:
3 geni mutati → malattia
da HbH (β4) anemia
emolitica moderata
5-30% HbH
10-20% Hb
Bart alla
nascita
doppia eterozigosi α -Thal
1 / α -Thal 2 3geni mutati 2 geni mutati (sullo stesso
su 2 cromosomi →rimane o su 2 cr.)→ α-talassemia
1 gene “buono”
minor (moderata anemia
microcitica ipocromica)
BetaTalassemie
area
Mediterraneo
Elettro. Hb
varie (trascrizione,
maturazione, traduzione
mRNA)
β1 ridotta sintesi catene
betaβ 0 nessuna sintesi
catene beta
1 gene mutato→asintom
Talassemia minor: eterozigosi β1
o β0 asintomatica: anemia
microcitica, ipocromica (diagnosi
diff. con anemia sideropenica);
Talassemia major (morbo di
Cooley): omozigosi β1 o β0
anemia grave, espansione midollo
emopoietico con deformità ossee,
epato-spleno- megalia, col tempo
sovraccarico di Fe da trasfusioni
ripetute
2-10% Hb
Bart alla
nascita
1-2% Hb Bart
alla nascita
2-8% HbA2 ;
>2%HbF
(variabile), il resto
HbA
95% HbF; 1-6%
HbA2, no HbA (β0)
CATABOLISMO DELL’EMOGLOBINA (vedi anche fegato)
ELETTROLITI
La misura della concentrazione di soluti nel plasma (urine) è l’osmolalità (Moli di soluto/Kg di
soluzione). Talvolta si usa l’osmolarità (Moli soluto/L soluz.).
Si misura con l’osmolarimetro (misura l’abbassamento della T di congelamento).
L’osmolarità del plasma è il parametro cui risponde l’ipotalamo con la produzione di ADH
(riassorbimento acqua dai dotti collettori renali) e con il senso di sete (aumentata introduzione di
acqua).
Siero: 275-295 mOsml/Kg
Urine (24h) : 300-900 mOsmol/Kg
Elettrolita
Concentrazione siero
Na+ (il catione +
135-145 mEq/L
abbondante nei fluidi
extracell)
K+ (il catione +
3.4-5 mEq/L
abbondante nei fluidi
intracell)
Cl- (l’anione + abbondante 98-106 mEq/L
nei fluidi extracell)
Concentrazione
urine (24h)
40-200 mEq
25-125 mEq
110-250 mEq
HCO3 -
22-26 mM (sangue intero) riassorbito ~ tutto
Ca2+
4.5-5.5 mg/100ml
(1.1-1.3 mM)
1.2-3 mEq
Mg2+
1.2-2 mEq/L
(0.6-1 mM)
6-10 mEq
PO43-
2.7-4.5 mg/100 ml
(0.9-1.4 mM)
13-42 mMoli
0.4-1.3 g
2-TEST DI FUNZIONALITA’ EPATICA
1.
2.
3.
cenni di fisiologia e anatomia
enzimi (AST, ALT, GGT, AP), Bilirubina, prot. siero, fatt. coagul.
alcuni quadri diagnostici (epatiti virali, alcolismo, malattie da accumulo)
Principali funzioni del fegato
q
q
q
q
q
Ruolo centrale metabolismo glucidico, lipidico, proteico
Metabolismo bilirubina e produzione bile
Detossificazione di composti endogeni (bilirubina, ormoni) ed esogeni (farmaci)
Sintesi di proteine del plasma (trasporto)
Sintesi di tutti i fattori della coagulazione (tranne VIII-vWF): vit K dipendenti (2°, 7°, 9°,
10°)
q Deposito di glicogeno, vit. B12, vit. A,D,E,K
Circolazione epatica
Il fegato riceve sangue dall’arteria epatica e dalla vena porta (= sangue refluo dall’intestino)
Quindi: il fegato è il primo organo a ricevere il sangue che contiene i prodotti dell’assorbimento
digestivo.
Enzimi di interesse diagnostico per patologie epatocellulari
Enzima
Valori di riferimento
Significato diagnostico
AST (SGOT)
mitocondriale
5-35 U/L
Anche in muscolo/cuore
Aumenta in cirrosi, alcolismo, danno
epatico cronico in malattie da accumulo
ALT (SGPT)
citosolica
5-35 U/L
+ specifica per danno epatico acuto
(aumenta anche di 100 volte!)
screening epatite
AST/ALT
≅1
<1 epatite acuta 3-4 cirrosi (alcolica!)
5-30 U/L
γGT
trasporto aa. polo
biliare
Epatopatie biliari ostruttive ; neoplasie
epatiche prim. o metast.
Aumenta in parallelo con ALP
Screening alcolismo (con MCV)
ALP fosfatasi
alcalina
Epatopatie biliari ostruttive (aumenta fino
a 10 volte); accrescimento, fratture ossee,
osteosarcoma, metastasi ossee
30-90 U/L
Alcolismo cronico
L’abuso di alcol (50 g etanolo al giorno per 10 anni) compromette la funzione epatica (steatosi →
epatite → cirrosi). Danno cellulare è dovuto a ossidazione etanolo ad acetaldeide e formazione di
addotti acetaldeide-proteine (base di Schiff).
Indicatori di laboratorio di abuso di alcol:
γGT (aumenta prima di altri segni di sofferenza epatica)
AST (aumento indica danno epatico in atto)
AST/ALT >2
HDL elevate MCV aumentato
Bilirubina
q
q
q
q
prodotto di degradazione dell’emoglobina (200-300 mg/die)
principale pigmento della bile
si forma nei macrofagi di milza e midollo dalla emoglobina (Fe riciclato!)
bilirubina (insolubile!) veicolata dall’albumina raggiunge il fegato, viene coniugata con ac.
glucuronico (bil. diretta) ed escreta nella bile → intestino → feci
q batteri intestinali ossidano bil. a urobilinogeno
q urobilinogeno è in parte riassorbito dal circolo entero-epatico e finisce nelle urine
(urobilina)
Valori di riferimento
bilirubina tot. 0.2-1 mg/100ml siero (3-17 µM); assente nelle urine
indiretta (= non coniugata) 0.7-0.8 mg/100ml (3-14 µM)
diretta (= coniugata) 0-0.2 mg/100ml (0-3 µM)
Catabolismo dell’emoglobina
Escrezione della bilirubina
Sintesi e coniugazione della
bilirubina
Quando bil >2 mg/dl compare ittero (ingl. jaundice)
Tipo di ittero
Pre-epatico
Cause e tipo di bil. aumentata
Emolisi ( ↑ produzione bilirubina) ↑ bil non coniugata (indiretta)
Epatico
Deficit cong. Glucuronil- transferasi; insufficienza epatica; necrosi
(difetto captazione, epatica; epatopatie acute e croniche; neoplasie primitive e secondarie
coniugazione o
↑ bil non coniugata (indiretta)
escrezione)
Post-epatico
Ostruzione biliare ↑ bil coniugata (diretta)
Neonatale
Fisiologico x ↑demoliz. eritrociti e insufficiente coniugaz. epatica
(1% dell’attività enzimatica dell’adulto) ↑ bil non coniugata (indiretta)
transitorio (3-5 gg) con bil ≤ 6-7 mg%
fototerapia se bil >15 mg/dl (isomerizzaz. e ciclizzaz. ↑ solubilità)
(ev. exanguinotrasfusione)
Aumenta in malattie emolitiche (incompatibilità Rh/AB0, deficit
G6PD), epatopatie, pre-termine. Gravi conseguenze neurologiche ittero
non trattato (precipitaz. bil. nei nuclei della base cranica!)
Modificazione delle proteine del siero in alcune epatopatie
Patologia
Albumina
α-globuline
β-globuline
γ-globuline
Epatite acuta
N o poco ↓
N o poco ↑
Poco ↑
↑
↓↓
N
↑
↑↑
↓
↑
↑↑
↑
N
N o poco ↑
↑
N
Epatite cronica
attiva
(autoimmune)
Cirrosi
Ostruzione
biliare
extraepatica
Patologia epatica
Colestasi
Test
Bilirubina
ALP
γGT
Colesterolo
Danno epatocellulare
Risultato
↑
↑
↑
↑
ALT
AST
↑
↑
Albumina
Colesterolo
↓
↓
PT
↑
3-TEST METABOLISMO GLUCIDICO
q
q
q
q
riassunto ormoni che regolano glicemia
cause di iper- e ipo-glicemia
criteri diagnostici diabete mellito
esami di lab. nella chetoacidosi diabetica; test di tolleranza al glucosio; emoglobina
glicosilata; corpi che tonici
Fabbisogno giornaliero di glucoso
Il glucoso è introdotto con la dieta come saccaroso (glucoso + fruttoso).
q Tessuti che dipendono dalla glicolisi anaerobia per produrre ATP: (40 g/die)
eritrociti, cristallino, cornea, midollare rene, leucociti, fibre muscolari bianche
q Cervello (120 g/die)
Fabbisogno totale : 160 g/die (60-80g dalla dieta; 100g dal fegato attraverso glicogenolisi e
gluconeogenesi)
Profilo glicemico giornaliero normale ~ costante, nonostante la discontinuità di introduzione del
glucosio con l’alimentazione, per la capacità del fegato di utilizzare glucosio nei periodi di glicemia
elevata e produrre glucosio quando viene meno l’apporto alimentare.
Glicemia normale 70-110 mg/100 ml siero (~5 mM)
Ormoni che controllano la glicemia
Organo
Ormone
Pancreas Insulina
2-16 µU/ml
(~40 pM)
raggiunge un
piccodi 6-10
volte il basale
dopo 30 o 60
min da carico di
glucosio
Glucagone
50 pg/ml
(~ 2pM)
Somatostatina
Surrene
↑ Ingresso glucosio (tranne fegato,
cervello, RBC)
↑ glicolisi, glicogenosintesi epatica e
sintesi ac. grassi
↓ Lipolisi e gluconeogenesi
Effetto
su glicemia
↓
↑ glicogenolisi e gluconeogenesi
epatiche
↑ Lipolisi
↓ rilascio di insulina, glucagone e
ormoni ipofisari
(impedisce oversecrezione)
↑ Glicogenolisi muscolare e lipolisi
↑
↑
ACTH
↑ Gluconeogenesi da aa.
Antagonista dell’insulina
↑ Rilascio di cortisolo e lipolisi
GH
Antagonista dell’insulina
↑
Adrenalina
Cortisolo
Ipofisi
Azione
↑
↑
Tiroide
Tiroxina
↑ Glicogenolisi e gluconeogenesi
epatica
↑ Assorbimento intestinale di zuccheri
↑
Principali cause di iper- (>120 mg%) e ipo-glicemia (<50 mg%)
Iperglicemia
Transitoria Stress emotivo/fisico
acuto
Shock
Infarto miocardio
Convulsioni
Epatopatia grave
Feocromocitoma
Ipoglicemia
Farmaci (salicilati, β bloccanti)
Alcolismo
Sepsi
Epatopatia grave
Glicogenosi
Persistente Diabete mellito
Insulinoma
Sindrome di Cushing
Glicogenosi tipo I
(iperattività surrene)
Acromegalia (ipersecrez.
GH)
Ipertiroidismo
Obesità
Il diabete mellito è la causa + frequente di iperglicemia persistente !
Tipo di
diabete
InsulinoDipendente
(IDDM)
o Tipo I
Patogenesi
Distruzione autoimmune
cellule β (autoanticorpi
anti- insulina/cell. β nel
95%
dei casi)
Deficit insulinico assoluto
(risp. a glucagone):
↑↑ Gluconeogenesi e
lipolisi
→ chetosi
InsulinoInsulino-resistenza
indipendente associata
(NIDDM)
a ridotta secrez. insulinica
o Tipo II
Deficit insulinico relativo
(no chetoacidosi)
Manifestaz. cliniche
Trattamento
Poliuria
polidipsia
polifagia
dimagrimento
chetosi → acidosi
Coma
chetoacidosico
Insulina, dieta,
attività
fisica, monitoraggio
glicemia:
auto-test 3xdie
glicemia a digiuno
Hb glicosilata ogni
4-6
mesi
Asintomatico,
esordio
graduale
(faticabilità,
infezioni ricorrenti,
storia di diabete
gestazionale)
No chetosi
Coma iperosmolare
non acidosico
Ipoglicemizzanti
orali
o insulina; dieta,
regolare attività
fisica,
monitoraggio:
auto-test
glicemia a digiuno
Hb glicosilata ogni
4-6
mesi
Criteri di diagnosi del diabete mellito
1- sintomi del diabete + glicemia random ≥ 200 mg/dl
2- glicemia a digiuno ≥ 126 mg/dl
3- glicemia dopo test tolleranza al glucosio (~75g orali) ≥ 200 mg/dl dopo 2 ore
2 su 3 di questi criteri per fare diagnosi di diabete
Valori borderline: impaired fasting levels (110-130 mg/dl)
impaired GTT (2 h) (140-200 mg/dl)
Glicemia a digiuno: dosaggio nel plasma/siero dopo 12 ore di digiuno (70-110 mg/dl) (princ. test
screening diabete)
Glicemia “Random”: 130-140 mg/dl
Glicemia 2 ore dopo il pasto: usata per monitoraggio, non utile ai fini diagnostici (dipende
dall’apporto di carboidrati nel pasto!) deve essere tornata normale dopo un aumento tra 60-90 min
Test di tolleranza al glucosio*: standardizzato!
q
q
q
q
q
q
Dieta: deve includere 150g/die di carboidrati nei 3 giorni precedenti l’esame (induzione
enzimatica)
Farmaci: salicilati, diuretici, anticonvulsivanti riducono secrez insulina; contraccettivi orali
→ resistenza all’insulina
Alcol: no alcol per 3 giorni pre-esame
Malattie: no febbre, no malattie (2 sett.), no infarto mioc. (6 sett.), traumi, infez., ecc.
Attività fisica: no degenza a letto (altera GTT)
Digiuno: per 12 ore prima del test (no fumo, alcol, esercizio fisico)
Test: al mattino introduz. di 1.75g glucosio/Kg di peso (bevanda) e prelievi di sangue ogni h per 3 h
Valori normali: picco glicemico dopo 30 min, ritorno alla normalità dopo 2 ore
*Glucose tolerance test (GGT)
Metodi di dosaggio glicemia/glicosuria
metodo chimico (non specifico per glucosio; zuccheri riducenti riducono Cu3+ a Cu2+ in alcali;
cartine!)
metodo enzimatico (glucosio ossidasi o esocinasi; specifico!)
emoglobina glicosilata (di elezione per monitoraggio di lungo termine)
una frazione dell’HbA si lega al glucosio stabilmente (HbA1A/B/C) attraverso base di Schiff tra
NH2 -term catene β e C1 del glucoso
è espressione della glicemia delle ultime 6-8 settimane (dosare ogni 4-6 mesi)
dosaggio elettroforetico o cromatografico; valori normali <6-7%
Metodi di dosaggio corpi chetonici
(acetone, acetoacetato, β-idrossibutirrato)
metodo chimico: acetoacetato (solo lui!) reagisce con nitroprussiato di sodio dando composto di
colore viola (cartine urine)
metodo enzimatico per acetoacetato e β-idrossibutirrato
Chetogenesi epatica nel diabete
q molto maggiore nel diabete che nel digiuno
q dovuta a elevato rapporto glucagone/insulina
Valori ematochimici nella chetoacidosi diabetica e nel coma ipoglicemico
Test di laboratorio
Siero
glucosio
Corpi chetonici
(1.5 mg/dl)
pH
(7.43)
HCO3 (iperventilaz.)
Na+
Osmolalità
295 mOsm/Kg
BUN
(disidrataz.)
Urine
glucosio
(norm. assente)
Corpi chetonici
(norm. assenti)
Chetoacidosi
diabetica
Overdose di
insulina
↑↑
↓↓
↑↑
(100x)
↓↓
(7.05)
↓↓
assenti
Coma
iperosmolare non
acidosico
↑↑↑
(>500 mg/dl)
assenti
N
N
N
N
↓
(poliuria)
↑↑
(350 mOsm/Kg)
↑
N
N
N
↑↑↑
N
↑
↑↑
assente
↑↑↑
↑↑
assenti
assenti
Segni chimico-clinici del diabete di tipo I
Vasculopatia diabetica (tipo I e tipo II)
La macroangiopatia diabetica (arteriosclerosi accelerata) è la causa di:
q arteriopatie periferiche (claudicatio intermittens )
q cardiopatia ischemica (angina; infarto)
q malattie cerebrovascolari (attacchi ischemici transitori (TIA), emorragie cerebrali; ictus )
La microangiopatia diabe tica è causata dalla iperglicemia cronica che danneggia l’endotelio
vasale:
q retinopatia
q nefropatia (microalbuminuria predittiva!)
q neuropatia (sensitivo/motoria)
Diabete gestazionale
q è una forma di diabete che insorge in gravidanza e termina, generalmente, con la fine di
questa
q una fra le complicanze più frequenti della gravidanza (2-5%), seconda solo all'ipertensione
(5-10%)
q dovuto a produzione di ormoni (Lattogeno Placentare, cortisolo e prolattina) che
interferiscono con l'azione dell'insulina. In donne predisposte questa interferenza è molto
accentuata e determina l'insorgenza del diabete gestazionale
q è un fattore di rischio per sviluppare negli anni un diabete di tipo II.
Screening con Test di Carpenter o "Mini-curva della gravidanza“: di routine in tutte le gravide
(26a settimana). Glicemia prima e 1 ora dopo carico orale (50 g) di glucosio. Se 2° dosaggio ≥ 140
mg/dl, test positivo: allora fare curva da carico orale di glucosio che è il vero test diagnostico. E’ utile
associare alla curva da carico il dosaggio dell’emoglobina glicosilata (HbA1c).
Complicanze
Il diabete gestazionale, se non correttamente trattato, può comportare infezioni urinarie, aborto,
morte tardiva del feto (3o trimestre), parto pretermine, eccessivo sviluppo del feto (macrosomia).
Terapia
La prima terapia è la terapia dietetica (dieta normocalorica a ridotto contenuto di zuccheri)
associata ad attività fisica. Il buon funzionamento della terapia viene valutato effettuando
l’autovalutazione della glicemia con stick glicemici (su sangue prelevato da un polpastrello previa
"scalfitura" con ago): al risveglio e 1 ora dopo colazione pranzo e cena. Il medico valuterà sulla
base dei risultati (che la paziente annoterà) se modificare o meno la dieta. Periodicamente si
effettueranno nuovamente il dosaggio della emoglobina glicosilata (HbA1C). In caso di insuccesso
della sola terapia dietetica si procederà all'aggiunta di insulina.
4-TEST METABOLISMO LIPIDICO
q
q
q
q
Classificazione lipoproteine e loro metabolismo
Classificazione apolipoproteine
Valori di riferimento
Vari fenotipi dislipidemie
Lipoproteine
Complessi lipoproteici circolanti, formati da trigliceridi, colesterolo, fosfolipidi e proteine.
Funzioni proteine (apo ): strutturali (“guscio” polare ↑ solubilità), attività enizmatiche e regolatorie
(cofattori) di enzimi correlati al metabolismo lipidico, ligandi per recettori (consentono endocitosi).
Si classificano:
- in base alla migrazione elettroforetica, in α -lipoproteine (HDL), preβ -lipoproteine (VLDL) e β lipoproteine (LDL)
- in base alla densità, in chilomicroni (origine), VLDL (pre- β), LDL (β)e HDL (α)
Classificazione apolipoproteine
Apo
Origine
Conc.plasm
(mg/dl)
PM
x103
Princ. Apo nelle HDL
Attiva LCAT (con Apo D)
(lecitina-colesterolo acil transferasi)
Ligando per recettore HDL
Attiva LCAT
Attiva trigl. lipasi epatica
Princ. Apo nelle VLDL, LDL
Ligando per recettore LDL (LDL-R)
Fegato
intestino
100-200
27
fegato
20-50
17
fegato
70-125
540
B-48
Strutturale nei chilomicroni
intestino
<5
260
C-1
fegato
5-8
7
C-2
Attiva LPL
(trigliceride lipasi)
Attiva LPL e LCAT
fegato
3-7
9
C-3
Inibisce LPL
fegato
10-12
10
fegato
3-15
34
A-1
A-2
B-100
Funzioni
E-2,3,4 VLDL, LDL e HDL
isoforme Ligando per LDL-R (E2 difettiva!)
Classificazione lipoproteine
Classe di lipoproteine
Costituenti
Chilomicroni
(100-1200 nm)
mobilità elettr.: origine
Trigliceridi (90-95%) e
colesterolo ester. dieta;
ApoB48 (“nascenti”)
Poi ApoC1-2 e apoE
super-petroliere:
Nel sangue per ~ 6 ore
trasportano trigliceridi dopo il pasto, assenti
alimentari ai tessuti e dopo digiuno 12 ore.
infine al fegato
VLDL
(30-80 nm)
mobilità elettr.: pre-β
Origine
Prodotti dagli enterociti e rilasciati nel circolo
linfatico → dotto toracico → sangue (siero
lattescente dopo i pasti).
Ricevono apoC2 e apoE da HDL
apoC2 attiva LPL endotelio → cedono
trigliceridi ai tessuti
cedono col. libero e triglic. alle HDL
e ricevono col.esterif. (via apoD)
captazione epatica x endocitosi
recettore- mediata via apoE (chi.“residui”)
Epatica. Circolando, ricevono apoC2,
apoE e col est. ester. da HDL e diventano
“mature” (↓ trigl. e ↑col. ester.) → IDL
Trigliceridi (50-65%)+
col. libero e esterif.
endogeni + fosfolipidi
Apo B100 (“nascenti”)
Aumentano con dieta
autobotti:
trasportano trigliceridi ricca di glucidi
(torbidità siero)
sintetizzati nel fegato
IDL (dalle VLDL)
↑ contenuto colesterolo 50% endocitosi epatica recettore- mediata (via
ester. Apo B100
apoE) e 50% attaccate da LPL epatica (↓ trigl)
→ LDL
LDL
(18-30 nm)
mobilità elettr.: β
autobotti “vuote”
(di trigliceridi)
HDL
(5-12 nm)
mobilità elettr.: α
“clean-up crew”
raccolgono colesterolo
libero da sangue e
tessuti e lo portano al
fegato
Princ. colesterolo e suoi
esteri (50%) e Apo B100
Trasporto colest. ai
tessuti (aterogeniche!)
Principale fonte di colesterolo x tessuti
extraepatici.
Captazione attraverso endocitosi recettoremediata via apo B100 30% captate dal fegato
e 70% dai tessuti extraepatici
Colesterolo endogeno,
fosfolipidi, proteine
(60%); rimuovono
colesterolo libero e dai
tessuti e lo veicolano al
fegato (Apo A1-A2, C e
D)
Fegato unico organo
che può liberare col.
nella bile (ac. biliari )
Epatica e intestinale: apoA1 + apoC2, apoE e
col. non ester. (dai tessuti) → HDL “nascenti”
(HDL3) col. libero viene esterif da LCAT
(necess. apo A1 e D)
Tramite attività CETP* scambiano col. ester.
con VLDL e IDL e ricevono
trigliceridiCaptaz. epatica via recettore x
apoA/E
*CETP = cholesteryl esther transfer protein
Ruolo delle lipoproteine nel metabolismo dei trigliceridi
Ruolo delle lipoproteine nel metabolismo del colesterolo
Ruolo delle HDL nel metabolismo del colesterolo
Le HDL veicolano il colesterolo “in eccesso” dai tessuti al fegato, che è l’unico organo deputato
all’escrezione.
Effetti dell’insulina sul metabolismo delle lipoproteine
q inibisce trigliceride lipasi (glucagone stimola)
q stimola sintesi di acidi grassi e trigliceridi
q è necessaria per espressione LPL endoteliale (FFA ai tessuti)
ê
Deficit insulina → lipasi tessuto adiposo ATTIVA → FFA al fegato → VLDL
↓
ipertrigliceridemia ß deficit clearance tessuti
Valori di riferimento (siero):
trigliceridi (VLDL)
colesterolo HDL
colesterolo LDL
colesterolo totale
colesterolo totale/HDL
70-140 mg/100 ml
30-75 mg/100ml
60-130 mg/100 ml
140-200 mg/100ml
≤5
Metodi di dosaggio
Colesterolo esterif (60% del tot) e col. libero : metodo enzimatico (col. ossidasi)
Trigliceridi: idrolisi enzimatica (lipasi) → ac. grassi e glicerolo e dosaggio glicerolo con metodo
enzimatico (deidrogenasi)
Apolipoproteine: immunoassay (ELISA/RIA)
HDL/LDL: ultracentrifugazione, precipitaz e dosaggio colesterolo
Iperlipoproteinemie
q
q
primitive
secondarie ad altra patologia: diabete, ipotiroidismo, obesità, alcolismo, contraccettivi
orali, malattie epatiche
Fenotipo
Incidenza Col.
tot
Rara
Trigl. HDL LDL VLDL CM Commenti
I
Ipertrigliceridemia
q Familiare
↑↑↑
(deficit
N (>1000
LPL o
Comune
mg/dl)
apoC2)
q Sec. a
IDDM
IIa
Ipercolesterolemia Omozigote ↑↑
N
qFamiliare (deficit (rara) o
300recett. x
eterozigote 600
apoB/E)Sec. a
mg/dl
dieta (poligenica) Comune
↓
↓
↓
No rischio
coronarico; rischio
↑↑↑ pancreatite
Xantomi eruttivi
N
↑↑
N
0
Rischio coronarico
20-50aa.
Xantomi cutanei
IIb
comune
Iperlipidem.
Combinata
(trigl+col)
Familiare o
sec. a dieta
III
Rara
Dis-β
Lipoprotein.
(omozigosi
apoE2 o
Deficit
apoE)
↑↑
↑
↑
↑↑
200-300 300-600
mg/dl
N
↑↑
↑↑
N
↑
↑
Elevato
rischio
0 coronarico
Lipoprot.
↑ Anomala
(β-VLDL,
Larga
banda β)
xantomi
5-ESAME DELLE URINE E TEST FUNZIONALITA’ RENALE
q
q
q
diagramma funzionale nefrone e sue funzioni
l’esame fisico-chimico delle urine
test di funzionalità renale (clearance creatinina, BUN, capacità di concentrazione)
Principali funzioni del rene
q rimozione metaboliti tossici dal sangue
q regolazione del volume ematico
q mantenimento equil. acido-base (escrez. H+ e riassorb. HCO3-)
q mantenimento pressione sanguigna (sistema renina-angiotensina)
q regolaz. eritropoiesi (eritropoietina)
Unità funzionale renale: nefrone
§
Arteriola afferente al glom. → efferente → capillari peritubulari → venula
§
Glomerulo con capsula di Bowman (corticale)
§
Tubulo convoluto prossimale
§
Ansa di Henle (attr. midollare)
§
Tubulo convoluto distale
§ Tubulo collettore
Funzioni delle varie parti del nefrone
Glomerulo
ultrafiltrazione del plasma: NON passano macromolecole (cutoff <66 kDa) e cellule (GFR glom.
filtration rate 130 ml/min)
cellule iuxtaglomerulari rispondono a ↓ volume ematico producendo renina (trasforma
angiotensinogeno → angiotensina) che induce vasocostrizione (↑pressione sang.)
Tubulo
riassorbimento: attivo (Na+, aminoacidi, glucoso, vitamine, fosfato, HCO3 -, ioni); passivo (acqua,
urea, Cl-)
cellule vicino al tubulo prox. producono eritropoietina in risposta a ipossia (→ stimolazione
eritropoiesi)
escrezione (H+, farmaci, ac. urico)
concentrazione : ansa di Henle discendente → rimozione acqua; ansa di Henle ascendente →
rimozione Na+ e Clsoglia renale = conc. plasmatica al di sopra della quale una sostanza compare nelle urine es. soglia
renale glucosio 200 mg/dl
L’esame chimico delle urine
Parametro
Colore
Valori di
riferimento
giallo paglierino
Commenti
Aspetto
limpido
torbidità da eccesso fosfati (urine alcaline), urati (urine acide),
batteri, cellule (WBC)
pH
4.5-8
acidità delle urine princ. dovuta a fosfato (norm.);
↓ acidosi, diabete (corpi chetonici); ↑ contaminaz. batterica (ureasi
batt. producono NH3)
Peso
specifico
1005-1030
(peso urina/peso
acqua)
↓ diabete insipido (deficit ADH), danno renale (glomerulonefrite,
danno tubuluare renale);
↑ eccessiva perdita di liquidi (sudore, vomito, diarrea), insuff.
cardiaca congestizia; si misura con densitometro
Glucosio
norm assente
glicosuria quando [gluc] nel filtrato glom. supera capacità riassorb.
tubulo (glicemia > 200 mg/dl) dosaggio enzimatico o per riduzione
Cu
Corpi
chetonici
norm. assenti
chetonuria nel diabete mellito, febbre (lattante!), digiuno
(anoressia), vomito; dosaggio con nitroprussiato che reagisce con
acetoacetato per dare coloraz. viola; dosaggio enzimatico
Proteine
norm assenti (non
dosabili con cartine)
40-60 mg/die (α1-2
globuline)
Eritrociti
norm. assenti
micro-albuminuria (30-300 mg/die) screening diagnostico
progressione glomerulonefritica nel diabetico (!)
proteinuria minima (<0.5g/die) febbre, ipertensione,
glomerulonefrite, rene policistico, infezioni renali; prot.moderata
0.5-3g/die nefropatie, mieloma, glomerulonefrite cronica,
nefropatia diabetica, infezioni, calcolosi; prot. marcata (>3g/die)
sindrome nefrosica, insuff. cardiaca congestizia
ematuria da infezione, calcolosi, neoplasia, trauma, contaminaz.
mestruale; emoglobinuria da emolisi intravascolare
Bilirubina
norm assente
farmaci, urobilinuria, emoglobinuria
bilirubinuria in condiz. di ↑ bilirubina diretta nel sangue (emolisi,
colestasi) bilirubina molto sensibile alla luce!
Urobilinoge Tracce, non rilev.
no
con cartine
↑ emolisi, epatopatie acute e croniche, cirrosi (ridotta ricaptazione
epatica urobilinogeno riassorbito dal circolo entero-epatico)
Nitriti
indicatore indiretto di batteriuria (enzimi di molti batteri riducono
nitrati urinari a nitriti)
Norm. assenti
Esterasi
Norm. assente
leucocitaria
Rilasciata da granulociti → infezione vie urinarie
L’urobilinogeno può aiutare nella diagnosi differenziale tra malattia epatica, emolisi e ostruzione
biliare.
Emolisi
Danno epatico*
moderato
Ostruzione
biliare
severo
Urobilinogeno
↑
↑
↑
↓ o assente
Bilirubina
urinaria
=
=
+
+
Bilirubina
siero
Dir. N
Indir. ↑
Dir.
N/poco↑
Indir. N
Dir. ↑
Indir. ↑
Dir. ↑
* Danno epatico può essere a carico dell’uptake, coniugazione o escrezione biliare della bilirubina.
L’esame microscopico del sedimento urinario
su campione fresco (urine della mattina = non diluite)
Cilindri (ingl. “casts”) Norm assenti. Si formano nel
tubulo convoluto distale in presenza di pH acido,
elevata conc. salina, basso flusso, ↑ proteine.
Indicatori di diffuso danno renale.
Cristalli
Identificati sulla base di aspetto microscopico, pH
urinario, solubilità. Possono essere di aiuto nella
diagnosi della natura dei calcoli renali.
Tipo di cilindri
Ialini
Cerei
Ematici
Cell. epiteliali
tubulari
Leucocitari
Misti
Descrizione
Significato clinico
Matrice mucoproteica secreta Febbre, esercizio fisico, scompenso cardiaco
dai tubuli
cong., glomerulopatie
Proteine sieriche, si formano Insufficienza renale avanzata
nel nefrone distale (larghi!)
(ingl. “broad casts”)
Matrice proteica con eritrociti Patognomonici di glomerulonefrite acuta
(rossi!)
proliferativa
Matrice proteica con cellule Necrosi tubulare (tossici), rigetto trapianto
tubulari
Matrice proteica con leucociti Pielonefrite acuta e glomerulonefrite proliferativa
Cilindri ialini con cellule
Glomerulonefrite proliferativa
varie
Cristalli
pH urine
Solubilità e commenti
Ossalato di
calcio
acido e
neutro
Forma di “busta”; comuni, solubili in HCl dil.
Fosfato amorfo
alcalino
Granuli incolori solubili in ac. acetico o HCL dil.; comuni, se
abbondanti → infezione
Urati
acido e
neutro
alcalino
Varie forme, giallini, sol. in alcali dil.; se abbondanti (con ac.
urico) → gotta o esaltato catab. nucleico
Granuli incolori a coppie e tetrameri; sol. in ac. acetico con
effervescenza
Carbonato di
calcio
Aminoacidi
(cistina,
tirosina, leucina)
Aminoaciduria in corso di malattie del metabolismo di specif.
aa.
Test di funzionalità renale
La funziona lità renale dipende da:
q flusso ematico renale
q filtrazione glomerulare
q funzione tubulare
q no ostruzione al deflusso urinario
Clearance creatinina
Lo studio della clearance renale di una sostanza (funzione glomerulare) richiede che si tratti di una
sostanza solubile (non legata all’albumina), filtrata dal glom. e NON riassorbita dal tubulo.
La sostanza endogena + comunemente usata è la creatinina (anche β2-microglobulina!).
Prodotto di degradaz. della creatina, formata nel muscolo a velocità costante, indip. dalla dieta;
filtrata dal glom. e (poco) escreta dal tubulo (GFR glom. filtr. rate semmai sovrastimato!)
Richiede: raccolta urine 24 ore (refrigerate!) + dosaggio creatinina nel siero
Clearance cr. (ml/min) = [urine] mg/dl / [siero]
mg/dl x V ml/min x 1.73/A
V = volume urine / 1440 min (24 h)
1.73 = superf. corp. standard
A = superf. corp. del pazie nte estrap. da tabelle
sulla base di peso e altezza
Valori di riferimento: 60-115 ml/min (f); 70-135
ml/min (m)
[Creatinina] siero
Aumenta : nefropatie con ↓ GFR ; ↓ flusso renale (scomp. card. cong); ostruzioni vie urin.; shock;
disidrataz.; traumi
Diminuisce : ridotta massa muscol.; denutrizione
Aumenta in modo significativo quando 50% dei nefroni non funzionano!
Valori di rif. : 0.5-1.3 mg/dl
BUN [urea] siero (azotemia)
Urea è prodotto dell’organicazione epatica dell’NH3 (catabolismo aa.)
Filtrata dal glomerulo e riassorbita in parte (40%) dal tubulo
Aumenta: cause pre-renali ( ↑produzione, shock, insuff. cardiaca cong, disidratazione), rena li
(insuff. renale acuta e cronica) o post-renali (ostruzione vie urinarie)
Diminuisce: gravidanza ( ↑GFR), ridotto apporto proteico dieta, emodiluizione, insuff. epatica
Valori rif. 8-23 mg/dl
Rapporto BUN/Creatinina
Calcolo del rapporto [BUN] / [Creatinina] nel siero può aiutare nella diagnosi differenziale della
causa (pre- o post-renale) dell’aumentata azotemia
↑ BUN/Creatinina con Creatinina ~ norm: cause pre-renali (scompenso cardiaco)
↑ BUN/Creatinina con Creatinina elevata: cause post-renali (ostruzione)
↓ BUN/Creatinina: dieta ipoproteica, necrosi tubulare, epatopatia grave
Al contrario di creatinina e BUN, la [ac. urico] nel siero NON è un buon indicatore di
funzionalità renale
[Ac. urico] siero
Prodotto dal catabolismo purinico.
Filtrato dal glomerulo, in gran parte (90%) riassorbito dal tubulo prox. e secreto dal tubulo distale.
Solubile (dissociato) a pH > 5.75 (rischio urolitiasi a pH urin. < 5.75)
Aumenta: aumentato catabolismo nucleico (terapia antiblastica); gotta;
Valori di riferimento: 3.5-7 mg/dl
Microalbuminuria (30-300 mg/24 ore)
al di sotto del limite di sensibilità delle cartine
richiede raccolta urine 24 ore
è indicativa della progressione del danno glomerulare nel paziente diabetico: nefropatia nel 45% dei
casi di IDDM (tipo I) e nel 30% dei casi di NIDDM (tipo II)
dosaggio indicato annualmente nel paziente diabetico (dalla diagnosi)
Valori di riferimento: <15 mg/24 ore
Test funzionalità tubulare
Si può diagnosticare danno tubulare dal confronto tra conc. plasmatica e conc. urinaria di elettroliti,
glucosio (soglia renale < 200 mg/dl) , H+, HCO3 - e dalla conoscenza delle funzioni dei vari
segmenti tubulari.
Tubulo prox. riassorbim. glucosio, aminoacidi, vitamine, proteine, Ca2+, K+, Na+ e Cl-, HCO3 - e
PO43Escrez. H+, farmaci
Ansa di Henle riassorbim. acqua, Na+, Cl-, Mg2+ (ansa ascendente escrez. Na+ e Cl- , crea
iperosmolarità midollare → ansa discendente perm. all’acqua riassorbimento acqua)
Tubulo distale riassorbim. Na+ (sotto controllo aldosterone) e escrez. K+, H+ (soprattutto come
NH4 + e NaH2 PO4 ), ac. urico
Dotto collettore riassorbe Cl-, urea (40%! contribuisce all’alta osmolarità midollare renale) e acqua
(sotto controllo ADH)
Controllo renale dell’equilibrio idrico
Rene è principale organo di controllo equilibrio idrico (filtrato glom. è ~150 L/die !!)
ADH (ipofisi post.) secreto in condiz. deficit idrico ( ↑osmolarità) stimola riassorbimento acqua da
tubulo collettore
Renina (cell.iuxtaglomerulari) secreta in risposta a ↓ volume/pressione sang converte
angiotensinogeno ad angiotensina (I → II) , che induce vasocostrizione (↑ pressione) e secrezione
di aldosterone (surrene), che induce ritenzione di Na+ (e di acqua).
Indicatori di malfunzionamento tubulare
↓ Capacità di concentrazione dell’urina (osmolalità): ↓ peso specifico (norm 1005-1030) e ↑ vol.
urinario (norm 1-5 L/24h); poliuria in diabete mellito, diabete insipido (deficit ADH), insuff.
renale cronica, ipotiroidismo. Oliguria/Anuria (<200 ml/24h) in nefrite e insuff. renale terminale,
ostruzione vie urin.
↓ Clearance β2-microglobulina: shedding costante da cell., ↑ nel siero e si ritrova nelle urine in
corso di patologie mielo- linfo proliferative oppure per insuff. riassorbim. tubulare (marker migliore
d. creatinina)
Controllo renale del pH del sangue
Il princ. tampone del sangue è rappresentato dalla coppia HCO3 -/H2 CO3
Sec. l’equaz. di H-H, perché il pH sia 7,4 il rapporto HCO3 -/H2 CO3 deve essere 20:1
La diminuzione del pH del sangue (acidosi) può essere di origine respiratoria o metabolica (non
resp.): HCO3 -/H2 CO3 < 20:1
Acidosi respiratoria: ipoventilazione, enfisema, broncopolmonite, scompenso card. cong.
Acidosi metabolica: chetoacidosi diabetica, digiuno, insuff. escrez. renale H+, perdita HCO3 (diarrea, fistole biliari o intest.).
Compenso renale dell’acidosi resp: rene ↑ escrez. H+ e ↑ riassorbim. HCO3 Compenso resp. dell’acidosi metab: iperventilazione (seguita nel tempo da compenso renale con
ritenzione HCO3 -).
L’aumento del pH del sangue (alcalosi) può essere di origine respiratoria o metabolica (non resp.):
HCO3-/H2CO3 > 20:1
Alcalosi respiratoria: iperventilazione, febbre, embolia polmonare
Alcalosi metabolica: eccessiva introd. HCO3 -, perdita di H+ (vomito, sondino naso-gastrico),
diuretici
Compenso renale alcalosi resp: ↑ escrez. renale HCO3 - e ritenzione H+
Compenso resp. alcalosi metab: ipoventilazione
Valori di riferimento (sangue arterioso):
pH 7,35-7,45
Anion gap (Na+ + K+) – (Cl- + HCO3 -) 12-18 mEq/L
pCO2 35-45 mmHg
HCO3 - 22-26 mM
pO2 80-110 mmHg
% sat O2 >95
6-ENDOCRINOLOGIA
Gli ormoni sono segnali chimici prodotti da cellule specializzate, secreti nel sangue e che si legano
a specifici recettori sulle cellule bersaglio lontane dalla ghiandola endocrina, inducendo risposte
funzionali attraverso secondi messaggeri:
q segnali endocrini → long distance; segnali autocrini/paracrini → short distance
q bassa concentrazione (nM) → metodi di dosaggio molto sensibili (ELISA, RIA); spesso
dosaggi multipli in condiz. stimolaz/inibiz
q natura chimica: steroidi, proteine, derivati di amminoacidi
Steroidi: sintesi dal colesterolo in gh. surrenale, ovaio, testicoli, placenta; appena prodotti
attraversano membrana (no accumulo) → sangue → veicolati da proteine carrier → organo
bersaglio → recettore nucleare → effetti trascrizionali (lenti); lunga emivita (60-100 min). Carrierbound, long half- life, nuclear receptor.
Ormoni peptidici: insulina, glucagone, PTH, GH, PRL; sintetizzati come pro-ormoni (taglio
proteolitico → ormone); accumulati in granuli secretori. Ormoni glicoproteici: FSH, LH, TSH, hCG
(subunità α uguale x tutti, subunità β diversa). Solubili (no carrier). Breve emivita (<60 min).
Recettore sulla plasmamembrana → secondi messaggeri (effetto rapido). Carrier-unbound, short
half- life, membrane receptor.
Derivati di amminoacidi: adrenalina, noradrenalina, tiroxina (T4), triiodotironina (T3); adrenalina
e noradrenalina si comportano similmente agli ormoni proteici (carrier-unbound, short half- life,
membrane receptor); T3 e T4 si comportano similmente agli steroidi (carrier-bound, long half- life,
nuclear receptor).
Gli ormoni steroidi derivano tutti dal colesterolo
Gli ormoni derivati da amminoacidi: ormoni tiroidei e midollare surrene.
Ormoni tiroidei
tri- iodo-tironina
Ormoni midollare surrene
tiroxina
Meccanismi di trasduzione del segnale ormonale
Metodologie di dosaggio
Bioassay: basato su risposta biologica in animali o tessuti/organi in coltura (superato!)
Protein binding assay: basato sul legame tra ormone e proteina legante specifica: recettore
(receptor assay, estrogeni e progesterone), anticorpo anti-ormone (immunoassay, il + usato),
proteina carrier (thyroid binding globulin). Può essere marcato l’ormone oppure la proteina legante
(marcatura radioattiva, fluorescente o luminescente) e il dosaggio può essere di tipo competitivo o
non competitivo.
Assay
Marcatura
Rivelazione
3
RIA
H
scintill. liquida
125
I
contatore gamma
EIA o ELISAHRP
spettrofotometro
AP
β-galattosidasi
CLA
isoluminolo
luminometro (600 molecole!)
esteri acridina
FIA
fluorescina, rodamina fluorimetro
IPOTALAMO E IPOFISI
Ipotalamo : pareti e pavimento 3° ventricolo; connette sistema nervoso e sistema endocrino; è
collegato direttamente alla neuroipofisi (ipof. post) mediante neuroni che attraversano il peduncolo
ipofisario e mediante il circolo portale ipofisario all’adenoipofisi (ipof. ant). Produce PRF, TRH,
Gn-RH, GHRH, CRH
Ipofisi: nella sella turcica, soprachiasmatica, collegata all’ipotalamo mediante peduncolo ipofisario;
ipof. anteriore (tess. ghiandolare) produce GH, ACTH, PRL (proteine), TSH, LH e FSH
(glicoproteine); ipofisi posteriore (tessuto nervoso), deposito degli ormoni prodotti da neuroni
ipotalamici (ADH e ossitocina), rilasciati per stimol. osmocettori ipotal. o contraz. utero.
Feed-back
negativo
Una disfunzione ipotalamica (cause tumorali, infiammatorie, degenerative, congenite) si deduce
dalla valutazione della risposta ipofisaria alla somministrazione di RH ipotalamici sintetici.
Una eccessiva produzione ormonale ipofisaria è di solito causata da tumore e riguarda un solo
ormone (es. iperproduzione GH, gigantismo ipofisario/acromegalia a seconda che l’iperproduz.
inizi prima o dopo fusione epifisi).
Una insufficiente produzione ormonale ipofisaria può essere dovuta a tumore o ischemia (es.
ischemia/shock da travaglio - sindr. di Sheehan) e di solito comporta pan- ipopituitarismo (sintomi
da insuff. ormoni sessuali, tiroidei e surrenalici).
IPOFISI POSTERIORE
ADH (vasopressina)
q nonapeptide ciclico prodotto da neuroni ipotalamici (nucleo sopraottico) e depositato
nell’ipofisi post.
q rilascio stimolato da osmocettori ipotalamici (suff. variaz. 1-2% osmolalità sangue) oppure
da barocettori (atrio sin, arco aortico e carotide, sensibili a ↓ pressione sang.) (inibizione da
freddo)
q stimola riassorbimento H2 O nel tubulo convoluto dist. e collettore rene
q ipo-secrezione di ADH (tumori, traumi, interventi chir) provoca diabete insipido: poliuria
(10-12 L/die) e polidipsia;
q diagnosi mediante confronto osmolalità siero e urine e test disidratazione: deprivazione
acqua e misura Osm siero/urine dopo iniezione ADH (Osm urine ↑ >5% nel DI)
Ossitocina
q nonapeptide ciclico prodotto da neuroni ipotalamici (nucleo paraventricolare) e depositato
nell’ipofisi post.
q differisce per soli 2 aa da ADH
q rilascio stimolato da distensione uterina e stimol. mammaria
q stimola contraz. utero gravido e miocellule gh. mammaria
q ossitocina sintetica è utilizzata per ↑ contrazioni uterine e stimolare secrez. latte
ORMONI TIROIDEI
Sintesi e rilascio controllati da TRH ipotalamico e TSH ipofisario (feed-back neg. di T3 e T4)
q Uptake conc. di Iodio nella tiroide (anche di 99mTc, usato per imaging)
q Iodinazione delle tirosine della proteina precursore tireoglobulina (nel lume follicolare) →
monoiodotirosina (MIT) e diiodotirosina (DIT).
q Coniugazione enzimatica (perossidasi): MIT+DIT → T3 e DIT+DIT → T4
q Secrezione: riassorbimento tireoglobulina e proteolisi: T3 e T4 → sangue ; MIT e DIT
riciclate.
q 80% del T3 circolante deriva dalla de- iodinazione di T4 (fegato e rene); T4 è pro-ormone di
T3 (meno attivo, ma + conc. nel sangue)
q T3 e T4 nel sangue sono veicolati da proteine: TBG (thyroxine-binding globulin) e TBA
(thyroxine-binding albumin); solo T3/T4 liberi (FT3 e FT4) sono attivi.
q recettore T3 nucleare → effetti trascrizionali
q screening diagnostico iper/ipo-tiroidismo: dosaggio FT4 e TSH
Gozzo (ingl. goiter) semplice (es. da deficit I): aumento volume ghiandolare (in assenza di processi
infiamm./neopl.) supplisce a moderata insuff. ormonale; TSH/T4 anche normali; terapia: L-tiroxina
(inibisce produz. TSH)
Ipotiroidismo : primitivo (es. autoimmune, tiroidite cronica di Hashimoto) o secondario a insuff.
ipotal. o ipofisaria
Sintomatologia: faticabilità, rallentamento facoltà fisiche e mentali (memoria, apprendimento,
attenzione), dispnea da sforzo, intolleranza al freddo, crampi muscolari, secchezza cute e capelli,
gozzo (non sempre), iperlipidemia (↑colesterolo e trigliceridi) → mixedema (evoluzione
dell’ipotiroidismo grave) ispessimento sottocute da infiltrazione mucopolisaccaridi. Può evolvere
nel coma: ipotermia, depressione respiratoria, insuff. cardiaca con cardiomegalia e versamento
pericardico.
Ipotiroidismo congenito (cretinismo ): incidenza 1:5000 nati; screening diagnostico: dosaggio
TSH/TT4; letargia, ritardo sviluppo scheletrico e mentale (irreversibile), fenotipo caratteristico.
Test di laboratorio nell’ipotiroidismo
Ipertiroidismo: primitivo o secondario a tumore ipotal. o ipofisario
Sintomatologia (tireotossicosi: nervosismo, ansia, irritabilità, insonnia, tremore, sudorazione
eccessiva, intolleranza al caldo, prurito, tachicardia e aritmie (atriali), dimagrimento (perdita di
massa muscolare e adiposa), amenorrea, ↓colesterolo e trigliceridi, faticabilità e dispnea da sforzo.
Può esitare nella crisi tireotossica (a seguito di stress: infezione, anestesia): ipertermia (>40°C),
tachicardia, fibrillazione atriale, scompenso cardiaco congestizio, delirio, coma.
Test captazione 123 I o 99m Tc nella diagnosi differenziale dell’ ipertiroidismo: ↑captazione in morbo
di Grave’s (Basedow), adenoma tossico, tumore ipofisario; ↓captazione in tiroidite cronica
Ipertiroidismo primitivo o Morbo di Basedow: incidenza 0.4%; 6 volte + frequente nelle donne
(pubertà, menopausa, gravidanza). Base autoimmune (Ab anti recettore FSH causano stimolaz.
continua cell follicolare, rilascio T3/T4 e inibiz. rilascio TSH).
Sintomatologia: gozzo tireotossico, esoftalmo (da depositi mucopolisaccaridi spazio retro-orbitale),
mixedema pre-tibiale.
Test di laboratorio nell’ipertiroidismo
ORMONI CORTECCIA SURRENALICA
Famiglia
Princ.
ormone
Androgeni DHEA
Mineralcorticoidi
Glucocorticoidi
Controllo rilascio
CRF ipotal e ACTH
aldosterone Sist. reninaangiotensina e [K +]
plasma
cortisolo
CRF ipotal
(ritmo circadiano
stress) e ACTH ipofisi
ant
Princ. effetti
Mascolinizzanti: irsutismo, amenorrea, ↑massa
muscol.
↑ Riassorb Na+ e escrezione K+ rene
Metabolici (anti- insulina):
↑gluconeogenesi, glicogeno-sintesi,
catab. proteico e lipolisi
Anti- infiammatori e immunosoppressivi
Debole attività mineral-corticoide (vedi strutture)
Catabolismo epatico x glucuronazione → dosaggio nelle urine delle 24 ore (creatinina totale come
controllo interno)
Il sistema renina-angiotensina -aldosterone regola volume del sangue e pressione arteriosa:
IPERALDOSTERONISMO
PRIMARIO da adenoma surrenalico (Morbo di Conn) o iperplasia nodulare bilaterale
↑ [aldosterone] nel siero, che non varia con restrizione/carico Na+ orale
SECONDARIO (Sindrome di Conn) da eccessiva produzione renina (es. stenosi arteria renale)
↑ [renina] nel siero, che non varia con restrizione/carico Na+ orale
Segni e esami clinici: ipertensione diastolica (>95), ↓[K +] siero (e poss. ↑[Na+]) →debolezza
muscolare, alcalosi da ↑escrez. H+ (gradiente elettrico + favorevole)
IPOALDOSTERONISMO
PRIMARIO da insuff. surrenalica: acquisita (di solito associato a deficit gluco-corticoidi) o
congenita (deficit enzimi biosintesi)
SECONDARIO a malattia renale cronica
Sintomatologia: ↑[K +] siero, acidosi
Il sistema CRF-ipotalamico/ACTH regola la secrezione di cortisolo (e di androgeni
surrenalici):
Feed-back
negativo
*L’ipersecrezione di ACTH induce iperpigmentazione da MSH
IPERCORTISOLISMO
PRIMARIO (Morbo di Cushing) da adenoma/carcinoma surrenalico
SECONDARIO (Sindrome di Cushing)
da ipersecrez. ACTH da adenoma ipofisario
da produzione ectopica di ACTH (carcinoma polm)
IATROGENO da somm. cortisolo (secrez. cortisolo endogeno soppressa → riduzione graduale
terapia!)
Segni clinici e sintomi: adiposità tronco (fenotipo e facies caratt.), faticabilità, iperglicemia e
glicosuria, ipertensione diastolica, ↓massa muscolare, osteoporosi, suscettibilità infezioni,
linfopenia, irsutismo, amenorrea, alterazioni personalità. Iperpigmentazione solo nel Cushing
secondario!
Esami lab: ↑cortisolo plasma (e cortisolo e 17-OH corticoidi urinari), resistente a carico di
desametasone ; possibile ↓[K +] siero e alcalosi
Manifestazioni cliniche della sindr. di Cushing
IPOCORTISOLISMO
PRIMARIO (Morbo di Addison) atrofia idiopatica surrene (su base autoimmune), da infezione
(TBC), emorragia o tumore; ↓ cortisolo e aldosterone
SECONDARIO (Sindrome di Addison)
a insuff. secrezione ACTH ipofisi; aldosterone normale!
Segni clinici e sintomi: astenia grave, anoressia, perdita di peso, ipotensione (sincope),
iperpigmentazione cute e mucose esposte e non, nausea/vomito, mutamento personalità (irritabilità,
irrequietezza). Evoluzione fatale se non curata!
Esami lab: ↓ cortisolo plasma (e ↓ cortisolo e 17-OH corticoidi urinari) basale e resistente a carico
di ACTH (primario); ↓[Na+] e ↑[K +] siero e acidosi
ORMONI MIDOLLARE SURRENE
Cellule cromaffini midollare surrene e gangli sistema simpatico derivano da cresta neurale (come
tessuto nervoso!).
Producono dopamina, adrenalina (ingl. epinephrine) [→ nel sangue] e noradrenalina (ingl.
norepinephrine) [neurotrasmettitore locale] da tirosina.
Rilascio ↑ in condizioni stress (ansia, dolore, febbre).
Effetti: metabolici anti- insulina (↑catabolismo glucidi e lipidi) e cardiovascolari (↑pressione
sanguigna e frequenza cardiaca)
Catabolismo : catecol-O-metil transferasi (COMT) e monoamino ossidasi (MAO) trasformano adr.
e noradr. in normetadrenalina e metadrenalina e queste in ac. vanillilmandelico (VMA) →
escrezione urinaria
FEOCROMOCITOMA
Tumore midollare surrene iperproducente catecolamine.
Segni clinici e sintomi: episodi ricorrenti di ipertensione sistolo-diastolica (>160/95), cefalea,
sudorazione e pallore, palpitazioni, tremito.
Dosaggio catecolamine plasma e dosaggio metanefrina e VMA nelle urine (24 ore).
Dosaggio VMA e omovanillico (HVA, catabolismo dopamina) urinari nella diagnosi
neuroblastoma (tumore pediatrico midoll. surrene)!
ORMONI SESSUALI
Ormoni sessuali femminili
Rilascio ciclico: fase follicolare e fase luteale (c.a. 14 gg. ciascuna); regolaz. a feed-back negativo
ovaio-ipofisi
Fase follicolare: Gn-RH ipotalamico stimola rilascio FSH ipofisario → stimolaz accrescimento
follicolo ovarico (ovocita e cell. follicolari) → follicolo maturo. Cell. follicolari (tecali) producono
estrogeni → proliferaz. mucosa uterina → inibizione secrez. FSH e stimolaz. secrez. LH → picco
LH → ovulazione
Fase luteale: follicolo (espulso uovo) diventa corpo luteo → cell. follicolari (granulosa) producono
progesterone. In assenza di hCG dall’uovo fecondato, corpo luteo degenera in c.a. 14 gg. → cessa
produz. progesterone → mestruazione.
Ormoni sessuali maschili
Regolaz. a feed-back negativo testicolo- ipofisi
Gn-RH ipotalamico stimola rilascio LH ipofisario → testosterone e estradiolo da cell. interstiziali
(Leydig) testicolo.
Bambini
Femmina
Fase foll
Fase luteale
Post-menop.
Maschio
Testosterone
ng/dl
<3-10
20-75
300-1000
Estrogeni
pg/ml
<25
60-200
160-400
8-30
20-80
Progesterone
ng/dl
7-52
15-70
200-2500
<130
13-97
FSH
mU/ml
<1-3
1-9 → 26
1-9
30-120
1-7
LH
mU/ml
<1-5
1-12 → 104
1-12
16-60
1-8
Ormone
Origine
Azione
↑ Rilascio cortisolo e androgeni
surrene
Aldosterone Cortic. surrene ↑ riass. renale Na+ e escrez. K+/H+
ADH
Ipofisi post
↑ Riass. H2 O tubulo renale
Catecolamine Midoll. surrene ↑Catabolismo gluc./lip.
Effetti cardiocirc.
ACTH
Ipofisi ant
Conc. plasma
a.m. 8-80 pg/ml
p.m. 7-30 pg/ml
6-30 ng/dl
2-4 µU/ml
adr. <140 pg/ml
nor. <1700 pg/ml
Cortisolo
Cortic. surrene ↑catabolismo lipidico e proteico
immunosoppressivo
a.m. 9-25 µg/dl
p.m. 3-16 µg/dl
(5-25 mg/die)
Estradiolo
Ovaio
Fase foll.60-200pg/ml
Fase lut. 160-400pg/ml
FSH
Ipofisi ant
GH
Glucagone
Insulina
Caratteri sessuali femm.
Accresc. follicolare; spermatogenesi Fase foll./lut. 1-9
ovul. 6-26 mU/ml
Ipofisi ant
Mobilizza grassi e conserva
2-7 ng/ml
glucoso (anti- insulina),
prolif. osso, cartil., muscolo
50 pg/ml (~2 pM)
Cell. αpancreas Metab. zuccheri e grassi
Cell. βpancreas Metab. zuccheri e grassi
2-16 µU/ml (~40 pM);
raggiunge un picco di 6-10
volte il valore basale dopo 30 o
60 minuti da carico di glucosio
LH
Ipofisi ant.
Ovulazione; sintesi testosterone
ossitocina
progesterone
PTH
testosterone
Ipofisi post.
Corpo luteo
Gh. paratiroidi
testicolo
TSH
T3
Ipofisi ant.
Tiroide
T4
Tiroide
Contraz. utero e gh. mamm.
Prepara utero a gestaz.
Aumenta [Ca2+] plasma
Spermatogenesi, caratt. sessuali
masch.
↑Rilascio ormoni tiroidei
↑termogenesi; ↑catab. glucidico e
proteico; sviluppo pre- e post-natale
SNC, cuore, scheletro.
Pro-ormone di T3
Fase foll.16-100 mU/ml
Fase lut. 1-12 mU/ml
1.5 pg/ml
Fase lut.200-2500 ng/dl
0.3-0.8 ng/ml
300-1000 ng/dl
0.5-5 µU/ml
TT3 60-200 ng/dl
FT3 0.1-0.4 ng/dl
TT4 5-15 µg/dl
FT4 1.5-2.5 ng/dl
Alcuni fattori simil-ormonali (proteici) con effetti autocrino/paracrini : citochine
Fattore di crescita
Abbreviazione
Azione principale
Vascular endothelial GF
VEGF
Proliferazione cell. endoteliali
Granulocyte macrophagestimulating factor
GM-CSF
Proliferazione precursori mielo.
Interferon α, β, γ
IFN- α, -β, -γ
Antivirale, anti-proliferativa
immuno-soppressiva
Insulin- like growth factor I IGF-I e-II
e II
Media effetto GH (IGF-I)
Stimola proliferazione cell.
Monocyte chemoattractant MCP-1
protein-1
Chemoattrattore per monociti
Stimola proliferaz. miociti vascol.
Nerve growth factor
NGF
Proliferazione neuronale
Platelet-derived growth
factor
PDGF
Chemiotassi mono.; Stimola
proliferazione cell.
Transforming growth
factor-α, -β
TGF-α, -β
Stimola proliferazione cell.
Tumor necrosis factor-α, -β TNF-α, -β
Inibiz. proliferaz. cell.,
stimola attivazione cell. infiammatorie
Esempi di approcci terapeutici innovativi indirizzati verso citochine :
q Prevenzione degenerazione maculare con aptamers anti-VEGF
q Prevenzione lesioni aterosclerotiche con peptidi anti-MCP-1
Aptamers :
brevi
sequenze (30-70mers)
aminoacidiche
o
nucleotidiche (DNA o
RNA) che riconoscono
specificamente e con
grande affinità piccole
molecole (es. farmaci),
siti attivi di enzimi o
proteine,
acidi
nucleici. Gli aptamers
si comportano come
“mini-anticorpi”
in
grado
di
legare
molecole di varia
natura chimica.
Ormoni eicosanoidi
Prostanoidi (prostaglandine e trombossani) e leucotrieni
Ormoni locali (effetto autocrino/paracrino) a breve emivita, a struttura lipidica.
Derivano da acidi grassi essenziali (no sintesi animale): linoleico (18:2 ∆9,12) e α-linolenico (18:3
∆9,12,15). Due famiglie: ω-6 (pro-infiammatori) e ω-6 (anti- infiammatori).
Due vie enzimatiche: COX e LOX
NSAID
cortisone
COX-1 e -2
trombossani
prostaglandine
Metabolismo acidi grassi essenziali
Prodotti dell’attività COX e LOX sull’acido arachidonico
Effetti funzionali di alcuni ormoni eicosanoidi
Ormone
PGD2
PGE2
Cellula produttrice
Effetto funzionale
mast cellule
↓ aggregaz. piastrinica e proliferaz. linf. T, vasodilatazione
rene, cuore, milza
↑aggregaz. piastrinica e contraz. uterina, vasodilatazione
↓ proliferaz. linf. T
PGF 2a
PGI2
rene, cuore, milza
cellule endoteliali
vaso- e bronco-costrizione
↓aggregaz. Piastrinica, vasodilatazione, ↓ proliferaz. linf. T
TXA2
piastrine
vaso- e bronco-costrizione, ↑aggregaz. piastrinica
LTB4
mono- e granulociti chemiotassi leucocitaria
mast cellule
↑ permeabilità vascolare
↑ proliferaz. linf. T e secrez. IFN- γ, IL-1 and IL-2
7- Cuore
Diagnosi di laboratorio dell’infarto del miocardio
Non esiste al momento un singolo marcatore di danno miocardico con le seguenti caratteristiche:
specifico x miocardio, sensibile, reversibile, proporzionale al danno tessutale, semplice da dosare.
Quindi: la diagnosi di cardiopatia richiede una combinazione di marcatori:
enzimi e proteine
Creatina fosfo-cinasi (CPK o CK)
Catalizza reazione: Creatina-P + ADP ↔ Creatina + ATP
formata da 2 subunità (B o M): 3 forme isoenzimatiche
CK1 (CK-BB) cervello aumenta nel siero in seguito a danno barriera emato-encefalica
CK2 (CK-MB) la + specifica x miocardio, ma solo 20% della CK cardiaca
CK3 (CK-MM) muscolo scheletrico
CK2 (immunoassay) aumenta entro 3 ore (nel 50% dei pazienti) e entro 6 ore (80% dei pazienti)
dall’infarto mioc (AMI). Valori normali entro 6-8 ore da sospetta ischemia escludono infarto.
Lattico deidrogenasi (LDH o LD)
Catalizza reazione: lattato + NAD+ ↔ piruvato + NADH + H+
Formata da 4 subunità (H e M): 5 forme isoenzimatiche
LD1 e LD2 sono le forme + specifiche x miocardio (importante il rapporto: LD1>LD2)
Inizia ad aumentare dopo 6-12 ore dall’infarto, picco dopo 1-3 giorni, torna normale dopo 8-14
giorni.
Di scarso interesse diagnostico, a meno che CK già tornata normale
Mioglobina (Mb)
Aumenta dopo 2-4 ore dall’MI e torna normale dopo 24 ore. Valori normali entro 6-8 ore da
sospetta ischemia escludono MI. Utile come indicatore di recidiva (24-36 ore).
Troponina T (TnT)
Aumenta dopo 2-4 ore (come CK-MB e Mb), picco dopo 48 ore, seguito da plateau x 5-10 giorni.
Diagnostica di MI fino a 6 giorni dopo infarto (utile nei casi che giungono tardi alla diagnosi).
Troponina I (TnI)
Aumenta dopo 3-8 ore, picco dopo 12-24 ore, seguito da plateau x 5-7 giorni
aumento rispetto vaori normali
Profilo valori plasmatici dei tipici marcatori cardiaci
7
6
5
CK-MB
4
Mb
3
TnI/TnT
2
1
0
0
4
8
12
16
20
24
28
32
36
ore dopo infarto acuto miocardio
40
44
48