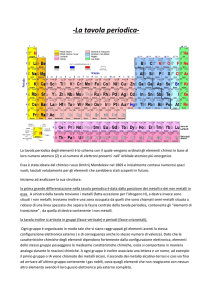
Tavola periodica
Oggi le varie applicazioni della chimica sarebbero molto più complesse se non fosse presente un
raggruppamento dei componenti chimici che faccia da riferimento.
Tutti i differenti atomi esistenti sono stati disposti su di una tavola seguendo le loro caratteristiche; gli
atomi con proprietà identiche appartengono allo stesso elemento. Con questo processo si è data origine
alla tavola periodica.
Storia
Furono svolti vari tentativi di raggruppamento, ma il primo abbozzo della tavola periodica fu fatto da
Mendeleev nel 1869. Lo scienziato seguì la legge periodica la quale
indicava che quando gli elementi sono sistemati in ordine di massa
relativa crescente, alcune loro proprietà si ripetono periodicamente.
Questa periodicità era definita ogni 8 elementi così Mendeleeev dispose
gli elementi con proprietà simili in colonne verticali. Ma tutte le proprietà
identificate non erano ricoperte dai soli 65 elementi conosciuti a quel
tempo. Lo scienziato fu in grado di individuare proprietà di elementi ancora sconosciuti, lasciando vuoti i
posti non associati ad alcun elemento; determinando una tavola con dei spazi liberi, colmati poi con
elementi neoscoperti lungo il corso degli anni. Pochi anni dopo furono scoperti i gas nobili così che alla
tavola venne aggiunta una colonna.
Alla legge periodica venne effettuata una modifica; fu sostituita la massa relativa crescente con il numero di
protoni cioè numero atomico (Z). Tutt’ora gli elementi sono elencati in ordine di numero atomico, il quale
definisce l’elemento. Con ciò si giunse al completamento dell’attuale tavola periodica comprendente tutti
gli elementi esistenti, in totale 116.
Isotopi
La correzione alla legge periodica venne effettuata da Moseley. Fu possibile con la scoperta dell’esistenza di
alcuni atomi appartenenti allo stesso elemento, aventi però diverso numero di protoni, chiamati isotopi.
Infatti una variazione del numero di neutroni determina un diverso numero di massa (A), ovvero la somma
dei neutroni e dei protoni, e una diversa massa.
La massa atomica di un elemento è la massa media degli atomi che compongono quell’elemento. È
calcolata dalla sommatoria del prodotto delle abbondanze naturali percentuali (percentuale dell’isotopo in
natura) e della masse degli isotopi.
Massa atomica= ∑𝑁
𝑖=1 (𝑎𝑏𝑏𝑜𝑛𝑑𝑎𝑛𝑧𝑎 𝑛𝑎𝑡𝑢𝑟𝑎𝑙𝑒𝑖 ∗ 𝑚𝑎𝑠𝑠𝑎 𝑑𝑒𝑙𝑙′𝑖𝑠𝑜𝑡𝑜𝑝𝑜𝑖 )
Nome e simbolo degli elementi
Ogni elemento ha un proprio nome e simbolo chimico.
L’assegnazione dei nomi non seguì una regola principale ma fu ispirata da:
-
Nomi associati alle proprietà degli elementi
Nomi di paesi e nazioni
Nomi di scienziati
Il simbolo di ogni elemento è composto al massimo da due lettere, la prima maiuscola la
seconda minuscola; si rifanno all’abbreviazione latina o inglese.
Suddivisioni della tavola periodica
La tavola periodica può essere suddivisa in:
1. Periodi
Le righe vengono chiamate periodi, sono 7 e indicate con numeri arabi. Gli elementi che sono disposti sullo
stesso periodo appartengono allo stesso numero quantico principale, cioè hanno uguale numero di orbitali
atomici.
2. Gruppi
Le colonne vengono chiamate gruppi o famiglie di elementi.
Gli elementi che appartengono allo stesso gruppo hanno uguale
numero di elettroni di valenza quindi i legami chimici a cui danno
origine sono gli stessi; si dice che hanno caratteristiche simili.
C’è un ulteriore suddivisione all’interno dei gruppi:
Gruppi principali
Gli elementi dei gruppi principali (nella figura in rilievo) fanno
parte delle prime due colonne e delle ultime sei e sono numerate da IA a VIIA (o per IUPAC 1,2, e da 13 a
18)
1° gruppo alcalini (metalli molto reattivi)
2° gruppo alcalino-terrosi (reattivi)
5° gruppo alogeni (non metalli molto reattivi)
6° gas nobili (sono chimicamente inerti in quanto hanno l’ultimo orbitale stabile)
Sono più facili da comprendere perché si possono prevedere le loro proprietà attraverso la posizione che
ricoprono nella tavola periodica.
Gruppi di transizione
Gli elementi di transizione (nella figura non in rilievo) sono quelli che si trovano tra i primi due e gli ultimi
sei gruppi e sono numerati nel seguente ordine: IIIB IVB VB VIB VIIB VIIIB (tre gruppi) IB IIB. Oppure per la
IUPAC sono numerati da 3 a 12.
Le loro proprietà sono più complesse da definire rispetto agli elementi principali.
Lantanidi ed attinidi
I lantanidi ed attinidi per convenzione sono spesso mostrati come due righe aggiuntive fra bario e afnio, e
radio e rutherfordio; in una tavola larga sono inseriti nei posti adeguati (sesto e settimo periodo).
I lantanidi o lantanoidi sono 14 elementi con numero atomico da 58 a 71. Venivano definiti “terre
rare”, ma in realtà costituiscono il 0,012% della crosta terrestre. I loro elettroni più esterni sono
collocati nell’orbitale f.
Gli attinidi o attinoidi sono 14 elementi con numero atomico da 90 a 103; sono molto simili tra loro.
Tutti esclusi i primi quattro sono elementi artificiali.
Metalli e non metalli
Nella tavola periodica è presente una linea zig zag che divide i metalli dai
non metalli andando dal boro all’astato. Tutti gli elementi che poggiano su
questa linea sono detti semimetalli (in viola): B,Si,Ge,As,Sb,Te,Po,At. La loro
conducibilità elettrica può essere modificata e controllata. Spesso utilizzati
come materiali costituenti dei dispositivi elettronici.
Gli elementi a sinistra della linea sono metalli (in azzurro). Questi hanno
proprietà simili tra loro:
tendono a cedere elettroni quando sono coinvolti in una reazione chimica
lucenti
buoni conduttori di calore ed elettricità
malleabili e duttili
Gli elementi al lato destro della linea sono i non metalli (in rosso), hanno molte proprietà diverse ma li
accomuna la tendenza ad acquistare elettroni nelle reazioni chimiche e la caratteristica di essere cattivi
conduttori di elettricità e di calore.
Blocchi
La tavola periodica può essere suddivisa in 4 blocchi:
blocco s (azzurro) IA, IIA ed elio: elementi che hanno
l’ultimo elettrone in un orbitale s
blocco p (viola) da IIIA a VIIIA: elementi che hanno
l’ultimo elettrone un orbitale p
blocco d (giallo) gruppi B: elementi che hanno l’ultimo elettrone in un orbitale d
blocco f (verde) lantanidi e attinidi: elementi che hanno l’ultimo elettrone in un orbitale f
Configurazione elettronica a partire dalla tavola periodica
Gli elettroni di valenza si trovano nell’orbitale più esterno; quelli interni che sono negli orbitali più vicini al
nucleo. Dai diversi blocchi è possibile risalire alla configurazione elettronica degli elettroni di valenza di ogni
elemento. Ciò si effettua senza procedere con le normali regole della configurazione elettronica: principio
di esclusione di Paoli, regola di Hund e regola della perpendicolare.
La configurazione elettronica è data nel seguente modo:
la configurazione degli elettroni interni abbreviata mettendo tra parentesi quadre il gas nobile che
precede l’elemento
il numero quantico relativo all’orbitale s e p corrisponde al numero del periodo
il numero quantico principale degli orbitali d ed f corrisponde al numero quantico principale del
periodo meno uno;
il nome dell’orbitale è dato dal blocco di appartenenza
il numero di elettroni nell’orbitale è dato dal gruppo di appartenenza dell’elemento relativo al
blocco
Eccezione per il cromo (4s1 3d1) ed il rame (4s1 3d10).
Proprietà periodiche
L’orbitale più esterno se non è completo tenta di ottenere la configurazione del gas nobile più vicino
acquistando o cedendo elettroni; formando legami chimici ionici o covalenti che dipendono dalle proprietà
periodiche.
Elettronegatività
L’elettronegatività è la tendenza dell’atomo ad attirare su di
se gli elettroni di legame. Lungo i periodi della tavola
periodica da sinistra verso destra aumenta mentre lungo i
gruppi dall’alto verso il basso diminuisce (i gas nobili hanno
l’elettronegatività pari a zero): l’elemento più elettronegativo
è il fluoro. È una grandezza adimensionale che si scrive su una
scala che va da 0 a 4.
Se i due atomi che si legano hanno una differenza di
elettronegatività da 0 a 0,4 il legame risulta essere covalente apolare; se va da 0,4 a 2 legame covalente
polare, se è superiore a 2 si genera un legame ionico quindi si forma un catione (carico positivamente) e un
anione (carico negativamente).
Nel legame covalente polare gli elettroni condivisi passano più tempo intorno all’atomo più elettronegativo
determinando una parziale carica positiva (atomo meno elettronegativo) e una parziale carica negativa
(atomo più elettronegativo). Un esempio di questo legame è la molecola di H2O
Affinità elettronica
L’affinità elettronica è l’energia che si libera quando un atomo neutro acquista un elettrone,
trasformandosi in anione. Aumenta lungo i periodi e diminuisce lungo i gruppi. I gas nobili non hanno
affinità elettronica in quanto sono stabili.
Energia di ionizzazione
È la quantità di energia necessaria per estrarre un elettrone da un atomo
allo stato gassoso.
Es. K + energia di ionizzazione → K+ + 1 eVerso destra lungo un periodo della tavola periodica cresce. Un atomo,
che necessità di meno elettroni per raggiungere la configurazione del gas
nobile successivo, ha un energia di ionizzazione maggiore rispetto a un
atomo che necessita di un maggior numero di elettroni.
Verso il basso lungo un gruppo, l’energia di ionizzazione diminuisce.
Maggiore il numero quantico principale di un atomo più grandi sono gli
orbitali esterni, quindi gli elettroni di valenza più lontani dal nucleo (meno
fortemente legati ad esso) possono essere estratti con più facilità.
Esempio Be ha un energia di ionizzazione maggiore rispetto a Sr ma minore rispetto a N. Infatti Be per
raggiungere la configurazione del gas nobile precedente (He) deve cedere meno elettroni di quelli che
dovrebbe acquisire per raggiungere quella del gas nobile successivo (Ne). Mentre N per raggiungere la
configurazione di Ne deve aggiungere solo 3 elettroni rispetto ai 5 che dovrebbe cedere per raggiungere la
configurazione di He.
Be ha una massa minore di Sr per questo i suoi elettroni di valenza sono legati al nucleo con un’energia
maggiore rispetto a quelli di Sr; così che si possono estrarre con più facilità.
Dimensione atomica
La dimensione atomica è la distanza tra il nucleo e gli elettroni più esterni.
Lungo il periodo la dimensione atomica decresce verso destra. Infatti nel
nucleo si concentrano sempre più protoni rispetto agli elettroni situati negli
orbitali più interni; determinando una diminuzione della distanza tra il
nucleo e i primi elettroni che ha come conseguenza la riduzione di tutta la
dimensione atomica.
Scendendo lungo una colonna si ha un aumento della dimensione atomica
dovuto all’ aumento del numero quantico che fa aumentare il numero di
orbitali.
Carattere metallico
Il carattere metallico è la tendenza dell’atomo a perdere elettroni. Il nome deriva dall’alta tendenza dei
metalli a cedere elettroni. Dato che l’energia di ionizzazione dipende dalla tendenza di attrarre elettroni a
se, le due proprietà saranno inversamente proporzionali. Di conseguenza il carattere metallico verso destra
lungo i periodi diminuisce mentre in basso lungo i gruppi aumenta. Quindi ha una crescenza uguale alla
dimensione; aumentando la dimensione gli elettroni più esterni sono meno attratti dal nucleo e possono
essere ceduti più facilmente.
Proprietà dell’elemento nella tavola periodica
Per ogni elemento sono riportate le seguenti caratteristiche, alcune a volte sono omesse:
Nome
Simbolo
Numero atomico (Z)
Temperatura di fusione
Temperatura di ebollizione
Energia di ionizzazione
Elettronegatività
Massa atomica relativa
Numero di massa (A)
Densità
Configurazione elettronica
Numeri di ossidazione (carica che assumerebbe l’elemento se gli elettroni di legame fossero
attribuiti al quello più elettronegativo)