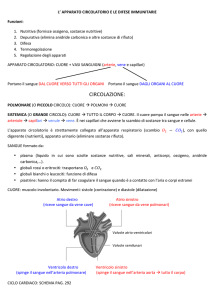
Ag-Ab
Reazione Antigene-Anticorpo
Immunocomplesso: reazione dell’antigene con il corrispondente anticorpo con
formazione di un complesso tenuto insieme da legame chimico , non covalente che
si forma tra i residui amminoacidici dell’Ag (antigene) e quelli del sito combinato
dell’anticorpo.
Tipi di legame :
o Legame idrogeno : atomo di idrogeno è condiviso da due atomi
elettronegativi
o Legame elettrostatici : attrazione di carice elettriche di segno
opposto
o Forze di Van der Waals : movimento degli elettroni di una
molecola che la inducono a comportarsi in maniera temporanea
come un dipolo , attraendole molecole vicine
o Legami idrofobici : determinati quando una molecola idrofobica si
trova in acqua. Le molecole idrofobiche si aggregano per evitare il
solvente.
Reazione Antigene-Anticorpo
Affinita : somma algebrica delle forze attrattive e repulsive tra antigene ed anticorpo
Avidità : insieme delle forze d’interazione tra i singoli siti combinatori
dell’anticorpo e l’antigene
Immunoprecipitazione
Rappresenta la formazione di un complesso tridimensionale detto lattice che
determina un precipitato visibile. Può essere utilizzata sia in modo qualitativo che
quantitativo
Precipitazione quantitativa
Si ottiene facendo reagire quantità costanti di anticorpo con quantità crescenti
d’antigene. La precipitazione è dovuta alla formazione di un reticolo di molecole
antigene-anticorpo.
Reazione di precipitazione
Le reazioni di precipitazione sono utilizzate per evidenziare la presenza
dell’antigene oppure dell’anticorpo. Vengono utilizzati reazioni in mezzi
semisolidi (agar) :
Immunodiffusione doppia
Immunodiffusione doppia
• Se gli antigeni sono
identici : si forma una linea
continua del precipitato
• Se gli antigeni sono diversi :
si hanno due linee di
precipitato che si incrociano
• Se l’antigene A possiede degli
epitopi in comune con l’antigene B
: si forma una linea di precipitato
non continua
Immunodiffusione radiale
Viene detto anche metodo di Mancini . Usato per la determinazione quantitativa
dei livelli delle immunoglobuline e dei componenti del complemento presenti sia
nel siero che in altri liquidi.
Il metodo consiste :
• Stratificare l’agar in cui è stato aggiunto un
antisiero specifico in piastre di petri
• Si effettuano dei pozzetti
• Si aggiunge l’antigene
• L’antigene diffondendo dà origine ad un
alone di precipitazione
• Il diametro dell’alone è proporzionale alla
concentrazione dell’antigene
Immunoelettroforesi
Metodo utilizzato per l’analisi delle proteine del siero . Essa si basa su una
reazione di precipitazione preceduta da una migrazione elettroforetica del siero.
Il metodo si basa :
• Si stratifica l’agar su un vetrino porta oggetto
• Si crea un pozzetto in cui si pone il siero da esaminare
• Si applica un campo elettrico
• Le proteine migreranno secondo la loro carica elettrica e la loro mobilità
• Separate le proteine si pratica un altro pozzetto parallelo al senso di migrazione
e vi si aggiunge l’antisiero
• Si lascia diffondere l’antisiero
• Nella zona di incontro tra antigene ed anticorpo si forma la banda di
precipitazione
Western Blot ( Immunoblot )
Questo metodo viene utilizzato per identificare e caratterizzare gli Ag sia nella
ricerca sia nella clinica.
Il metodo consiste nel :
• Separare gli antigeni attraverso l’utilizzo di un gel di poliacrilammide
• Trasferire il gel su una membrana di nitrocellulosa
• Aggiungere un anticorpo specifico per l’Ag ricercato marcato con un marcatore
enzimatico
• L’anticorpo si collocherà solo dove la reazione sarà avvenuta permettendo di
analizzare con facilità la quantità e la presenza dell’Ag
• In alternativa può essere utilizzato un anticorpo marcato con un tracciante
radioattivo.
Western Blot ( Immunoblot )
Agglutinazione
L’interazione tra un anticorpo e un antigene corpuscolato ( presente su batteri,
eritrociti, leucociti, ecc) determina la formazione di aggregati visibili, definita
agglutinazione. L’anticorpi in questo caso prenderanno il nome di agglutinine.
Titolo anticorpale del siero
Inibizione dell’agglutinazione
E’ un saggio altamente sensibile per evidenziare piccole quantità di Ag (
es. droghe) oppure per determinare se un soggetto è stato esposto ad
alcuni virus che causano l’agglutinazione dei globuli rossi ( es. rosolia ,
influenza, ecc)
In pratica se nel siero del paziente sono presenti Ab contro un virus , essi
reagiranno con questo, quindi il virus non sarà più in grado di agglutinare i
globuli rossi aggiunti in un secondo momento
Le reazioni d’agglutinazione sono utilizzate anche per determinare i gruppi
sanguigni di un paziente (emoagglutinazione) oppure per ricercare un
anticorpo legato ad un antigene ( test di Coombs).
Emoagglutinazione
Viene utilizzata per determinare il gruppo sanguigno utilizzando anticorpi anti-A, antiB, anti-AB
Test di Coombs
Test di Coombs diretto
• I globuli rossi del paziente vengono lavati per allontanare le IgG non legate alla
membrana
• I globuli rossi vengono posti direttamente a contatto con il siero di Coombs
• Si stabilisce cosi se i globuli rossi sono stati ricoperti in vivo da IgG , come
accade nelle malattie emolitiche autoimmuni
• Test positivo : le emazie agglutinano , significa che gli Ab del coniglio si sono
legati agli Ab adesi sulla membrana degli eritrociti .
Test di Coombs indiretto
• Gli eritrociti vengono lavati per rimuovere le IgG non legate alle membrane .
• Si incubano i globuli rossi del paziente o degli eritrociti compatibili con il siero del
paziente e successivamente con il siero di Coombs.
• Il test viene detto indiretto perche il siero del paziente è incubato con eritrociti
normali per far aderire gli eventuali anticorpi anti-eritrocitari.
• Test positivo : i globuli rossi agglutinano , quindi nel siero testato vi è la presenza
di Ab.
Immunoflorescenza
Permette di legare ad alcuni anticorpi delle sostanze fluorescenti , senza alterarne la
capacità di legarsi agli antigeni
Le sostanze fluorescenti in questione sono :
• La fluorosceina
• La rodamina
Le sostanze fluorescenti coniugate agli anticorpi possono evidenziare al microscopio
a fluorescenza la presenza di :
• Antigeni di superficie di cellule viventi in sospensione
• Antigeni presenti nel citoplasma
• Antigeni presenti nei nuclei
Il metodo viene utilizzato per identificare :
•
•
•
•
•
•
fenotipi cellulari
i componenti del complemento
antigeni tissutali
antigeni tumorali
batterici
virali
Immunoflorescenza diretta ed
indiretta
Esistono due metodi :
• Metodo diretto : l’anticorpo specifico coniugato al fluorocromo si fa
direttamente aderire agli antigeni cellulari
• Metodo indiretto : l’anticorpo specifico ( anticorpo primario) non
coniugato si fa aderire agli antigeni cellulari , in una seconda fase , si
aggiunge un anticorpo anti- anticorpo primario, coniugato con il
fluorocromo.
FACS
( fluorescence- activated cell sorter )
Si basa sul principio della citometria a flusso . Viene utilizzato un raggio laser e un
rivelatore di luce per contare le cellule
FACS
( fluorescence- activated cell sorter )
La citometria a flusso si basa sul seguente principio:
• Un campione, contenente le cellule,è incubato con un Ab monoclonale
marcato con un fluorocromo
• Le cellule che hanno legato ai loro antigeni di membrana l’Ab
fluorescinato vengono eccitati dal raggio laser ed emettono la luce
• Il rilevatore della luce misura sia la grandezza sia il numero delle cellule
che hanno legato l’Ab marcato
• Un computer analizza questi parametri e crea un diagramma in cui sono
riportate il numero delle cellule e la loro tipologia
RIA
( saggio radioimmunologico)
E’ una tecnica molto sensibile che può rivelare la presenza di un antigene o di
un anticorpo a concentrazioni inferiori a 0,001 pg/ml.
Il test RIA si basa sulla competizione tra un antigene radio marcato ed uno non
marcato per un anticorpo specifico ad alta affinità.
L’antigene è marcato generalmente con piccole quantità di un isotopo radioattivo
( per es. I251 ) che emette raggi gamma ( γ )
RIA
( saggio radioimmunologico)
• Se si vuole determinare la concentrazione di un antigene X , presente nel
siero , lo si purifica e lo si marca con I 251
• Si allestiscono una serie di provette contenenti una quantità costante
d’antigene X radiomarcato e di anticorpi anti-antigene X
• Si aggiunge una quantità crescente del siero in esame , in cui è presente
l’antigene da testare.
• L’anticorpo si può legare sia all’antigene marcato sia all’antigene non
marcato, quindi i due tipi d’antigene competono per legare l’anticorpo.
• Si misura con un contatore gamma la quantità d’antigene marcato rimasto in
soluzione e quindi per differenza si può determinare la concentrazione di
antigene non marcato.
ELISA
( enzyme-linked immunosorbent assay)
E’ una tecnica simile al RIA ma è più sicuro è meno costoso
Viene utilizzata per evidenziare la reazione antigene -anticorpo
Si utilizza un marcatore enzimatico contrariamente al RIA in cui si utilizza un
marcatore radioattivo
Sono impiegati vari enzimi tra cui :
• la β-galattosidasi
•La fosfatasi alcalina
•La perossidasi di rafano
Il test si basa sul fatto che un enzima coniugato ad un anticorpo reagisce con un
substrato incolore, detto substarto cromatogenico, e dà origine a un prodotto di
reazione colorato.
L’intensità del colore è proporzionale alla quantità d’anticorpo marcato che si lega
all’antigene.
ELISA
(metodo indiretto)
Viene utilizzato per determinare la quantità di
anticorpi. Si basa sul seguente procedimento:
• In un micropozzetto ricoperto d’antigene si
aggiunge il campione da analizzare ( siero o
un altro campione , in cui è presente
l’anticorpo da testare, detto Ab primario e lo si
lascia reagire con l’antigene.
• Si aggiunge un anticorpo secondario anti-Ab
primario, coniugato ad un enzima.
• Si lava via l’Ab secondario libero e si
aggiunge il substrato per l’enzima.
• La quantità di prodotto di reazione colorato,
che si forma , viene valutata mediante speciali
lettori spettrofotometrici
• I lettori spettrofotometrici possono misurare
l’assorbanza di una piastra a 96 pozzetti .
ELISA
(metodo indiretto)
Il test ELISA è utilizzato anche per determinare la presenza di anticorpi
sierici diretti contro il virus dell’immunodeficienza umana ( HIV), antigene
eziologico dell’ AIDS.
In questo caso le proteine ricombinanti dell’involucro e del core dell’HIV (Ag)
vengono adsorbite nei micropozzetti.
E’ possibile evidenziare la presenza di anticorpi sierici diretti contro l’HIV,
mediante l’ELISA indiretto , entro 6 settimane dall’infezione
ELISA
(a sandwich)
Viene utilizzato per determinare la quantità
dell’antigene.
ELISA sandwich :
• il micropozzetto è ricoperto con l’anticorpo
primario
• Viene aggiunto il campione contenente
l’antigene da misurare
• Dopo un periodo di incubazione si aggiunge
un anticorpo specifico per l’antigene coniugato
con un enzima.
• Si lava via l’Ab secondario libero e si
aggiunge il substrato dell’enzima.
• L’intensità del colore è proporzionale alla
quantità di anticorpo secondario marcato che si
lega all’antigene, e quindi alla concentrazione
dell’Ag.
ELISA
(competitivo)
ELISA competitivo :
• E’ un test di inibizione la concentrazione dell’Ag
è inversamente proporzionale al colore
sviluppato.
• Si incuba l’anticorpo primario con il campione
contenente l’Ag da misurare
• Si aggiunge la miscela Ag-Ab formatasi ai
micropozzetti contenenti l’Ag.
• Maggiore è la quantità di Ag, presente nel
campione , minore sarà la quantità di anticorpo
primario libero.
• Si aggiunge l’anticorpo secondario, specifico
per l’Ab primario, coniugato con un enzima.
• Dopo aver lavato via l’Ab secondario si
aggiunge il relativo substrato e si misura il
prodotto di reazione colorato
Complemento
• E’ formato da un complesso sistema multifattoriale, costituito da oltre 20 proteine sieriche
, che ha la funzione di distruggere i batteri tramite la lisi o la fagocitosi.
• Soggetti affetti da deficit quantitativo o funzionale del complemento pur avendo livelli
normali di Ig, sono particolarmente esposti a ripetute infezioni.
• Le molecole del complemento si trovano nel sangue o nei liquidi biologici, in forma inattiva
finche non sono attivati da microrganismi o altri fattori.
• Il meccanismo di attivazione è un meccanismo a cascata, in cui il primo elemento agisce
sul successivo , rendendolo attivo e quindi capace di agire sull’elemento successivo.
• L’attività è localizzata nella zona d’innesco con una emivita degli elementi di un millesimo
di secondo.
• Le molecole del complemento sono indicate con una numerazione , che va da C1 al C9 ,
oppure con le lettere maiuscole (B,D,P).
• I frammenti derivati dalla molecola che ha subito l’azione enzimatica dell’elemento che lo
precede nella cascata, sono indicati con le lettere minuscole (es. C5a, C5b) .
• Il meccanismo terminale dell’azione del complemento è la formazione di un “complesso
litico”, detto complesso d’attacco alla membrana (MAC), costituito dai fattori che vanno dal
C5 al C9.
Complemento
Complemento
Via classica
• Il primo fattore attivato è C1 .
• Il fattore C1 è costituito da un complesso tri-molecolare di 750 kDa legato in
maniera non covalente , C1q, C1r, C1s , in un rapporto molare di 1/2/2
(C1qr2s2).
• C1q è una proteina complessa, ricca in idrossiprolina, idrossilisina e glicina che
per le sue caratteristiche elettroforetiche presenta delle analogie con le Ig,
mentre per la sua struttura amminoacidica ricorda le proteine del collagene.
• La molecola C1q è costituita da 6 unità ognuna costituita da tre distinte
subunità A,B,C
• E’ possibile distinguere una parte centrale compatta , che lega C1r e C1 s , ed
una struttura più esterna che termina con una forma a calice.
• La struttura a calice svolge la funzione di riconoscere e legare particolari siti
presenti nelle Ig, i quali si evidenziano durante la formazione
dell’immunocomplesso.
• La sub-unità C1q si deve legare ai domini CH2 di almeno due anticorpi IgG
adiacenti .
• La sub-unità C1q si può legare ad un solo anticorpo IgM perche dotato di molti
domini CH3.
• Esistono 4 sottoclassi di IgG nell’uomo ciascuna delle quali ha una differente
affinità per C1q. La più affine è IgG3 , seguita dall’IgG1 e IgG2 mentre l’IgG4
non attiva il complemento.
Via classica
•C1s inattivo ha un peso molecolare intorno a 90 kDa ed è costituito da una sola
catena polipeptidica
•L’attivazione di C1s comporta la formazione di due catene una più grande (a) ed una
più piccola (b) , in cui si trova il sito enzimatico necessario per l’attivazione dei
componenti successivi .
• L’attività enzimatica è di tipo serino-esterasi, ed agisce su due substrati C4 e C2
che vengono scissi rispettivamente in C4a e C4b , e in C2a e C2b dando origine al
complesso C4b2a, denominato C3 convertasi che ha la capacità di attivare il fattore
C3.
Via classica
meccanismi di controllo
Le reazioni che caratterizzano la via classica sono soggette al controllo di diverse
proteine solubili quali :
• C1 inibitore ( C1 INH ) : questo fattore agisce su C1, bloccando
l’attività enzimatica di C1s ( edema angioneurotico , dipende
dall’assenza di questo fattore)
• C4bp ( C4 binding protein) : questo fattore si lega al C4b,
bloccando la formazione del complesso C4b2a e permettendo ,
cosi, il legame del fattore H, capace a sua volta di inattivare ,
oltre che il C3b, anche il C4b.
• Fattore I : questo fattore inattiva il C3b, formando il C3b inattivo
(iC3b).
Questi meccanismi sono necessari per mantenere gli effetti dell’innesco della
cascata del complemento solamente a livello del sito d’attivazione.
Via alternativa
Via alternativa
Via lectinica
•Viene attivata in assenza di Ab .
•E’ un meccanismo di difesa aspecifico
•Viene indicata come MBL , ossia la via della lectina legante il mannosio
•La sua attivazione dipende dal riconoscimento non specifico di sostanze estranee
(carboidrati).
•Presenta analogie strutturali alla via classica.
•La MBL è simile al C1q, infatti dopo che si è legata ad un microrganismo si unisce,
per formare un complesso attivo , ad un enzima , detto MASP (MBL-associated
serine-protease) , che è simile al C1r e al C1s della via classica.
•Il complesso MBL-MASP cliva il C4 e il C2 e porta alla formazione di una C3
convertasi che ha come conseguenza la formazione della C5 convertasi.
Formazione del complesso d’attacco alla
membrana
( MAC )
La C5 convertasi provoca la scissione del C5 in C5a e C5b.
La C5a liberato contribuisce con le sue capacità anafilattiche e chemiotattiche alla
risposta infiammatoria locale
La C5b si lega al C6 e al C7 per formare il complesso C5b-7, che presentano la
capacità di legarsi alle membrane biologiche.
Il complesso C5b-7 lega una molecola del fattore C8 e circa 10 molecole di C9,
formando il complesso d’attacco alla membrana (MAC), il C5b-9.
Il complesso d’attacco alla membrana (MAC) ha attività litica sulle membrane,
causando la formazione di pori di circa 10 nm di diametro
Attraverso i pori avviene il passaggio d’acqua e di Sali che portano alla lisi
osmotica della cellula o del microrganismo.
La proteina S si lega al complesso C5b-9, la quale blocca l’attività di lisi e quindi
regola l’attività biologica del MAC.
Fattori regolatori
Esistono molecole di membrana ad attività regolatoria tra cui:
• fattore accellerante il decadimento ( DAF) e la proteina cofattore di
membrana (MCP), che agiscono sulla C3 convertasi della via classia e
della via alternativa.
• fattore di restrizione omologa (HRF) e l’ inibitore di membrana della
reazione di lisi (MIRL/CD59), che lega il complesso C5b-8 e blocca il
legame del C9 alle cellule autologhe.
Anticorpi Monoclonali
Struttura e funzione degli anticorpi
Quando un antigene entra nell'organismo, esso stimola una risposta
immunitaria. Il principale elemento di questa risposta comprende
l'attivazione di linfociti B selezionati per produrre anticorpi capaci di legare
l'antigene (immunità umorale).
Il legame con l'anticorpo può ridurre/inattivare l'attività biologica
dell'antigene (specialmente se si tratta di una tossina), ed inoltre "marca"
l'antigene per la distruzione da parte di altri elementi del sistema
immunitario.
Un dato anticorpo si legherà solo ad una specifica regione dell'antigene,
detta epitopo . La maggior parte degli antigeni che si trovano in natura
(proteine, virus, batteri) contengono centinaia, se non migliaia di differenti
epitopi. Un tipico epitopo sulla superficie di una proteina comprende da
cinque a sette residui amminoacidici.
Struttura e funzione degli anticorpi
Una molecola di anticorpo (immunoglobulina) è costituita da due catene proteiche
"leggere" (L) identiche e da due, anch'esse identiche, catene proteiche "pesanti"
(H), tenute insieme tutte sia da legami a idrogeno sia da ponti bisolfuro
esattamente localizzati.
Le regioni N-terminali delle catene L e H formano in ciascun anticorpo il sito di
riconoscimento dell'antigene.
I siti che riconoscono e fissano gli antigeni sono costituiti da tre regioni
determinanti la complementarietà (CDR) collocate nell'ambito delle regioni variabili
(VH e VL) alle estremità N delle due catene H e delle due catene L.
Le CDR costituiscono la parte della molecola anticorpale che presenta la massima
variabilità della sequenza amminoacidica.
Oltre alle regioni variabili (VH e VL), ogni catena L contiene una regione, o
dominio, costante (CL), e ogni catena H ha tre regioni, o domini, costanti (CH1,
CH2, CH3). Digerendo gli anticorpi con l'enzima papaina, si liberano tre frammenti:
due identici (Fab)-ognuno dei quali contiene una catena L intatta congiunta da
ponte bisolfuro alle regioni CL e CH1 della catena H- e uno diverso (Fc), il quale
consta di due frammenti di catena H, ognuno contenente i domini CH2 e CH3,
congiunti da un legame bisolfuro. Il frammento Fab conserva l'attività legante
l'antigene.
Struttura e funzione degli anticorpi
Una volta avvenuto il legame antigene-anticorpo, in una molecola anticorpale
intatta la porzione Fc suscita parecchie risposte immunitarie:
• Si attiva la cascata del complemento. I componenti di questo sistema
disgregano le membrane cellulari, attivano i fagociti e generano segnali per
mobilizzare altri componenti del sistema di risposta immunitaria.
• Prende corpo la citotossicità cellulo-mediata anticorpo-dipendente (ADCC)
provocata dal legame tra la porzione Fc dell'anticorpo e il recettore Fc di una
cellula ADCC effettrice.
• In seguito al legame tra la regione Fab e un antigene solubile la porzione Fc
di un anticorpo si può fissare sui recettori Fc delle cellule fagocitiche, che
inglobano e distruggono il complesso anticorpo-antigene.
Struttura e funzione degli anticorpi
Principi alla base della produzione di Anticorpi
monoclonali
Ogni specifico anticorpo, che riconosce uno specifico epitopo, è prodotto da uno
specifico linfocita B. L'isolamento e la coltura in vitro di una cellula capace di
produrre un singolo anticorpo rappresenta una fonte di anticorpi monoclonali
(monospecifici).
Tuttavia i linfociti B, quando sono coltivati in vitro, muoiono dopo brevissimo
tempo, e quindi non possono essere una fonte per la produzione a lungo termine
di anticorpi.
La tecnologia dell'anticorpo monoclonale comprende l'isolamento di questi
linfociti B, e la loro successiva fusione con cellule trasformate (cellule
mielomatose). Molte delle risultanti cellule ibride manterranno l'immortalità, oltre
a produrre grandi quantità dell'anticorpo monospecifico.
Principi alla base della produzione di Anticorpi
monoclonali
La tecnica degli ibridomi può servire quindi a mantenere una scorta continua di
anticorpo monospecifico puro, e l'obiettivo attuale consiste nel progettare e produrre
anticorpi monoclinali umani dotati tanto di specifiche proprietà immunoterapiche
quanto di bassa immunogenicità potenziale.
PREPARATI DI ANTICORPI POLICLONALI
I preparati di anticorpi policlonali sono stati usati per decine di anni per indurre
immunizzazione passiva contro malattie infettive e altri agenti dannosi, in
particolare tossine (es.antisiero equino contro l'infezione da Corynebacterium
diphteriae).
I preparati di anticorpi sono generalmente somministrati per iniezione
endovenosa. Mentre questo fornisce un'immediata protezione immunitaria,
l'effetto è transitorio, e di solito persiste per sole due o tre settimane (per
esempio finché gli anticorpi non sono escreti).
L'immunizzazione passiva può essere usata come profilassi (es.
somministrazione di anticorpi diretti contro tossine di serpenti a persone che
debbano viaggiare in luoghi dove tali serpenti si trovino comunemente) o come
terapia (es. somministrazione di anticorpi antiveleno immediatamente dopo il
morso di un serpente).
Preparazione di un antisiero
I preparati di anticorpi usati per indurre immunità passiva possono essere ottenuti
da fonti animali o umane. I preparati di origine animale sono in genere chiamati
"antisieri", mentre quelli di origine umana sono detti "immunoglobuline". In entrambi i
casi gli anticorpi predominanti sono le IgG. Gli antisieri sono generalmente prodotti
per mezzo dell'immunizzazione di animali sani con appropriati antigeni. Piccoli
campioni di sangue sono successivamente prelevati dall'animale e su questi si fa
un'analisi quantitativa della presenza degli anticorpi desiderati (enzyme-linked
immunosorbent assay - ELISA). Il sangue viene raccolto usando una tecnica
aseptica all'interno di contenitori sterili (in presenza di eparina o altro
anticoagulante).
La frazione anticorpale viene quindi purificata dal siero per mezzo di successive
precipitazioni (etanolo e ammonio solfato) o di cromatografia ad alta risoluzione.
Dopo questa purificazione si determina il titolo degli anticorpi, solitamente per
mezzo di saggi biologici o immunologici. Spesso si aggiungono stabilizzanti come
NaCl (0.9% w/v) o glicina (2- 3% w/v).
Preparazione di un antisiero
Preparati di anticorpi policlonali di origine umana o animale usati per indurre
immunità passiva contro specifici agenti biologici
Preparazione di un antisiero
Gli antisieri si sono dimostrati preziosi nel trattamento di molte patologie, ma
possono anche indurre particolari effetti indesiderati, tra cui è particolarmente
degna di nota la loro capacità di indurre reazioni di ipersensibilità, le quali
possono arrivare fino allo shock anafilattico con la morte del paziente.
I preparati di anticorpi policlonali in uso terapeutico possono essere
raggruppati secondo il loro target in:
• Anticorpi diretti contro specifici patogeni microbici o virali
• Anticorpi diretti contro tossine microbiche
• Anticorpi diretti contro il veleno di ragni e serpenti (antiveleno)
ANTICORPI MONOCLONALI
La tecnologia degli anticorpi monoclonali si è sviluppata negli anni '70, quando
Kohler e Milstein riuscirono a fondere cellule mielomatose immortali con
linfociti B produttrici di anticorpi. Una parte degli ibridi ottenuti risultava essere
stabile, con caratteristiche cancerose e capace di produrre anticorpi. Queste
cellule, dette ibridomi, rappresentavano dunque una inesauribile fonte di
anticorpi monospecifici (monoclonali).
Formazione e selezione delle cellule ibride
Il primo passo della produzione di una linea cellulare ibrida che produca un unico
anticorpo è l'inoculazione, nel topo o nel ratto, dell'antigene contro il quale si
desidera venga prodotto l'anticorpo. Dopo parecchie inoculazioni e in capo ad un
periodo di alcune settimane, si saggiano gli animali per stabilire se hanno o meno
sviluppato la risposta immunitaria. In caso affermativo essi vengono uccisi e se ne
asporta la milza (che ospita i linfociti, le cellule che producono gli anticorpi), la si
lava e trita, e si agita poi dolcemente per liberare le singole cellule, alcune delle
quali saranno cellule B produttrici di anticorpi.
Si mescola la sospensione di cellule spleniche con una sospensione di cellule di
cellule mielomatose geneticamente prive dell'enzima ipoxantina-guaninafosforibosil-transferasi (HGPRT -). La miscela delle sospensioni cellulari viene
mescolata con glicole polietilenico al 35% per alcuni minuti e successivamente
trasferita a un mezzo di coltura contenente ipoxantina, amminopterina e timidina
(mezzo HAT).
Formazione e selezione delle cellule ibride
Il trattamento con polietilenglicole facilita la fusione tra le cellule, ma anche così gli
eventi di fusione sono rari e casuali. Nella miscela esisteranno alla fine:
•cellule mielomatose
•cellule spleniche
•cellule di fusione mieloma-milza
•cellule di fusione mieloma-mieloma
•cellule di fusione milza-milza.
Il mezzo HAT, invece, permette la crescita delle sole cellule di fusione mieloma-milza,
perché nessun'altra è in grado di proliferarvi.
Le cellule spleniche e quelle di fusione milza-milza non sono in grado di crescere in
alcun mezzo.
Le cellule mielomatose e quelle di fusione mieloma-mieloma, del tipo HGPRT - non
sono in grado di utilizzare l'ipoxantina come precursore per la biosintesi delle purine
guanina e adenina, che sono, naturalmente, essenziali alla sintesi degli acidi nucleici.
Esse dispongono però di un percorso alternativo, naturale, per sintetizzare le purine,
che si serve dell'enzima diidrofolato-riduttasi. E' per questo che si comprende nel
mezzo l'amminopterina, che inibisce appunto l'attività della diidrofolato-riduttasi.
In definitiva le cellule HGPRT - mielomatose e di fusione mieloma-mieloma non sono
capaci di sintetizzare nel mezzo HAT le purine e, di conseguenza, periscono.
Formazione e selezione delle cellule ibride
Quanto alle cellule di fusione milza-mieloma, esse sopravvivono nel mezzo HAT
perché le cellule di milza contribuiscono con l'HGPRT funzionale, che può utilizzare
l'ipoxantina esogena del mezzo anche quando la produzione di purine affidata alla
diidrofolato-riduttasi sia bloccata dall'amminopterina, e perché, inoltre, sono attive le
funzioni della divisione cellulare delle cellule mielomatose.
Si fornisce la timidina per superare il blocco della produzione di pirimidine causato
dall'inibizione della diidrofolato-riduttasi ad opera dell'amminopterina.
Da 10 a 14 giorni circa dopo il trattamento di fusione nel mezzo HAT saranno
sopravvissute solamente, crescendovi, le cellule di fusione milza-mieloma.
Tali cellule vengono allora distribuite nei pozzetti delle piastre da microdosaggio e fatte
crescere in mezzo di coltura completo senza HAT.
Identificazione di specifiche linee cellulari ibride produttrici di anticorpi
Il compito successivo consiste nell'identificare le cellule ibride che producono
anticorpi contro l'antigene immunizzante. Uno dei procedimenti comuni di selezione
utilizza il mezzo di coltura, che contiene gli anticorpi secreti.
Lo si raccoglie dai pozzetti che contengono cellule in crescita e lo si aggiunge nel
pozzetto di un'altra piastra da microdosaggio preliminarmente rivestita con
l'antigene bersaglio.
Se il mezzo di coltura contiene un anticorpo (anticorpo primario) che riconosce un
epitopo dell'antigene vi si legherà, e i successivi lavaggi non lo allontaneranno. Ai
pozzetti della piastra si aggiunge un secondo anticorpo (anticorpo secondario)
specifico degli anticorpi murini (di topo): si legherà a qualsiasi anticorpo primario
fissato sull'antigene.
Prima di adoperarlo nell'immunodosaggio si coniuga il secondo anticorpo con un
enzima che trasforma un substrato incolore in un composto colorato. La presenza di
colorazione in uno dei pozzetti dimostrerà che il mezzo di coltura conteneva un
anticorpo specifico per l'antigene.
Identificazione di specifiche linee cellulari ibride produttrici di anticorpi
I pozzetti della piastra da microdosaggio originale il cui mezzo fornisce
all'immunodosaggio risposta positiva (colorazione) possono contenere una
miscela di cellule di fusione. Tali cellule perciò vengono diluite con mezzo di
coltura e inoculate in pozzetti vergini, onde impiantare linee cellulari da cellule
individuali (cloni).
Dopo avere coltivato i cloni se ne saggia il mezzo nuovamente per stabilire quali
linee cellulari (ibridomi) producano molecole di anticorpi monoclonali atte a
riconoscere l'antigene bersaglio.
Se si isola più di un ibridoma specifico si effettuano ulteriori saggi per stabilire se
i diversi cloni producano anticorpi contro il medesimo determinante antigenico.
Ciascun clone produttore di anticorpi monoclonali può essere mantenuto in
coltura più o meno indefinitamente, inoltre si possono congelare i campioni in
azoto liquido per potere disporre in seguito di una fonte di cellule.
Produzione di un anticorpo monoclonale (Mab)
Identificazione di specifiche linee cellulari ibride produttrici di anticorpi
La produzione degli anticorpi monoclonali può essere anche condotta mediante
iniezione degli ibridomi nella cavità peritoneale di ratti, che servono dunque da
camera di fermentazione vivente.
Crescendo, le cellule di ibridoma trapiantate producono anticorpi.
Molti dei primi preparati di anticorpi monoclonali venivano prodotti in questo
modo, tra questi OKT-3, il primo anticorpo monoclonale approvato per l'uso
terapeutico dalla Food and Drug Administration.
Questo metodo presenta però degli svantaggi quali l'alto costo e il fatto che il
prodotto sia contaminato da significativi livelli di varie proteine murine.
La rimozione delle cellule dal mezzo contenente gli anticorpi è portata a termine
mediante centrifugazione o filtrazione, e normalmente si fa anche una
ultrafiltrazione per concentrare il filtrato, che viene poi sottoposto a diverse
purificazioni di tipo cromatografico
A seconda dell'utilizzo previsto, l'anticorpo può poi essere coniugato a
specifiche molecole "segnale" (es. radionuclidi o tossine). Alla fine vengono
aggiunti al prodotto degli agenti stabilizzanti come tamponi, glicina o anche
albumina. Il prodotto viene poi liofilizzato e venduto confezionato in atmosfera di
gas inerte.
Produzione di anticorpi monoclonali mediante coltura di cellule animali
Applicazioni terapeutiche degli anticorpi monoclonali
L'incomparabile specificità degli anticorpi monoclonali, unita alla loro
relativamente facile produzione e alla possibilità di averne scorte pressoché
inesauribili, li rende interessanti strumenti in campo biochimico.
In campo terapeutico essi rappresentano di gran lunga la più grande categoria
di sostanze biofarmaceutiche attualmente in studio, e centinaia di queste
preparazioni si trovano correntemente sotto sperimentazione pre-clinica e
clinica.
Negli anni '80 si è focalizzata l'attenzione sul loro uso sia come agenti traccianti
(diagnostica per immagini) o come diretti agenti terapeutici.
I primi studi sono stati concentrati sul cancro, ma i preparati di anticorpi
monoclonali vengono oggi usati in una gran varietà di campi della medicina.
Applicazioni cliniche degli anticorpi monoclonali in commercio
• Immunizzazione passiva
• Diagnostica per immagini (es. cancro, malattie infettive, patologie
cardiovascolari)
• Terapia del cancro e delle patologie cardiovascolari
• Prevenzione della reazione immunitaria di rigetto nei trapianti di organi
• Diagnosi di gravidanza e di malattie a trasmissione sessuale
• Purificazione di prodotti industriali
• Rilevazione di molecole in tracce nei prodotti alimentari, agricoli e
industriali