Capitolo 5
Gaetano A. Lanza
Filippo Crea
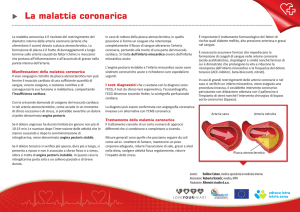
Definizione
Il termine cardiopatia ischemica raggruppa una serie
di quadri clinici che hanno in comune lo sviluppo
di ischemia miocardica, ossia di una sofferenza o un
danno delle cellule miocardiche conseguente a un insufficiente apporto di ossigeno rispetto alle loro richieste
metaboliche.
Epidemiologia
La cardiopatia ischemica è di gran lunga la cardiopatia con
maggiore incidenza (numero di nuovi casi insorti in un
certo periodo di tempo in una popolazione) e prevalenza
(numero di casi affetti dalla malattia in una popolazione
in un dato momento) nei Paesi sviluppati.
Negli Stati Uniti ogni anno muoiono per cardiopatia
ischemica circa 550.000 soggetti e la prevalenza della
malattia è di circa 13 milioni di individui.
In Italia le malattie cardiovascolari sono causa del 45%
circa della mortalità globale, e la cardiopatia ischemica
è a sua volta responsabile del 35% dei decessi dovuti a
malattie cardiovascolari, con un numero annuo di morti
pari a circa 130.000. L’incidenza di infarto miocardico
è di circa 120.000 nuovi casi per anno. La prevalenza
della cardiopatia ischemica nella popolazione italiana
è meno nota, ma è verosimilmente intorno al 4%, con
una prevalenza simile di infarto miocardico pregresso e
storia di angina pectoris. In Italia, quindi, vivono più di
2 milioni di soggetti affetti da cardiopatia ischemica nelle
sue varie forme.
© 2010 ELSEVIER S.R.L. Tutti i diritti riservati.
Eziopatogenesi
L’aterosclerosi coronarica è di gran lunga la causa più
frequente di cardiopatia ischemica (si veda il Capitolo 4).
Tuttavia, aterosclerosi coronarica e cardiopatia ischemica
non sono sinonimi. Infatti, come si vedrà, può esservi
una coronaropatia aterosclerotica anche grave senza che
vi siano evidenti segni clinici di ischemia miocardica e,
viceversa, manifestazioni cliniche di ischemia miocardica
senza che sia evidenziabile una coronaropatia ostruttiva.
L’ischemia miocardica, infatti, può essere causata anche
da uno spasmo coronarico, da alterazioni del microcircolo
coronarico o da cause extracoronariche.
Inoltre, esistono altre cause di coronaropatia ostruttiva,
anche se molto meno frequenti dell’aterosclerosi, quali
un’embolia coronarica, una coronarite ostiale da aortite
103
Cardiopatia
ischemica
luetica, un’arterite coronarica nell’ambito di una vasculite
(per esempio, poliarterite nodosa, sindrome di Takayasu,
malattia di Kawasaki). Infine, anche anomalie congenite delle arterie coronarie possono essere responsabili di
ischemia miocardica, alcune già nei primi mesi dopo la
nascita (per esempio, l’origine di una coronaria dall’arteria polmonare), altre più tardivamente (per esempio, un
decorso anomalo di un’arteria coronaria dopo un’origine
dei due rami da un ostio unico).
Fisiopatologia dell’ischemia miocardica
L’ischemia miocardica si verifica quando il flusso coronarico risulta inadeguato a soddisfare il consumo miocardico di ossigeno (MVO2). Per discutere i meccanismi
fisiopatologici che possono essere causa di ischemia
miocardica è opportuno rivedere prima brevemente
i principali meccanismi che sono alla base della regolazione del circolo coronarico e i fattori che determinano
l’MVO2.
Anatomia delle arterie coronarie epicardiche
Le arterie che irrorano il cuore sono due, l’arteria coronaria destra e l’arteria coronaria sinistra, che nascono
dall’aorta, immediatamente dopo la sua origine, rispettivamente, dalle cuspidi valvolari aortiche anteriori destra
e sinistra (Fig. 5.1).
L’arteria coronaria destra irrora abitualmente la porzione
infero-basale del ventricolo sinistro, la parete posteriore e
la parte posteriore del setto (tramite l’arteria discendente
posteriore) e il ventricolo destro.
L’arteria coronaria sinistra, dopo un breve tratto, chiamato
tronco comune, si divide in due rami, l’arteria discendente anteriore (o interventricolare anteriore) e l’arteria
circonflessa.
L’arteria discendente anteriore sinistra è certamente il
ramo più importante e irrora abitualmente tutta la parete
anteriore e antero-laterale del cuore, la parte anteriore del
setto e la punta.
L’arteria coronaria circonflessa, d’altro canto, irrora in genere solo la regione postero-laterale e infero-laterale della
parete del ventricolo sinistro. In circa il 20% dei soggetti,
tuttavia, l’arteria circonflessa ha un calibro maggiore e,
dirigendosi posteriormente lungo il solco atrioventricolare, dà origine all’arteria discendente posteriore, irrorando
il territorio infero-posteriore che è più comunemente
di pertinenza della coronaria destra (arteria circonflessa
dominante).
1
104
Figura 5.1
(a) origine e
decorso delle
arterie coronarie.
(b) tagli trasversali
che mostrano
la distribuzione
abituale
dell’irrorazione dei
territori miocardici
da parte delle
singole coronarie.
Parte 1 - MALATTIE DEL SISTEMA CIRCOLATORIO
A = anteriore; AL = antero-laterale; AS = antero-settale; CDx = arteria coronaria destra;
CX = circonflessa della coronaria sinistra; D = ramo diagonale della discendente anteriore;
DA = discendente anteriore della coronaria sinistra; DP = discendente posteriore della
coronaria destra; I = inferiore; IL = infero-laterale; IS = infero-settale; MD = ramo del
margine acuto della coronaria destra; MO = ramo del margine ottuso della circonflessa;
P = posteriore; PL = postero-laterale; PS = postero-settale; S = settale; TC = tronco
comune della coronaria sinistra; VD = ventricolo destro.
Fisiologia del circolo coronarico
Dal punto di vista funzionale i vasi arteriosi coronarici
­possono essere suddivisi in due compartimenti principali
(Fig. 5.2): (1) vasi di conduttanza, che comprendono i grossi rami epicardici e le loro diramazioni principali; (2) vasi di
resistenza, che comprendono le prearteriole e le arteriole.
I vasi di conduttanza che hanno un diametro maggiore
di 500 mm non offrono significativa resistenza al flusso
coronarico, mentre i vasi di resistenza determinano una
marcata caduta della pressione di perfusione lungo il loro
decorso.
Le prearteriole hanno un diametro di 100-500 mm e sono
la sede dell’autoregolazione del flusso coronarico, che
consente di mantenere il flusso coronarico costante al
variare della pressione aortica. Infatti le prearteriole si
Figura 5.2
Schema delle
sezioni principali
della normale
circolazione
arteriosa
coronarica
(in alto) e del
loro effetto
sulla pressione
arteriosa di
perfusione
(in basso).
costringono quando la pressione aortica aumenta e si dilatano quando la pressione aortica si riduce, così da mantenere costante il flusso. Il loro tono, inoltre, è influenzato
da vari meccanismi neuroumorali ed endotelio-mediati.
Le arteriole hanno un diametro inferiore a 100 mm e sono
la sede della regolazione metabolica del flusso coronarico;
esse, infatti, si dilatano quando il consumo miocardico
di ossigeno aumenta e si costringono quando si riduce.
Anche il tono arteriolare, inoltre, è influenzato da vari
fattori neuroumorali.
È importante ricordare che, in condizioni basali, l’estrazione di O2 da parte dei miocardiociti è molto alta (circa
il 70%); ne consegue, che se la domanda metabolica aumenta, l’unico meccanismo per aumentare l’apporto di O2
è rappresentato da un proporzionale aumento del flusso
coronarico, che si attua anzitutto attraverso la vasodilatazione del distretto coronarico arteriolare. La capacità di incremento massimo del flusso, rispetto alla base, in risposta
a uno stimolo metabolico è definita riserva coronarica.
I fattori che regolano il circolo coronarico sono molteplici
e complessi (Fig. 5.3), ma il più importante è certamente rappresentato dalla richiesta metabolica del muscolo
cardiaco. Quando questa aumenta, si determina idrolisi
di adenosin-trifosfato (ATP) e conseguente liberazione di
adenosina nell’interstizio. L’adenosina induce una vasodilatazione a livello delle arteriole, con un conseguente
aumento del flusso coronarico proporzionale all’aumento
delle richieste metaboliche. L’adenosina non è l’unica
sostanza implicata nella regolazione metabolica del flusso
coronarico, ma è verosimilmente la principale.
Altri elementi che contribuiscono alla regolazione del circolo coronarico sono l’innervazione coronarica, alcune sostanze vasoattive circolanti, come le catecolamine, e le sostanze
vasoattive sintetizzate dall’endotelio, in particolare l’ossido
nitrico. Normalmente il flusso coronarico può aumentare
fino a 4-5 volte durante richiesta massimale di ossigeno.
Il flusso coronarico è ovviamente determinato, oltre che
dalla resistenza dei vasi coronarici, dalla pressione di
perfusione endoluminale (che nei vasi di conduttanza è
praticamente identica a quella aortica), e avviene prevalentemente in diastole, poiché in sistole i rami intramurali
vengono virtualmente occlusi dalla contrazione ventricolare. A questo proposito va ricordato che la tachicardia
predispone allo sviluppo di ischemia miocardica non
soltanto perché aumenta l’MVO2, ma anche perché determina un accorciamento della durata della diastole e,
quindi, del tempo disponibile per il flusso coronarico.
È importante notare che gli strati subendocardici della
parete ventricolare miocardica sono generalmente più
facilmente soggetti all’ischemia rispetto agli strati subepicardici, e ciò perché essi sono maggiormente esposti alla
pressione diastolica endocavitaria, che tende a contrastare
il flusso determinato dalla pressione endoluminale e determina anche un MVO2 di base più elevato a causa della
maggiore tensione parietale alla quale le cellule subendocardiche vengono esposte.
Determinanti del consumo miocardico di O2
La maggiore caduta di pressione (e quindi la maggiore resistenza al flusso) si osserva
nelle arteriole, mentre le prearteriole offrono una resistenza al flusso più limitata rispetto
alle arteriole. I vasi di conduttanza non offrono alcuna resistenza apprezzabile al flusso.
(Da: Maseri A. Ischemic heart disease. New York: Churchill Livingstone Inc.; 1995, modificata.)
Il cuore è un organo aerobio e, in condizioni fisiologiche, la determinazione del fabbisogno miocardico di
O 2 fornisce un indice accurato del suo metabolismo
complessivo.
Capitolo 5 - Cardiopatia ischemica
105
1
Figura 5.3
Schema delle
componenti che
contribuiscono
alla regolazione
del flusso
coronarico.
La principale finalità del flusso coronarico è fornire un adeguato apporto di ossigeno (oltre che di sostanze metaboliche) al miocardio (offerta) in relazione al fabbisogno di ossigeno da
parte delle cellule miocardiche (domanda), i cui determinanti sono schematizzati nella parte destra della figura. Un apporto ematico insufficiente a soddisfare le richieste metaboliche del
miocardio causa ischemia miocardica. (Da: Camm AJ, Serruys PW, Lüscher TF, editors. The ESC textbook of cardiovascular medicine. 2nd ed. London: Blackwell Publ.; 2009, modificata.)
Mentre la quantità di energia richiesta per i processi metabolici basali e per l’attivazione elettrica dell’organo è minima, la maggior parte della richiesta energetica, e quindi
dell’MVO2, deriva dall’attività meccanica del muscolo
cardiaco. Come conseguenza, i principali determinanti
dell’MVO2 sono (si veda Fig. 5.3):
• la frequenza cardiaca;
• il postcarico;
• il precarico;
• la contrattilità.
Come si può intuire, la frequenza cardiaca (ossia il numero di battiti cardiaci al minuto) è il fattore che più di tutti
influenza l’MVO2. A ogni battito, infatti, corrisponde una
contrazione; così, raddoppiando il numero di battiti, il
consumo di ossigeno, in pratica, raddoppia.
Il postcarico corrisponde alla tensione delle pareti delle
camere cardiache durante la contrazione e dipende principalmente dalla pressione sviluppata al loro interno, che,
a sua volta, è determinata dalle resistenze all’eiezione
del sangue. Nel caso del ventricolo sinistro, in assenza di
ostruzioni all’efflusso, un indice attendibile del postcarico
è fornito dalla misurazione della pressione arteriosa sistemica, che rappresenta il secondo fattore principale come
determinante dell’MVO2.
La tensione sviluppata dalle pareti miocardiche, tuttavia,
dipende anche dalla pressione endocavitaria sviluppata
dal ritorno venoso, cioè dalla pressione telediastolica
ventricolare (precarico).
Infine, un aumento dell’inotropismo cardiaco aumenta il
lavoro cardiaco, e quindi l’MVO2.
In clinica non è possibile rilevare tutte queste variabili;
alcune di esse tuttavia sono facilmente misurabili, come
la frequenza cardiaca (FC) e la pressione arteriosa (PA).
Poiché questi due parametri determinano gran parte
della richiesta metabolica miocardica, il prodotto FC ×
PA sistolica, detto comunemente doppio prodotto, è
ritenuto un indice affidabile, semplice e non invasivo, per
la valutazione dell’MVO2 e viene comunemente utilizzato
a questo scopo nella pratica clinica.
Cause dell’ischemia miocardica
Stenosi coronariche
Come anticipato, il substrato più frequente dell’ischemia
miocardica è rappresentato dallo sviluppo di stenosi nei
vasi arteriosi coronarici epicardici, causate dalla formazione di placche aterosclerotiche. A tale riguardo sono
importanti le seguenti considerazioni.
•Perché una stenosi coronarica sia in grado di
impedire, quando richiesto, un aumento massimale
del flusso coronarico (di ridurre, cioè, la riserva
coronarica) essa deve determinare già a riposo una
resistenza al flusso; quando ciò avviene si osserva
in condizioni basali una caduta di pressione
lungo la stenosi, per cui la pressione a valle risulta
inferiore a quella a monte della stenosi.
• Stenosi dei vasi epicardici che determinano una
riduzione del lume < 50% non causano una caduta
di pressione a valle della stenosi. Di conseguenza,
esse in genere non sono in grado di causare
limitazioni del flusso coronarico e quindi
di determinare ischemia, anche durante aumenti
massimali della richiesta metabolica
del miocardio.
• La presenza di una stenosi superiore al 50% del lume,
viceversa, determina a valle della stenosi una caduta
di pressione che è proporzionale alla riduzione del
calibro vasale. Ciò stimola la dilatazione dei vasi di
resistenza, che compensa la riduzione della pressione
di perfusione garantendo in condizioni basali
il mantenimento di un flusso coronarico adeguato.
Ne deriva che a riposo non si verifica ischemia
miocardica, nonostante la presenza di una stenosi
significativa.
106
Parte 1 - MALATTIE DEL SISTEMA CIRCOLATORIO
• La vasodilatazione arteriolare basale che si verifica in
presenza di una stenosi significativa, tuttavia, limita
la capacità di ulteriore vasodilatazione (comporta,
cioè, una riduzione della riserva coronarica).
Ne deriva che quando si verifica un aumento della
domanda di ossigeno (classicamente in seguito
a uno sforzo) il circolo coronarico può non essere
in grado di aumentare il flusso in modo adeguato
a fare fronte all’aumentata richiesta metabolica del
miocardio irrorato dal vaso stenotico, a causa della
ridotta capacità di vasodilatazione (ossia del precoce
esaurimento della propria “riserva”); come risultato
si avrà ischemia miocardica.
• Se la stenosi riduce il calibro del vaso epicardico di
oltre l’80%, il flusso coronarico, in assenza di circoli
collaterali, diventa insufficiente già a riposo, a causa
dell’esaurimento della capacità di vasodilatazione
dei vasi di resistenza arteriolari, e quindi della riserva
coronarica.
• In presenza di una stenosi coronarica significativa,
l’ischemia interessa in genere essenzialmente
gli strati subendocardici, che, come detto sopra,
sono più esposti all’ischemia rispetto a quelli
subepicardici.
• Spesso le stenosi coronariche non sono fisse, cioè
non causano un grado di riduzione costante del lume
vasale, che sarebbe associato a una riduzione fissa
della riserva coronarica e quindi alla comparsa di
ischemia miocardica sempre per lo stesso aumento di
richiesta metabolica. Più frequentemente, le stenosi
coronariche sono piuttosto dinamiche, vale a
dire presentano variazioni del grado di riduzione
del lume per il sovrapporsi di variazioni del tono
vascolare a livello della stenosi, che ne aumentano
transitoriamente il grado in caso di vasocostrizione
o lo riducono in caso di vasodilatazione. Ciò
rende rispettivamente più facile o meno facile
l’induzione di ischemia, riducendo e aumentando
rispettivamente il livello di richiesta metabolica alla
quale la riserva coronarica si esaurisce. Le variazioni
dinamiche di una stenosi sono dovute in genere
a fattori neuroumorali che agiscono sul tono del
vaso e spiegano in parte la variabilità della soglia
ischemica (ossia il livello di lavoro cardiaco al quale
compare l’ischemia) che si osserva spesso nella
pratica clinica. Tuttavia, anche variazioni del tono
dei vasi di resistenza a valle della stenosi e variazioni
del tono vasale in rami collaterali che contribuiscono
al flusso nell’area servita dal ramo stenotico possono
condizionare il livello del lavoro cardiaco al quale
l’ischemia miocardica compare e contribuire
alla variabilità della soglia ischemica.
Disfunzione del microcircolo coronarico
Alterazioni strutturali (fibrosi, ipertrofia) e/o funzionali
dei vasi di resistenza arteriosi, che ne compromettono la
capacità di vasodilatazione, possono essere responsabili di
una riduzione della riserva coronarica, e quindi di ischemia miocardica, in seguito ad aumento della richiesta
miocardica di O2, anche in assenza di qualsiasi malattia
dei vasi epicardici. Una vasocostrizione sufficientemente
intensa e diffusa dei vasi di resistenza può inoltre causa-
re ischemia miocardica anche a riposo. La disfunzione
del microcircolo è la causa dell’angina microvascolare
(si veda oltre).
Spasmo coronarico
Lo spasmo coronarico è caratterizzato da una vasocostrizione intensa di un segmento di uno o più vasi coronarici
epicardici, che determina un’occlusione totale o subtotale del lume vasale con conseguente grave riduzione
dell’apporto di O2 al miocardio e quindi ischemia. La
grave carenza di ossigeno determinata dallo spasmo coronarico interessa in genere l’intero spessore della regione miocardica irrorata dal vaso (ischemia transmurale).
Lo spasmo coronarico è la causa dell’angina vasospastica
(si veda oltre).
Trombosi coronarica
La formazione acuta e imprevedibile di un trombo in un
ramo epicardico coronarico ne determina un’occlusione subtotale o totale. La trombosi si verifica in genere a
livello di una placca aterosclerotica, spesso non ostruttiva, andata incontro a complicanze (rottura, ulcerazione, erosione, emorragia) che facilitano l’esposizione del
tessuto subendoteliale al sangue, causando l’attivazione
piastrinica e della cascata della coagulazione che, se non
contrastata, porta appunto alla formazione di un trombo.
La trombosi coronarica è la causa fondamentale delle
sindromi coronariche acute (si veda oltre).
Conseguenze dell’ischemia miocardica
L’ischemia causa importanti alterazioni miocardiche che
si presentano di solito secondo una sequenza temporale
tipica, nota come cascata ischemica, che coinvolge, in
breve tempo, dapprima l’attività metabolica, poi quella
meccanica e poi quella elettrica delle cellule miocardiche;
infine, nel paziente può comparire, ma non sempre, il
dolore ischemico cardiaco.
Queste alterazioni sono reversibili se l’ischemia è transitoria. Se essa si prolunga oltre i 20-30 min le alterazioni
cellulari diventano irreversibili e ne consegue la necrosi
dell’area ischemica, cioè l’infarto del miocardio.
Alterazioni metaboliche
In condizioni di normale ossigenazione il miocardio ha
un metabolismo strettamente aerobio e catabolizza gli
acidi grassi, il suo principale substrato energetico, e il
glucosio a CO2 e H2O. In presenza di ischemia gli acidi
grassi non possono essere ossidati, per cui, tramite glicolisi
anaerobia, il glucosio viene metabolizzato ad acido lattico. Ciò comporta una diminuzione del pH intracellulare
e una riduzione delle riserve di fosfati ad alta energia:
l’adenosin-trifosfato (ATP) e il creatin-fosfato. La riduzione delle riserve di ATP compromette gli scambi ionici a
livello del sarcolemma, con aumento dell’Na+ e riduzione
del K+ intracellulare.
L’aumento dell’Na+ intracellulare ha come conseguenza
un incremento intracellulare di Ca2+ attraverso un aumentato scambio Na+-Ca2+. La ridotta disponibilità di ATP
abbassa anche l’assunzione di Ca2+ da parte del reticolo
sarcoplasmatico e riduce l’estrusione di Ca2+ dalla cellula.
L’aumento del Ca2+ intracellulare produce un sovraccarico
Capitolo 5 - Cardiopatia ischemica
di Ca2+ a livello dei mitocondri e ciò deprime ulteriormente la produzione di ATP. Il Ca2+ risulta quindi avere
un ruolo centrale nel circolo vizioso che porta al danno
irreversibile della cellula in caso di ischemia persistente.
Nelle cellule ischemiche si producono anche radicali liberi
dell’ossigeno, cioè molecole di ossigeno con un eccesso di
elettroni che lo rendono chimicamente molto reattivo. I
radicali dell’ossigeno, per mezzo di fenomeni di perossidazione, possono danneggiare i costituenti della membrana
cellulare e quindi contribuire al danno ischemico.
Un’ischemia di breve durata (o di lieve entità) determina
alterazioni reversibili del metabolismo cellulare, che si
normalizzano con il ripristino di un flusso coronarico adeguato alle richieste metaboliche. D’altro canto, un’ischemia prolungata (superiore a 20-30 min), soprattutto se
grave, finisce con il determinare alterazioni irreversibili
nei miocardiociti, che vanno infine incontro a necrosi.
È interessante notare che il miocardio che è andato incontro a un’ischemia transitoria (tipicamente di 2-5 min)
diviene metabolicamente più resistente a un’ischemia
successiva, anche prolungata. Questo fenomeno viene
chiamato precondizionamento ischemico. Esso conferisce una protezione contro un’ischemia che si verifichi
nelle 2 ore successive all’episodio ischemico transitorio
precondizionante (precondizionamento precoce), ma
anche contro un’ischemia che insorga tardivamente, dopo 24 ore, e anche fino a 72 ore dopo l’episodio ischemico precondizionante (precondizionamento tardivo).
I meccanismi del precondizionamento ischemico (sia
precoce sia tardivo) sono complessi e ancora non completamente chiariti. Tuttavia, sembrano giocare un ruolo
di rilievo sia l’adenosina liberata dalle cellule miocardiche
durante l’ischemia precondizionante, sia l’attivazione dei
canali ATP-dipendenti del K+ a livello della membrana
cellulare e a livello dei mitocondri. Il meccanismo del
precondizionamento ischemico è verosimilmente alla
base dell’osservazione che l’infarto del miocardio preceduto da episodi anginosi (angina preinfartuale) presenta
una minore gravità ed estensione rispetto a quello che si
verifica “a ciel sereno”.
Alterazioni meccaniche
L’ischemia miocardica determina alterazioni sia della funzione sistolica sia della funzione diastolica del miocardio.
Alterazioni della funzione sistolica
La funzione contrattile del miocardio ischemico risulta
depressa. Nella regione di miocardio ventricolare ischemico si manifesta, quindi, una riduzione o abolizione del
normale ispessimento sistolico. Indipendentemente dal
fatto che l’ischemia sia transitoria o prolungata, se l’area
ischemica è sufficientemente ampia si ha una depressione
della funzione globale del ventricolo sinistro con riduzione della gittata sistolica, della portata cardiaca e della
frazione di eiezione. Se l’ischemia interessa il 20-25%
della massa ventricolare sinistra si ha evidenza clinica di
scompenso. Se infine l’ischemia interessa i muscoli papillari o altri segmenti del miocardio coinvolti nel normale
funzionamento dell’apparato mitralico si può instaurare
un’insufficienza mitralica acuta, che può essere responsabile di sintomi di scompenso cardiaco anche se l’area
miocardica ischemica è limitata.
Ovviamente, nel caso si sviluppi una necrosi miocardica
(a causa del prolungamento dell’ischemia) la disfunzione
contrattile della regione colpita dal danno ischemico diventerà persistente. Maggiore sarà l’estensione dell’area
infartuata, maggiore sarà il grado di compromissione
della funzione contrattile del ventricolo sinistro e, quindi,
del cuore.
Rimane discussa la possibilità che ripetuti episodi ischemici miocardici determinino piccole aree di necrosi con
successiva riparazione cicatriziale fibrotica (condizione un
tempo definita come “miocardiosclerosi”) che, alla lunga,
sommandosi, finiscono per determinare una disfunzione
globale della contrattilità ventricolare con conseguente
dilatazione miocardica e sintomi di scompenso. In effetti,
questo meccanismo è ritenuto possa essere responsabile
(o almeno implicato) nei casi di cosiddetta cardiomiopatia postischemica, in cui una compromissione globale
della contrattilità cardiaca si verifica in pazienti con una
malattia coronarica significativa senza storia clinica di
infarto miocardico e anche di evidenti aree infartuate alle
tecniche di imaging (si veda il Capitolo 2). Questo quadro,
tuttavia, potrebbe anche essere spiegato con la perdita di
miocardiociti causata dall’ischemia mediante un meccanismo di apoptosi, piuttosto che di necrosi. L’apoptosi è
una forma di morte programmata nella quale le cellule
si frammentano in piccoli corpiccioli, detti corpi apoptotici, ancora avvolti da una membrana cellulare, i quali
vengono inglobati da cellule fagocitiche. Alla perdita di
cellule miocardiche per apoptosi segue un riadattamento
delle cellule rimanenti con rimodellamento e dilatazione
ventricolare.
È da ricordare che il recupero contrattile del miocardio
ventricolare dopo un’ischemia transitoria può non avvenire prontamente, nonostante il ripristino di un normale
flusso coronarico, ma solo dopo diversi minuti o, in casi
di ischemia grave e/o sufficientemente prolungata, anche
ore o addirittura giorni dal ripristino del flusso coronarico,
un fenomeno che viene definito “stordimento” (stunning)
miocardico.
D’altro canto, vi sono casi in cui una grave ed estesa malattia coronarica può causare facilmente e frequentemente
ischemia miocardica, e in cui, anzi, può esistere uno stato
di riduzione del flusso coronarico già a riposo; in questa
condizione le cellule miocardiche possono subire modificazioni che le portano ad adattarsi allo stato di grave
carenza di apporto ematico, sviluppando uno stato di
ipocontrattilità cronica, che, determinando una marcata
riduzione del loro fabbisogno di ossigeno, consente loro di
sopravvivere; questa condizione è definita “ibernazione”
miocardica (hibernation).
Alterazioni della funzione diastolica
L’ischemia miocardica altera non solo la contrazione,
ma anche il rilasciamento ventricolare, come dimostra il
prolungamento del periodo di rilasciamento isovolumetrico, con rallentamento della riduzione della pressione
(dP/dt negativo) durante la fase iniziale della diastole.
Queste alterazioni ostacolano il normale riempimento
ventricolare e contribuiscono, insieme alla disfunzione
contrattile sistolica, a provocare l’aumento della pressione diastolica che conduce a una congestione venosa
a monte.
107
1
108
Parte 1 - MALATTIE DEL SISTEMA CIRCOLATORIO
Alterazioni elettriche
L’ischemia miocardica altera in modo rilevante le proprietà
elettriche delle cellule miocardiche, molte delle quali sono
mantenute grazie a pompe ioniche che consumano energia (e quindi ossigeno), causando anomalie della fase di
depolarizzazione e/o di ripolarizzazione, che si riflettono
sull’elettrocardiogramma (ECG).
Alterazioni del tratto ST
L’ischemia acuta del miocardio è caratterizzata all’ECG
principalmente da modificazioni del tratto ST. Il tipo e la
sede di queste modificazioni dipendono dalla sede e/o dal
grado di ischemia. È utile ricordare che nella terminologia
elettrocardiografica classica le alterazioni del tratto ST che
compaiono come conseguenza dell’ischemia miocardica sono indicate con il termine “lesione”, termine che
ancora oggi è spesso usato per la descrizione di queste
modificazioni.
Le basi elettrofisiologiche che determinano la comparsa delle tipiche alterazioni del tratto ST all’ECG durante ischemia
miocardica possono essere riassunte come segue (Fig. 5.4).
• La fase di depolarizzazione è alterata, con
riduzione dell’ampiezza del potenziale di azione e
rallentamento della velocità di ascesa (fase 0), che si
traduce in un rallentamento della depolarizzazione
della regione ischemica; allo stesso tempo si ha
una riduzione della durata del potenziale di azione,
con accorciamento delle fasi 2 e 3; ciò determina,
durante la sistole, una differenza di potenziale tra
tessuto sano e tessuto ischemico che genera un flusso
di corrente diretto verso quest’ultimo.
• Il processo di ripolarizzazione delle cellule
miocardiche ischemiche, d’altro canto, può essere
incompleto, per cui il potenziale di membrana a
riposo può attestarsi intorno a −70 mV invece che
ai normali −90 mV; questo determina, durante la
diastole, una differenza di potenziale tra tessuto sano
e tessuto ischemico che genera un flusso di corrente
diretto verso il primo.
È da notare che, sebbene dal punto di vista elettrofisiologico
sia la corrente anomala sistolica sia quella diastolica possano
contribuire a determinare le alterazioni rilevabili all’ECG in
caso di ischemia miocardica, in effetti la prima è quella che
verosimilmente svolge il ruolo maggiore, ed è quindi con
riferimento a questa che, per semplicità, si discutono di seguito le conseguenze dell’ischemia sul tratto ST all’ECG.
Il tipo di modificazione del tratto ST osservabile all’ECG
dipende anzitutto dalla localizzazione dell’ischemia nel
miocardio, vale a dire se essa interessa solo o prevalentemente gli strati subendocardici, come avviene nelle forme più
frequenti di ischemia, o interessa la parete miocardica a tutto
spessore, e quindi coinvolge anche gli strati subepicardici.
• In caso di ischemia subendocardica, durante la
sistole si genererà una corrente di lesione diretta
dall’epicardio all’endocardio. In termini vettoriali,
ciò si traduce in un vettore di lesione che si dirige
dal tessuto sano verso il subendocardio. Se si pone
un elettrodo esplorante sulla parete toracica, questo
vedrà il vettore allontanarsi, per cui nella derivazione
corrispondente si registrerà un sottoslivellamento del
tratto ST (si veda Fig. 5.4).
Figura 5.4
Schema delle
due teorie alla
base della genesi
delle alterazioni
ischemiche del
tratto ST all’ECG.
Come esempio
viene illustrato il
caso dell’ischemia
subendocardica
(regione marrone
della sezione
della parete
ventricolare
sinistra).
Teoria sistolica (in alto): durante la diastole non vi sono differenze di potenziale tra le cellule della regione ischemica e non ischemica; il potenziale di membrana a riposo (fase 4) del potenziale
di azione è infatti identico nelle cellule delle due regioni. Durante la sistole, tuttavia, il potenziale di azione delle cellule ischemiche (IS) è meno positivo (l’esterno delle cellule è quindi più
positivo) delle cellule non ischemiche (NI); ciò determina un flusso di corrente diretto verso la regione ischemica endocardica (Endo), che si allontana, quindi, dall’elettrodo esplorante posto
sul torace (E); ne risulta la registrazione all’ECG di un sottoslivellamento del tratto ST. Teoria diastolica (in basso): secondo questa teoria, all’induzione dell’ischemia, il potenziale di membrana
a riposo diventa minore nelle cellule ischemiche (IS) rispetto a quelle non ischemiche (NI); ciò determina un flusso di corrente in diastole che si allontana dalla regione ischemica ed è diretto,
quindi, verso l’elettrodo toracico esplorante E; ne deriva un sopraslivellamento del tratto T-P, che apparirà all’ECG come linea isoelettrica, quando in realtà essa è posizionata al di sopra della
reale linea isoelettrica (linea tratteggiata); durante la sistole non vi sono differenze di potenziale tra la regione ischemica e non ischemica, per cui il tratto ST torna alla reale linea isoelettrica,
determinando la comparsa di un apparente sottoslivellamento del tratto ST.
Capitolo 5 - Cardiopatia ischemica
• In caso di ischemia transmurale, le alterazioni
elettrofisiologiche riguardano le cellule dell’intero
spessore della parete miocardica della regione
ischemica. In termini vettoriali ciò si traduce in
un vettore di lesione che si dirige dal tessuto sano
verso il tessuto ischemico, che comprende anche
il subepicardio. Se si pone un elettrodo esplorante
sulla parete toracica, esso si troverà a più diretto
contatto con l’area ischemica del subepicardio.
Ne conseguirà un vettore di lesione (corrente di
lesione) diretto verso l’elettrodo esplorante,
e quindi la registrazione all’ECG di un onda
positiva, vale a dire un sopraslivellamento del
tratto ST (Fig. 5.5).
Alterazioni dell’onda T
In pazienti con episodi di ischemia miocardica si possono osservare spesso all’ECG anomalie dell’onda T, che
rappresenta la fase di ripolarizzazione dei ventricoli. In
effetti, classicamente il termine “ischemia” all’ECG è stato applicato proprio alle alterazioni dell’onda T, ma si
è poi evidenziato come in realtà tali modificazioni solo
occasionalmente sono quelle che si manifestano quando
si instaura un’ischemia acuta del miocardio, mentre più
spesso si possono osservare in associazione o alla risoluzione delle alterazioni del tratto ST o come anomalie
croniche in aree soggette a ischemia, caratterizzate dalla
negativizzazione dell’onda T, classicamente con morfologia a branche simmetriche (Fig. 5.6). Un’onda T negativa,
inoltre, rimane spesso per molto tempo o indefinitamente
nelle derivazioni che mostrano i segni di una pregressa
necrosi miocardica.
Queste alterazioni sembrano legate a un prolungamento della fase 3 del potenziale di azione, e quindi della
ripolarizzazione ventricolare, nelle aree ischemiche. Ciò
crea, durante la fase di ripolarizzazione, una differenza
di potenziale tra la regione ischemica (che rimane più a
lungo negativa) e le aree non ischemiche che causa un
flusso di corrente che si allontana dalla prima (si ricorda,
infatti, che, per convenzione, il vettore di una corrente
elettrica ha sempre il verso diretto verso le aree con cari-
che positive). Così, un elettrodo esplorante posizionato
sulla regione ischemica vedrà allontanarsi il vettore della
corrente, dando origine nella derivazione corrispondente
a un’onda T negativa.
Si deve osservare che in alcuni pazienti con ischemia
acuta si può notare la comparsa all’ECG di onde T alte,
strette e appuntite (onde T “a tenda”) (Fig. 5.7). Queste
alterazioni si possono rilevare in particolare nelle primissime fasi di un infarto miocardico acuto (ischemia
iperacuta) e sono indicative di un’ischemia localizzata
agli strati subendocardici. Un’ischemia che determini un ritardo della ripolarizzazione nella sola regione
subendocardica, infatti, causa durante questa fase un
flusso di corrente che si allontana dal subendocardio ed
è diretto verso l’epicardio; di conseguenza, un elettrodo
localizzato sul torace registra un’onda T positiva con le
peculiarità descritte. La registrazione di onde T alte e
appuntite come segno di ischemia subendocardica acuta
all’ECG è tuttavia rara, in quanto esse sono in genere
fugaci e presto sovrastate dalle più classiche e durature
alterazioni del tratto ST.
109
1
Figura 5.5
Genesi del
sopraslivellamento
del tratto ST
durante ischemia
miocardica
transmurale in
base alla teoria
sistolica (si veda
Fig. 5.4).
Tutta le regione ischemica si presenta meno negativa in sistole rispetto alle circostanti regioni
non ischemiche. Il flusso di corrente diretto verso la regione ischemica interessa anche il
subepicardio (Epi), per cui l’elettrodo esplorante (E) registra in questa fase una corrente
diretta verso di essa, e quindi un sopraslivellamento del tratto ST.
Figura 5.6
Onde T
cronicamente
negative in sede
antero-laterale in
un paziente con
storia di angina
da sforzo.
110
Parte 1 - MALATTIE DEL SISTEMA CIRCOLATORIO
Figura 5.7
Onde T alte
e appuntite
indicative
di ischemia
subendocardica
acuta registrate
durante un
episodio di
angina.
Onda Q di necrosi miocardica
Quando si verifica la necrosi di una regione miocardica
(infarto), questa non conterrà più cellule elettricamente
attive; essa, cioè, diviene “elettricamente muta”. All’ECG
ciò determina la comparsa di un’onda Q patologica nelle
derivazioni prospicienti la necrosi.
Per comprendere il motivo della comparsa di onde Q nelle
derivazioni ECG che esplorano una regione miocardica
colpita da infarto bisogna ricordare che normalmente la
depolarizzazione delle pareti ventricolari procede in ogni
regione miocardica dall’endocardio verso l’epicardio; ne
deriva che i vettori di depolarizzazione della parete anteriore sono diretti verso l’avanti, quelli della parete inferiore verso il basso, quelli della parete posteriore all’indietro,
e così via. Quando si determina la necrosi di una regione
del miocardio (infarto miocardico), i vettori diretti verso
quella zona vengono meno, mentre persisteranno i vettori
diretti in senso opposto. Il risultato finale è la comparsa di
un vettore di depolarizzazione che “fugge” dalla zona di
necrosi (Fig. 5.8).
Pertanto, nel caso in cui l’elettrodo esplorante (positivo)
di una derivazione sia posizionato sopra l’area di necrosi,
in quella derivazione si avrà un’onda negativa nella parte
iniziale del QRS, cioè un’onda Q (si veda oltre, Infarto
miocardico acuto con sopraslivellamento del tratto ST). Poiché piccole onde Q sono spesso presenti fisiologicamente
in alcune derivazioni dell’ECG in soggetti normali, perché un’onda Q possa essere considerata patologica, cioè
indicativa di necrosi miocardica, deve avere una durata
Figura 5.8
Schema della
genesi dell’onda
Q nell’infarto
miocardico nelle
derivazioni ECG
prospicienti l’area
di necrosi.
L’area di necrosi (regione in rosso) determina una “finestra” elettrica. Pertanto l’elettrodo
esplorante registra l’attività elettrica della parete opposta.
≥ 0,04 sec. Altri criteri a favore della natura infartuale di
un’onda Q comprendono una profondità (ampiezza) ≥
25% dell’onda R e la presenza di uncinature, soprattutto
nella sua branca discendente.
Va sottolineato che l’onda Q di necrosi è il segno ECG
caratteristico della necrosi miocardica che interessa a tutto
spessore la parete ventricolare (necrosi transmurale). Nei
pazienti con infarto miocardico che interessa solo gli strati
subendocardici, viceversa, si rilevano in genere esclusivamente alterazioni più o meno marcate diffuse del tratto ST
e/o dell’onda T. Se un infarto subendocardico interessa più
della metà dello spessore della parete miocardica, tuttavia,
l’aspetto elettrocardiografico è spesso simile a quello di
un infarto transmurale.
Il dolore ischemico cardiaco
L’ultimo evento della cascata ischemica, in ordine temporale, è il dolore ischemico cardiaco. Se è causato da
un’ischemia transitoria, ed è quindi di breve durata, il
dolore ischemico cardiaco viene definito angina pectoris.
Se è causato da un un’ischemia prolungata o persistente, la
quale finisce inevitabilmente con il causare necrosi miocardica, viene abitualmente definito dolore infartuale. Pertanto angina pectoris e dolore infartuale sono manifestazioni
cliniche di gravità crescente dell’ischemia miocardica.
Meccanismi del dolore ischemico cardiaco
I meccanismi neurofisiologici che portano alla comparsa
di angina, a dispetto della frequenza con cui questo sintomo si verifica nella popolazione, rimangono ancora non
completamente chiariti. È probabile che diversi fattori
contribuiscano a stimolare le fibre dolorifiche miocardiche responsabili del dolore durante l’ischemia. Particolare
importanza si ritiene abbia la liberazione di adenosina, la
quale non solo, come visto, ha un ruolo centrale nella regolazione metabolica del flusso coronarico (mediato dalla
stimolazione dei recettori A2 delle cellule muscolari lisce
arteriolari), ma è anche una potente sostanza algogena
(mediante stimolazione dei recettori A1 sulla membrana
delle cellule nervose cardiache afferenti). Altri stimoli
Capitolo 5 - Cardiopatia ischemica
chimici che potrebbero essere in qualche modo implicati
nella genesi del dolore anginoso comprendono gli ioni K+
e H+ e la bradichinina. Inoltre, anche stimoli meccanici,
legati all’edema e all’aumento della pressione interstiziale
che il processo ischemico causa, potrebbero determinare la
stimolazione delle fibre afferenti dolorifiche cardiache.
Anche le modalità di trasmissione del segnale dolorifico
sono ancora poco note. In particolare, è discusso se lo
stimolo algogeno sia condotto da fibre nervose specializzate in questa funzione (teoria della specificità), o se esso
sia condotto da fibre polimodali che segnalano la natura
dolorifica dello stimolo solo in base all’intensità della loro
eccitabilità (teoria dell’intensità).
In ogni caso, una volta originato, il segnale dolorifico cardiaco viene trasmesso attraverso i nervi simpatici e, in
parte, vagali a livello dei neuroni delle corna dorsali del midollo spinale. Da qui, un secondo neurone porta l’impulso
al talamo e un terzo alla corteccia temporo-parietale, dove
il segnale viene elaborato come dolorifico (Fig. 5.9).
È importante osservare che la trasmissione centrale dello
stimolo dolorifico cardiaco è modulata a vari livelli lungo
il suo percorso. Una delle modulazioni più importanti
avviene probabilmente a livello del midollo spinale, dove
alcuni neuroni sono in grado di inibire la trasmissione
dell’impulso quando lo stimolo è modesto; stimoli dolorifici sufficientemente intensi, d’altro canto, inattivano
questi neuroni consentendo il passaggio dello stimolo
dolorifico (teoria del “gate” di Melzack e Wall).
I secondi neuroni dell’asse neuronale dolorifico cardiaco,
che si trovano nel midollo spinale, ricevono anche, e
soprattutto, fibre che veicolano segnali di provenienza
dalla superficie metamerica cutanea corrispondente. Ne
consegue che, a livello centrale, lo stimolo dolorifico cardiaco sarà riferito a livello superficiale alla regione cutanea
i cui protoneuroni si connettono ai neuroni midollari che
ricevono l’impulso dolorifico durante ischemia miocardica. Nella maggior parte dei casi, le connessioni delle fibre
nervose cardiache a livello centrale non sono specifiche
della regione miocardica di origine, per cui non è possibile
discriminare la sede di provenienza del dolore cardiaco in
base alla sede di riferimento.
Caratteristiche del dolore ischemico cardiaco
Le caratteristiche del dolore ischemico cardiaco comprendono la qualità, la sede, le eventuali irradiazioni, le
modalità di insorgenza e risoluzione, e alcune altre caratteristiche. Queste sono spesso tipiche e consentono di
giungere facilmente alla diagnosi con un’accurata anamnesi. Tuttavia, in non pochi casi le caratteristiche del dolore toracico non sono propriamente tipiche e la diagnosi
richiede una sufficiente capacità di sospetto clinico.
Qualità del dolore Il dolore ischemico cardiaco è tipico
quando si presenta come oppressivo o costrittivo, ma in
alcuni casi può essere di tipo urente o come un senso di
peso. Esso è tipicamente caratterizzato da inizio e cessazione graduali e, elemento importante, non è influenzato
dagli atti respiratori, dalla posizione del corpo e dalla
digitopressione sulla parete toracica.
Localizzazione Tipicamente il dolore ischemico cardiaco
è localizzato in sede retrosternale e il paziente lo indica
spesso ponendo la mano sulla regione sternale.
111
1
Figura 5.9
Schema delle
vie nervose
afferenti coinvolte
nella genesi e
trasmissione del
dolore cardiaco
ischemico.
Lo stimolo algogeno a partenza dal cuore viene condotto ai gangli cardiaci, mediastinici
e toracici, e quindi raggiunge i neuroni situati nelle corna dorsali del midollo spinale.
Se supera questo primo sbarramento (“gate”), raggiunge il talamo mediante il tratto
spinotalamico. Dal talamo viene trasmesso ai centri sensitivi corticali. Questo impulso
è modulato a vario livello da impulsi ascendenti e discendenti in grado di inibire,
o anche potenziare, la trasmissione del segnale.
Irradiazione Il dolore ischemico cardiaco può irradiarsi
verso varie sedi, che in rare occasioni possono essere la
localizzazione principale, o anche unica, del dolore stesso. Le irradiazioni più tipiche del dolore anginoso sono
la superficie ulnare dell’arto superiore sinistro, le spalle
e il collo. Tuttavia, sedi non rare di irradiazione sono
mandibola, epigastrio, regione interscapolo-vertebrale e
anche braccio destro.
Fattori precipitanti L’insorgenza del dolore ischemico
cardiaco è, nella forma più tipica, ricollegabile a una
causa scatenante, anzitutto l’esercizio fisico, ma anche
condizioni di stress emotivo, l’esposizione a una temperatura rigida, il pranzo, un rapporto sessuale, una crisi
ipertensiva. Esso può comunque insorgere anche a riposo
o di notte.
Durata Tipicamente l’angina pectoris dura solo pochi
minuti (da 1-2 a 5-10 min). Tuttavia, nelle forme più gravi,
la durata può arrivare anche a 20-30 min. È importante
sottolineare che una durata maggiore di un tipico dolore
ischemico cardiaco indica una condizione di persistenza
dell’ischemia che porta inevitabilmente a necrosi miocardica (dolore infartuale).
Risposta ai nitrati sublinguali La somministrazione di
trinitrina o isosorbide dinitrato per via sublinguale o buccale (spray) ha la capacità di determinare una regressione
più rapida del dolore anginoso rispetto al decorso spontaneo, con risposta entro 2-5 min dall’assunzione. Somministrati prima di eseguire un’attività nota per essere
112
Parte 1 - MALATTIE DEL SISTEMA CIRCOLATORIO
in grado di causare angina, i nitrati possono prevenire la
comparsa del sintomo. In contrasto, i nitrati sono inefficaci sul dolore infartuale.
Classificazione dell’angina
L’angina può essere classificata in modo diverso a seconda
che si utilizzino criteri fisiopatologici, descrittivi o clinicoprognostici.
Criteri fisiopatologici Sulla base dei meccanismi fisiopatologici che la determinano, l’angina pectoris può essere
distinta in angina primaria e angina secondaria. L’angina
primaria è così detta in quanto dovuta a una primaria riduzione del flusso coronarico. Essa si verifica, quindi, tipicamente a riposo, ed è dovuta a un’ostruzione temporanea
di un vaso coronarico, causata da spasmo coronarico, da
trombosi coronarica transitoria o da entrambi.
L’angina secondaria, viceversa, è quella che insorge solo
secondariamente a un aumento della richiesta di ossigeno
da parte del miocardio (classicamente in relazione a uno
sforzo), che eccede la possibilità di aumento del flusso
coronarico richiesto. Il substrato è in genere rappresentato da stenosi emodinamicamente significative nei vasi
epicardici, ma in alcuni casi l’alterazione risiede in una
disfunzione del microcircolo coronarico,
In clinica i meccanismi fisiopatologici responsabili delle
forme primarie e di quelle secondarie di angina possono
combinarsi in vario modo a determinare gli episodi anginosi in uno stesso paziente, una condizione che viene
spesso definita angina mista.
Criteri descrittivi L’angina viene spesso definita anche
in base a semplici caratteristiche descrittive, che, tuttavia,
sottendono spesso specifici meccanismi fisiopatologici, o
anche, in alcuni casi, particolari implicazioni prognostiche e terapeutiche.
Così, nella pratica clinica sono spesso usati termini quali
angina da freddo (causata dall’esposizione a basse temperature e dovuta a vasocostrizione coronarica e aumento
della pressione arteriosa), angina postprandiale (che si manifesta, in genere, in seguito a sforzi modesti solo quando
effettuati dopo un pasto e può suggerire la presenza di
una malattia coronarica grave), angina da stress (connessa
prevalentemente a situazioni di stress emotivo) e angina da decubito (causata dall’assunzione della posizione
clinostatica, che aumenta il lavoro cardiaco mediante
aumento del precarico).
Quadri descrittivi di angina spesso indicativi di una condizione di alto rischio comprendono, in particolare, l’angina di recente insorgenza (nelle 4 settimane precedenti),
l’angina in crescendo (caratterizzata, in un paziente con
angina da sforzo, da una riduzione progressiva della soglia
ischemica, con comparsa dell’angina per sforzi sempre più
lievi), l’angina a riposo (con episodi spesso ricorrenti e/o di
durata protratta e/o scarsamente sensibili ai nitrati sublinguali) e l’angina precoce postinfartuale (caratterizzata dalla
comparsa di angina, spesso a riposo o per minimi sforzi,
nella fase subacuta di un infarto miocardico acuto).
Criteri prognostici Dal punto di vista delle implicazioni
prognostiche, l’angina viene distinta in due grandi forme,
l’angina stabile e l’angina instabile, che costituiscono le
due principali sindromi anginose della malattia coronarica
e si distinguono principalmente sulla base della stabilità
o meno del quadro clinico nel tempo. L’importanza della
distinzione risiede principalmente nella diversa potenziale
evoluzione a breve termine verso lo sviluppo di sindromi
coronariche più gravi, come l’infarto miocardico e l’arresto cardiaco, che è, come si vedrà, molto bassa nel caso
dell’angina stabile e significativamente più elevata nel
caso dell’angina instabile.
Altre manifestazioni cliniche dell’ischemia
miocardica
È importante notare che, sebbene il dolore ischemico
cardiaco sia il sintomo più frequente e caratteristico
dell’ischemia miocardica, questa in alcuni casi può manifestarsi con altri sintomi, definiti equivalenti anginosi,
che comprendono:
• dispnea, indicativa di un’insufficienza ventricolare
sinistra acuta; ciò si può determinare quando
l’ischemia è sufficientemente estesa da alterare
in modo significativo la funzione sistolica, o anche
diastolica, del ventricolo sinistro, con conseguente
aumento della pressione telediastolica e incremento
della pressione nei capillari polmonari;
• astenia, legata a una riduzione transitoria
della funzione sistolica in grado di causare
una diminuzione della portata con ipoperfusione
muscolare;
• palpitazioni, causate da disturbi del ritmo,
conseguenti all’instabilità elettrica che l’ischemia
miocardica può provocare; il paziente può avvertire
un semplice cardiopalmo o, in casi di aritmie gravi,
soffrire di sincope o lipotimia.
Ischemia silente
La valutazione delle alterazioni del tratto ST e dei sintomi
durante ECG da sforzo, e ancor più durante le normali
attività all’ECG dinamico, ha permesso di evidenziare
come spesso episodi di ischemia miocardica transitoria
non siano associati ad angina, né ad altri sintomi (sono,
cioè, silenti).
I pazienti con ischemia silente possono essere suddivisi
in due gruppi principali: (1) pazienti che non hanno mai
avuto sintomi legati all’ischemia (ischemia costantemente
silente); (2) pazienti che hanno avuto o presentano anche
episodi sintomatici di ischemia (ischemia episodicamente
silente).
Al primo gruppo appartengono soggetti apparentemente
sani, soggetti che hanno sofferto di un infarto miocardico
senza sintomi (che viene scoperto occasionalmente durante la registrazione di un ECG) e soggetti che sviluppano
un’insufficienza cardiaca dovuta a un danno ischemico
progressivo del miocardio senza che sia identificabile un
chiaro infarto miocardico pregresso o una storia di angina
(cardiomiopatia ischemica).
Al secondo gruppo appartengono pazienti con storia di
angina di vario tipo (stabile, instabile, variante, microvascolare), nei quali la maggior parte degli episodi di ischemia transitoria rilevabili con gli esami strumentali sono in
Capitolo 5 - Cardiopatia ischemica
effetti asintomatici (Fig. 5.10), o anche soggetti che dopo
un infarto miocardico acuto sintomatico presentano un
test da sforzo o un ECG dinamico con segni di ischemia
miocardica in assenza di sintomi.
La prevalenza di ischemia miocardica totalmente silente
è difficile da stabilire con certezza. Alcuni studi con ECG
dinamico hanno evidenziato come episodi di sottoslivellamento del tratto ST compatibili con ischemia miocardica
siano riscontrabili solo in una piccola percentuale di soggetti adulti sani asintomatici. Il rischio di eventi cardiaci
in questi soggetti è peraltro molto basso, per cui non si
ritiene giustificato uno screening di massa per evidenziare
un’eventuale ischemia silente nella popolazione sana.
Molto meglio documentati sono i dati riguardanti l’incidenza dell’ischemia episodicamente silente. In base a
studi con ECG dinamico almeno il 70-75% degli episodi
di ischemia transitoria è asintomatico, indipendentemente
dai meccanismi che sono responsabili dell’ischemia. Infine,
la maggior parte dei pazienti con esiti di infarto miocardico
che presentano un test da sforzo positivo per ischemia miocardica residua non riferisce sintomi durante l’esame.
Come detto, i meccanismi fisiopatologici alla base
dell’ischemia silente sono gli stessi di quelli dell’ischemia
sintomatica. Prova indiretta di ciò è che gli episodi silenti
e quelli sintomatici hanno la stessa distribuzione nell’arco
della giornata (si veda Fig. 5.10) e rispondono allo stesso
modo ai diversi interventi terapeutici. Le ragioni per cui
a volte gli episodi sono accompagnati da angina e altre
volte sono completamente asintomatici non sono completamente chiare.
Si è ipotizzato che i pazienti con ischemia silente abbiano
una soglia del dolore più alta. Ad avvalorare questa ipotesi
vi è il riscontro di livelli di endorfine più elevati in questi
soggetti rispetto a quelli con ischemia sintomatica. Questa
ipotesi può essere tuttavia valida per i soggetti con ischemia
costantemente silente, mentre difficilmente può spiegare
perché nello stesso paziente, e in tempi molto ravvicinati,
un episodio sia silente e un altro sintomatico. Per questo
gruppo, che è il più numeroso, si è avanzata l’ipotesi che
il sintomo compaia in rapporto a episodi di ischemia più
gravi e prolungati. Infatti, gli episodi sintomatici rilevati
durante registrazioni di ECG dinamico tendono ad associarsi
a episodi di sottoslivellamento del tratto ST più marcati e
più prolungati. Questa relazione, tuttavia, non è costante;
anche nello stesso individuo, infatti, si possono avere episodi prolungati asintomatici ed episodi brevi accompagnati
da angina. Anche l’ipotesi che la sensazione dolorosa sia legata alla stimolazione dei meccanocettori miocardici, e che
quindi sia presente solo in presenza di un’acuta e marcata
dilatazione ventricolare sinistra conseguente all’ischemia,
non è stata confermata dagli studi clinici.
Un’importante osservazione è che, mentre sarebbe intuitivo ipotizzare che l’assenza del dolore nell’ischemia
silente possa esporre il paziente a un maggiore rischio,
in quanto non allertato dal sintomo sulla presenza di
ischemia e quindi non spinto a interrompere o comunque ad attenuare l’eventuale causa scatenante, di fatto gli
studi clinici non hanno mostrato un rischio maggiore di
eventi nei soggetti con ischemia silente rispetto a quelli
prevalentemente sintomatici.
Poiché i meccanismi fisiopatologici sono gli stessi
dell’ischemia sintomatica, la terapia dell’ischemia silente
non differisce da quella dell’angina e sarà quindi dettata
dalle caratteristiche della storia clinica e degli episodi
ischemici. La consapevolezza che la maggior parte degli
episodi ischemici è asintomatica consiglia di verificare
l’efficacia di una terapia antianginosa non soltano sulla
base dell’andamento dei sintomi, ma anche con controlli
periodici dell’ECG dinamico e con la valutazione delle
alterazioni ECG durante test da sforzo.
113
1
Il dolore ischemico cardiaco come sistema
di allarme
Dal punto di vista pratico è utile considerare il dolore
ischemico cardiaco come il sistema di allarme del cuore,
che suona in caso di pericolo (cioè di ischemia miocardica). Il sistema di allarme cardiaco, come gli altri sistemi
viscerali di allarme, è tuttavia meno efficiente dei sistemi
di allarme somatici.
Infatti, spesso esso non suona quando dovrebbe suonare
(è il caso dell’ischemia silente), altre volte suona eccessivamente in assenza di un danno grave (è il caso, come si
vedrà dell’angina microvascolare); infine, esso non fa capire
chi sta suonando (infatti, il suono è lo stesso indipendentemente dalla causa o dal meccanismo). Tuttavia, il modo
Figura 5.10
Distribuzione
circadiana
di episodi
di ischemia
miocardica rilevati
all’ECG dinamico
di 24 ore.
Distribuzione in: (a) pazienti con angina cronica stabile (episodi di sottoslivellamento del tratto ST); (b) pazienti con angina variante (episodi di sopraslivellamento del tratto ST). In entrambi
i gruppi la maggior parte degli episodi ischemici è silente (in giallo) e solo una minoranza è associata ad angina (in rosso).
114
Parte 1 - MALATTIE DEL SISTEMA CIRCOLATORIO
in cui il suono si ripete può dare informazioni preziose
sulla causa dell’ischemia e, quindi, sulla prognosi. Infatti,
se il suono si ripete sempre allo stesso modo, significa che
le cause che lo determinano sono stabili (è questo il caso
dell’angina stabile e dell’angina microvascolare). Se invece
il suono diventa più frequente, incalzante o prolungato, significa che il livello di allarme è aumentato perché qualcosa
è cambiato in senso peggiorativo, per cui è necessario che
si intervenga in modo appropriato nel più breve tempo (è
questo il caso delle sindromi coronariche acute).
Manifestazioni cliniche della cardiopatia ischemica
La cardiopatia ischemica può manifestarsi come
cardiopatia ischemica cronica o come sindrome
coronarica acuta. La cardiopatia ischemica cronica,
a sua volta, può avere quattro diverse presentazioni
cliniche:
• angina cronica stabile;
• angina microvascolare;
• angina variante;
• cardiomiopatia dilatativa postischemica.
Le sindromi coronariche acute, a loro volta, possono avere
tre diverse presentazioni cliniche:
• sindromi senza sopraslivellamento persistente
del tratto ST;
• sindromi (infarto miocardico acuto) con
sopraslivellamento persistente del tratto ST;
• morte improvvisa coronarica.
In circa il 60% degli uomini e il 40% delle donne la prima manifestazione della cardiopatia ischemica è una
sindrome coronarica acuta. È importante notare che i
diversi quadri clinici della cardiopatia ischemica possono succedersi nel tempo in uno stesso paziente. Per
esempio, l’esordio può essere una sindrome coronarica
acuta, seguita da un periodo di angina stabile. Il periodo
di stabilità può essere interrotto da un secondo episodio
acuto che, se causa la perdita di una quantità rilevante
di miocardio, può essere seguito da un quadro clinico
tipico di miocardiopatia postischemica. Ovviamente sono
possibili diverse altre combinazioni e successioni dei vari
quadri clinici della cardiopatia ischemica.
Le diverse sindromi coronariche hanno alla base specifici meccanismi fisiopatologici, o una loro variabile
combinazione, che sono schematicamente illustrati nella
figura 5.11.
Angina cronica stabile
Definizione
L’angina cronica stabile è caratterizzata da episodi di angina pectoris che presentano caratteristiche costanti da
almeno due mesi. Tipicamente, gli attacchi anginosi sono
causati da sforzi fisici o altre situazioni che aumentano
la domanda miocardica di ossigeno, come stress emotivi
o crisi ipertensive. L’eliminazione del fattore scatenante,
come l’interruzione dello sforzo, determina la regressione
della sintomatologia. È importante sottolineare che la
diagnosi di angina stabile prescinde dalla gravità e dalle
caratteristiche del quadro anginoso, mentre si basa essenzialmente sulla stabilità dei sintomi stessi nel tempo.
La stabilità del quadro clinico è una spia della presenza
di lesioni coronariche croniche, esenti da complicanze
trombotiche acute o recenti.
Fisiopatologia
L’alterazione anatomopatologica fondamentale dell’angina
stabile è rappresentata dalla presenza di placche aterosclerotiche che provocano stenosi di uno o più vasi coronarici
epicardici. Una vasocostrizione a livello di stenosi deformabili può renderle transitoriamente più gravi (stenosi
dinamiche). Anche una disfunzione del microcircolo coronarico, spesso presente in questi pazienti, può modulare le
conseguenze emodinamiche delle stenosi coronariche.
In queste condizioni l’ischemia miocardica si verifica
quando un aumento del fabbisogno di ossigeno da parte
del miocardio non può essere soddisfatto per l’impossibilità di aumentare proporzionalmente il flusso coronarico
a causa della stenosi. L’ischemia che si determina è tipicamente subendocardica.
Sintomatologia
La sintomatologia è prevalentemente costituita dall’angina da sforzo. In alcuni pazienti il carico di lavoro cardiaco
al quale compare l’angina (soglia anginosa) è abbastanza
costante e riproducibile, indicando la presenza di stenosi
coronariche fisse. Più spesso, però, il carico di lavoro al
quale l’angina compare (e quindi la soglia anginosa) è
variabile. Come già detto, questa variabilità può dipendere
dalla presenza di stenosi coronariche dinamiche oppure
da variazioni del tono vasale a livello del microcircolo
coronarico o anche di vasi coronarici collaterali. Inoltre,
anche una risposta variabile in frequenza e pressione
arteriosa allo sforzo in momenti diversi può contribuire
a determinare una variabilità della comparsa dell’angina
per analoghi livelli di esercizio.
Nei pazienti con angina stabile gli episodi anginosi mostrano una tipica distribuzione circadiana, con un picco
principale nelle ore del mattino e un secondo picco nelle
ore pomeridiane (si veda Fig. 5.10). Ciò dipende dall’andamento analogo sia dei maggiori determinanti del consumo miocardico di ossigeno (frequenza cardiaca e pressione
arteriosa), sia del tono vascolare, che risulta aumentato in
queste ore per una più elevata attività a-adrenergica.
Nella valutazione del paziente anginoso è importante
tenere presente il grado di limitazione funzionale indotto
dalla malattia, poiché esso è un indice, per quanto grossolano, della gravità del danno anatomico e ha anche
implicazioni prognostiche. La classificazione della gravità
dell’angina più seguita nella pratica clinica è quella suggerita dalla Canadian Cardiovascular Society, che prevede
quattro classi (Tab. 5.1).
Capitolo 5 - Cardiopatia ischemica
115
1
Figura 5.11
Schema delle
componenti
patogenetiche
dell’ischemia
miocardica
(indicate dai
cerchi grandi).
L’entità del substrato stenotico per ogni sindrome e la sua variabilità nella popolazione sono schematizzate alla base di ogni figura. I cerchi rossi identificano quale o quali componenti operano
nelle singole presentazioni cliniche della cardiopatia ischemica. (Da: Maseri A, op. cit., modificata.)
Diagnosi differenziale del dolore anginoso
Nella diagnosi differenziale dell’angina stabile devono
essere prese in considerazione diverse condizioni pato-
Tabella 5.1 C
lassificazione della gravità dell’angina
proposta dalla Canadian Cardiovascular Society
I
II
Attività fisiche abituali, come camminare o salire le
scale, non causano angina. L’angina compare solo
per sforzi intensi, rapidi o prolungati
Lieve limitazione di attività abituali: l’angina compare
nel camminare o salire le scale rapidamente o
dopo i pasti o in presenza di freddo o vento, o in
condizioni di stress emotivo o solo nelle prime ore
dopo il risveglio. A un passo normale e in normali
condizioni il paziente può camminare in piano per
più di due isolati o salire più di un piano di scale
III
Marcata limitazione delle attività fisiche ordinarie,
come camminare per uno o due isolati o salire più
di un piano di scale a passo normale
IV
Impossibilità di effettuare qualsiasi attività fisica
senza comparsa di angina. L’angina può anche
verificarsi a riposo
logiche caratterizzate, in modo vario, dalla presenza di
dolore toracico transitorio.
Prolasso della mitrale In alcuni casi il dolore può essere
difficilmente differenziabile da quello coronarico, altre volte è localizzato all’emitorace sinistro; i reperti auscultatori e
l’ecocardiogramma consentono di chiarire la diagnosi.
Cardiomiopatia ipertrofica e stenosi aortica In questi
casi il dolore può essere indistinguibile da quello dell’angina; l’esame obiettivo e l’ecocardiografia sono diagnostici.
Disturbi di origine neuromuscolare (costocondrite, sindrome radicolare cervico-dorsale e sindromi infiammatorie
dell’articolazione scapolo-omerale) In questi casi il dolore ha localizzazioni diverse, non è correlato allo sforzo, ha
durata a volte protratta e viene tipicamente esacerbato dai
movimenti e/o dalla digitopressione sulla parete toracica.
Disturbi di origine gastrointestinale (esofagite, ernia
iatale, gastrite, ulcera peptica e, meno frequentemente,
colecistopatia) Nel caso di esofagite ed ernia iatale, la
diagnosi differenziale talora può essere difficile perché la
localizzazione è frequentemente retrosternale e il dolore
può essere costrittivo, anche se più spesso è “urente”; il
reflusso gastroesofageo può, in alcuni casi, essere anche
indotto dallo sforzo; più caratteristica tuttavia è l’esacerbazione postprandiale o correlata all’assunzione della
posizione clinostatica o a piegamenti in avanti. La risposta
alla terapia antiacida aiuta nella diagnosi differenziale,
116
Parte 1 - MALATTIE DEL SISTEMA CIRCOLATORIO
che può essere definitivamente confermata con indagini
radiologiche ed endoscopiche.
Disturbi di origine psicologica (psiconevrosi e somatizzazioni) Disordini di natura psichica possono spesso
associarsi a precordialgie, per lo più tuttavia atipiche. In
ogni caso, queste patologie sono da prendere in considerazione solo dopo attenta esclusione di una causa organica
del dolore toracico.
Esame obiettivo
Di solito l’esame obiettivo non contribuisce in modo
significativo alla diagnosi di angina pectoris, e ciò per
due motivi: (1) solo raramente è possibile esaminare il
paziente durante un attacco anginoso; (2) sia durante la
crisi, sia soprattutto nei periodi intervallari, l’obiettività
è di solito negativa.
Un esame obiettivo generale può essere utile, tuttavia, per
ottenere indicazioni indirette sulla probabilità di malattia
coronarica, evidenziando, per esempio, alcuni fattori di
rischio cardiovascolare, come ipertensione, obesità o xantomi (patognomonici di ipercolesterolemia familiare).
L’esame obiettivo cardiaco, inoltre, può rilevare la presenza di patologie che possono essere causa di dolore toracico
e ischemia miocardica, pur in assenza di malattia coronarica, come la valvulopatia aortica e la cardiomiopatia
ipertrofica, o che si associano con una certa frequenza a
dolori toracici atipici, soprattutto in giovani donne, come
il prolasso della valvola mitrale.
Durante un attacco anginoso, all’ispezione si può talora
osservare la comparsa di un impulso precordiale sistolico
indicativo di una transitoria discinesia ventricolare sinistra
indotta da un’ischemia sufficientemente importante.
All’auscultazione cardiaca, d’altro canto, si può rilevare la
comparsa di un III e/o IV tono, in caso di una significativa
alterazione della funzione sisto-diastolica ventricolare
sinistra indotta dall’ischemia, o di un soffio da insufficienza mitralica, nel caso di una disfunzione dei muscoli
papillari causata dall’ischemia.
Infine, nel caso che l’ischemia interessi una cospicua
porzione di miocardio, si possono manifestare sintomi
di scompenso acuto del ventricolo sinistro (dispnea)
e presenza all’auscultazione toracica di piccoli rumori umidi alle basi polmonari. Caratteristicamente, tutti questi segni, se non sono già presenti prima dell’episodio anginoso,
regrediscono con la risoluzione dell’ischemia miocardica.
Esami di laboratorio Gli esami di laboratorio, in particolare il profilo glicemico e l’assetto lipidico, contribuiscono a definire il profilo di rischio cardiovascolare.
Se suggerito dal quadro clinico, è opportuno valutare la
presenza di patologie che possono facilitare l’ischemia
miocardica come l’anemia (che riduce l’apporto di ossigeno al cuore) e l’ipertiroidismo (che determina attivazione
adrenergica associata a un aumento del consumo miocardico di ossigeno).
ECG a riposo In molti pazienti con angina stabile l’ECG
a riposo è normale o non mostra, comunque, alterazioni
specifiche della presenza di una malattia coronarica. In
diversi casi, tuttavia, l’ECG può mostrare alterazioni che
suggeriscono in modo più o meno rilevante la probabile
natura ischemica dei sintomi del paziente, come un lieve
sottoslivellamento del tratto ST o un’inversione o appiattimento dell’onda T. Altre volte l’ECG può evidenziare
inaspettatamente i segni di un pregresso infarto miocardico o alterazioni poco specifiche, ma che suggeriscono un
approfondimento diagnostico, come un blocco di branca
o aritmie ventricolari.
L’ECG, d’altro canto, consente di effettuare la diagnosi
quando può essere registrato durante un attacco anginoso,
mostrando il segno tipico dell’ischemia subendocardica,
vale a dire un sottoslivellamento orizzontale del tratto ST
uguale o superiore a 1 mm (si veda Fig. 5.4), localizzato
in genere principalmente nelle derivazioni precordiali
laterali (V4-V6). Va sottolineato, infatti, come in caso di
ischemia subendocardica il maggior sottoslivellamento
del tratto ST si osserva quasi invariabilmente in queste
derivazioni (con massima entità di solito nella derivazione
V5) indipendentemente dalla sede anatomica dell’ischemia. Il tratto ST si normalizza nel volgere di pochi minuti
dopo la regressione dell’angina.
Diagnosi
Radiografia del torace Sebbene di solito sia eseguita come
esame di routine, la radiografia del torace è generalmente
del tutto normale in un soggetto affetto da angina pectoris
stabile senza storia di infarto miocardico pregresso. Essa
può talora evidenziare una dilatazione della radice o dell’arco aortico se il paziente è iperteso o ha una valvulopatia
aortica associata, oppure una cardiomegalia con eventuali
segni di stasi polmonare qualora il paziente abbia avuto in
precedenza episodi infartuali di una certa gravità.
In alcuni pazienti la radiografia del torace può mostrare
calcificazioni di pertinenza coronarica, che, in pazienti
con dolore anginoso tipico, sono quasi sempre indicative
della presenza di stenosi coronariche significative.
Nella diagnostica strumentale dell’angina stabile (e della
malattia coronarica in genere) si utilizzano varie indagini,
alcune semplici (come gli esami di laboratorio e l’ECG a
riposo), altre più complesse, quali:
• metodiche elettrocardiografiche (ECG da sforzo; ECG
dinamico secondo Holter);
• metodiche scintigrafiche: scintigrafia miocardica con
tecnezio 99m (99mTc) sestamibi o tallio 201 (201Tl) da
sforzo o da stress farmacologico e a riposo;
• metodiche ecocardiografiche, a riposo e da stress
farmacologico, o anche da sforzo;
• cateterismo cardiaco e angiografia coronarica.
ECG da sforzo L’ECG da sforzo rappresenta il test
principale per la diagnosi di malattia coronarica nei
pazienti con angina stabile. Lo scopo fondamentale
del test da sforzo è quello di determinare un aumento
progressivo e massimale della domanda di ossigeno da
parte del miocardio. Come osservato nella fisiopatologia
dell’ischemia miocardica, in un soggetto normale ciò
non causa alcun sintomo né alterazione dell’ECG, in
quanto il flusso coronarico può essere incrementato in
modo massimale per garantire un apporto di ossigeno
adeguato. Invece, in presenza di stenosi coronariche,
l’impossibilità di incrementare in modo adeguato il
Capitolo 5 - Cardiopatia ischemica
117
1
Figura 5.12
(a) ECG di
base in un
paziente con
angina stabile.
(b) Durante
test da sforzo
comparsa di
sottoslivellamento
del tratto ST in
V2-V6 (massimo
2 mm circa),
diagnostico
di ischemia
miocardica.
flusso oltre un certo limite, dipendente dalla gravità
e dall’estensione delle stenosi, determinerà, oltre un
certo livello di sforzo, la comparsa delle alterazioni ECG
tipiche dell’ischemia miocardica, associate o meno alla
comparsa di angina.
La prova può essere eseguita essenzialmente in due modi:
(1) con cicloergometro (il paziente pedala su una cyclette); (2) con tappeto rotante (il paziente cammina su di
esso). In ambedue i casi, e secondo protocolli prefissati,
lo sforzo compiuto dal soggetto viene progressivamente
­incrementato (aumentando la resistenza della pedaliera
nel primo caso e variando la velocità e l’inclinazione della
pedana nel secondo) in modo da aumentare la frequenza
cardiaca e la pressione arteriosa, e quindi il lavoro e la
richiesta di ossigeno da parte del cuore.
Durante la prova il paziente è monitorato in modo continuo con l’ECG e la misurazione frequente della pressione
arteriosa, il che consente di individuare immediatamente
potenziali situazioni di rischio. Le risposte della frequenza
cardiaca e della pressione arteriosa ai carichi di lavoro
crescenti del test permettono, inoltre, di valutare il livello
di consumo miocardico di ossigeno, espresso come doppio prodotto (si veda in precedenza), che il paziente può
tollerare senza sviluppare ischemia. Il test è interrotto per
esaurimento muscolare o se si verificano condizioni potenzialmente a rischio di complicanze gravi, come angina
ingravescente, modificazioni ischemiche marcate all’ECG,
aritmie maggiori, un eccessivo rialzo della pressione arteriosa o la comparsa di ipotensione.
Il test da sforzo è considerato positivo per ischemia miocardica quando si osserva un sottoslivellamento del tratto ST ad andamento rettilineo o discendente di almeno
1 mm (ischemia subendocardica) in una o più derivazioni
ECG (Fig. 5.12). Solo occasionalmente si può osservare un
sopraslivellamento del tratto ST (≥ 1 mm), indicativo di
un’ischemia più grave (transmurale), dovuta in genere a
118
Parte 1 - MALATTIE DEL SISTEMA CIRCOLATORIO
spasmo occlusivo o a stenosi serrata prossimale di un vaso
coronarico (di solito l’arteria discendente anteriore).
Se un test da sforzo è positivo è importante considerare:
• a quale carico di lavoro si manifestano le alterazioni
ischemiche; infatti, alterazioni ECG che compaiono
pochi minuti dopo l’inizio dell’esercizio e/o a bassi
valori di doppio prodotto hanno un significato più
grave di quelle che si verificano per sforzi intensi
e/o valori di doppio prodotto elevati; più basso è
il doppio prodotto al quale l’ischemia miocardica
compare (ossia più ridotta è la riserva coronarica),
più grave è la coronaropatia. Elemento importante,
queste informazioni possono essere ottenute sia
in assenza di terapia sia per valutare gli effetti
di eventuali trattamenti;
• il tempo necessario per il ritorno delle alterazioni
ECG alle condizioni basali dopo la fine dello sforzo
(periodo di recupero); una normalizzazione lenta
(oltre 5 min), infatti, indica in genere una sofferenza
ischemica particolarmente grave del miocardio.
Relativamente all’affidabilità diagnostica dell’ECG da sforzo,
vale a dire alla sua capacità di individuare la presenza di una
malattia coronarica ostruttiva significativa quando essa è
presente (sensibilità del test) e di escluderla quando è assente
(specificità del test), va osservato che esso, come ogni test, è
gravato da un certo numero di possibili errori diagnostici.
Così, in diversi casi il test induce il tipico sottoslivellamento del tratto ST, ma l’angiografia coronarica non mostra
stenosi significative (falsi positivi), mentre in altri il test
non mostra alcuna significativa alterazione dell’ECG, ma
l’angiografia coronarica mostra una o più stenosi critiche
(falsi negativi).
I falsi positivi sono tanto più frequenti quanto più i soggetti sottoposti all’esame fanno parte di una popolazione con
una bassa probabilità pre-test di avere una malattia coronarica ostruttiva (per esempio, donne giovani senza fattori di
rischio). In generale, infatti, la predittività di un test positivo dipende dalla prevalenza della malattia (la probabilità
pre-test, appunto) nella popolazione esaminata.
I falsi negativi, d’altro canto, sono più frequenti nei soggetti in cui l’ischemia coinvolge la parete posteriore e
posterolaterale del cuore (territorio dell’arteria coronaria
circonflessa sinistra), la cui attività elettrica non è sempre
esplorata in modo adeguato dall’ECG standard.
Figura 5.13
Immagini in asse
lungo sagittale
(a) e apicale
(b), ortogonali
fra loro, di una
scintigrafia
miocardica.
La scintigrafia è stata eseguita con 99mTc al picco di un test da sforzo e dopo 4 ore,
a riposo, in un paziente con angina da sforzo. È apprezzabile al picco dello sforzo un difetto
di perfusione della parete inferiore e laterale (frecce), che si normalizza a riposo, indicando
la presenza di una marcata ischemia miocardica transitoria.
ECG dinamico secondo Holter L’ECG dinamico consiste
nella registrazione continua dell’elettrocardiogramma per
24-48 ore. L’apparecchiatura necessaria consta di un piccolo
registratore portatile collegato a elettrodi posti sul torace del
soggetto in esame. Sono generalmente registrate in continuo,
su cassetta o su memoria a stato solido, 2 o 3 derivazioni ECG
(oggi anche tutte e 12 le derivazioni). Il paziente tiene inoltre
un diario delle sue attività giornaliere, segnalando anche la
comparsa di eventuali sintomi. Con i sistemi moderni, al
termine dell’esame, l’ECG continuo viene trasferito rapidamente su un computer e analizzato con un apposito software, che valuta in modo automatico le aritmie e le alterazioni
ischemiche presenti nel periodo di registrazione. Il software
consente la riproduzione dell’ECG di qualsiasi parte della
registrazione e quindi l’analisi automatica può in genere
essere verificata in ogni dettaglio da un operatore.
L’utilità dell’ECG dinamico per la diagnosi di cardiopatia
ischemica è limitata. Infatti, la probabilità di documentare
episodi di ischemia transitoria durante le normali attività
dipende notevolmente dal livello di sforzo al quale compaiono i sintomi, essendo più alta nei pazienti con bassa
soglia ischemica. Tuttavia, in circa il 10% dei pazienti con
angina stabile nei quali l’ECG da sforzo risulta dubbio o
negativo, l’ECG dinamico può consentire la diagnosi di
malattia coronarica documentando episodi di ischemia
miocardica durante il monitoraggio; in genere si tratta di
pazienti che clinicamente presentano una soglia anginosa
da sforzo variabile.
Il maggior vantaggio dell’ECG dinamico è quello di permettere la valutazione del paziente durante la normale
vita quotidiana. Esso consente così di definire numero,
gravità e durata degli episodi ischemici durante la giornata
(carico ischemico totale), di studiarne la relazione con le
attività, di individuare eventuali aritmie associate e, in un
secondo tempo, di valutare più adeguatamente l’effetto
di una terapia antischemica.
Si ricorda, infatti, che la maggior parte degli episodi di
ischemia miocardica, rilevati in base a tipiche alterazioni
ECG, non è associata ad angina (è cioè silente, si veda Fig.
5.10). Un episodio di ischemia subendocardica è diagnosticato all’ECG dinamico quando si osserva un sottoslivellamento del tratto ST orizzontale o discendente ≥ 1 mm
della durata di almeno 1 min.
Metodiche scintigrafiche Attualmente i test utilizzati
per la diagnosi di ischemia miocardica sono sostanzialmente quelli che valutano la perfusione miocardica, per
la quale si utilizzano come radioisotopi il 201Tl o il 99mTc
sestamibi. Il tracciante radioattivo viene abitualmente
somministrato in una vena all’acme di un test da sforzo
e una scintigrafia miocardica viene acquisita subito dopo
e a distanza di 3-4 ore per valutare la distribuzione del
tracciante nella parete ventricolare sinistra.
Il 201Tl è un analogo radioattivo del potassio. Iniettato in
vena, viene rapidamente captato dalle cellule miocardiche. La sua estrazione dal sangue e la sua captazione da
parte delle cellule miocardiche dipendono dalla perfusione coronarica e dall’integrità delle cellule. Se una
regione miocardica diventa ischemica durante il test da
sforzo, essa avrà un flusso coronarico ridotto rispetto alle altre regioni (non ischemiche), per cui le arriverà meno tallio e apparirà quindi ipocaptante alla scintigrafia
Capitolo 5 - Cardiopatia ischemica
e­ seguita subito dopo lo sforzo rispetto alle zone circostanti
(Fig. 5.13). Per confermare la diagnosi di ischemia transitoria
è importante documentare la “normalizzazione” dell’ipocaptazione del 201Tl a distanza. A riposo, infatti, non vi sono
differenze di flusso tra l’area ischemica e ­quelle non ischemiche, per cui, nel volgere di qualche ora, le ­concentrazioni
intracellulari miocardiche del tracciante si equilibrano e non
si notano differenze di captazione tra le varie regioni miocardiche alla scintigrafia acquisita tardivamente. La persistenza
di un difetto di captazione del tracciante a riposo indica
che l’area ipocaptante non è semplicemente ischemica, ma
presenta una vera e propria riduzione del tessuto miocardico
vitale in grado di captare il tracciante. Essa indica, cioè, la
presenza di una necrosi miocardica pregressa. Le medesime
informazioni ottenute con il 201Tl possono essere ottenute
utilizzando come tracciante il 99mTc.
Nei pazienti che non sono in grado di eseguire uno sforzo
si può effettuare una scintigrafia miocardica perfusionale
utilizzando come stress test la somministrazione di farmaci in grado, in presenza di malattia coronarica, di indurre
ischemia. I farmaci utilizzati a tale scopo sono il dipiridamolo o l’adenosina (che accentuano le diseguaglianze
di perfusione tra regioni perfuse da rami coronarici non
stenotici e regioni perfuse da rami coronarici stenotici),
oppure la dobutamina (che aumenta il consumo di ossigeno miocardico, come il test da sforzo). In questi casi, il
tracciante radioattivo viene iniettato al picco della somministrazione del farmaco e a distanza.
La sensibilità degli stress test scintigrafici per la diagnosi
di malattia arteriosa coronarica è superiore a quella del
semplice ECG da sforzo, mentre la loro specificità è simile. Essendo più indaginosi e costosi del semplice ECG da
sforzo, e comportando la somministrazione di sostanze
radioattive, gli stress test scintigrafici non dovrebbero
essere indicati come test iniziali per la diagnosi di cardiopatia ischemica. Essi trovano indicazione, viceversa, nei
casi in cui la diagnosi di cardiopatia ischemica rimanga
dubbia dopo un ECG da sforzo. Gli stress test scintigrafici, tuttavia, hanno indicazione come primo test nei
pazienti che hanno un ECG a riposo con alterazioni che
rendono problematica l’interpretazione di alterazioni
del tratto ST durante lo sforzo, quali blocco di branca
sinistra, sindrome di Wolff-Parkinson-White e ipertrofia
ventricolare sinistra marcata con anomalie significative
della ripolarizzazione.
Metodiche ecocardiografiche In un paziente con sospetta cardiopatia ischemica l’ecocardiogramma basale
è poco utile a scopo diagnostico, ma in alcuni casi può
evidenziare alterazioni regionali della cinesi ventricolare
legate a un pregresso infarto, con zone di ipo- o acinesia
e, talora, di discinesia.
Gli stress test ecocardiografici possono essere utilizzati in
alternativa agli stress test scintigrafici per la diagnosi di
cardiopatia ischemica con le stesse indicazioni. In questi
casi, peraltro, anche in pazienti che possono eseguire lo
sforzo si preferisce utilizzare uno stress farmacologico
(dipiridamolo, adenosina o dobutamina) piuttosto che lo
sforzo, perché esso consente una valutazione più continua
e accurata delle immagini ecografiche durante il test.
In ogni caso l’ecocardiogramma del paziente viene monitorato durante tutto l’esame. Se una regione miocardica divie-
ne ischemica essa sviluppa alterazioni della sua contrattilità,
che, rispetto alle altre aree e anche rispetto alla base, apparirà ridotta (ipocinesia) o assente (acinesia), oppure presenterà un movimento paradosso espansivo durante la sistole
(discinesia). Ancora una volta è importante documentare
la reversibilità dell’alterazione rilevata all’ecocardiogramma
per confermare la transitorietà dell’anomalia legata all’ischemia. Rispetto agli stress test scintigrafici l’eco-stress ha una
maggiore specificità ed è meno costoso, ma ha una minore
sensibilità ed è anche più operatore-dipendente.
Cateterismo cardiaco e angiografia coronarica Il cateterismo cardiaco consiste nell’avanzamento di cateteri,
introdotti in vasi periferici, sino al cuore per una serie di
valutazioni dirette a livello delle camere cardiache e dei
grossi vasi. I cateteri per lo studio dell’aorta, delle arterie
coronarie e del cuore sinistro vengono introdotti mediante puntura percutanea, in anestesia locale, di un’arteria
femorale o di un’arteria radiale. I cateteri per lo studio delle cavità cardiache di destra e dei vasi polmonari, invece,
vengono introdotti per via venosa (dalla vena femorale
o, meno frequentemente, succlavia o giugulare interna).
L’esame utilizza un’apparecchiatura radiologica che permette la visualizzazione dei cateteri, che sono radiopachi,
e ne consente l’accurato posizionamento nelle varie cavità
cardiache o nei grossi vasi.
La metodica permette di:
• misurare le pressioni delle sezioni destre e sinistre
del cuore;
• visualizzare con mezzo di contrasto radiopaco
sia i grossi vasi sia le cavità cardiache; in
particolare, si può visualizzare il ventricolo sinistro
(ventricolografia) e valutarne le dimensioni e la
funzione contrattile globale e regionale;
• incannulare le arterie coronarie destra e sinistra,
e iniettare selettivamente del mezzo di contrasto
nell’albero coronarico in modo da visualizzarne
l’anatomia e le eventuali lesioni aterosclerotiche
stenosanti (coronarografia; Fig. 5.14).
La coronarografia rappresenta l’esame definitivo per la
diagnosi di cardiopatia ischemica su base aterosclerotica, in quanto consente di documentare direttamente la
presenza di stenosi dei grossi vasi epicardici, oltre che di
valutarne il numero e l’entità. Essa non consente, tuttavia, di ottenere informazioni dirette sul microcircolo
coronarico, in quanto non visualizza arterie con diametro
inferiore a 0,5 mm.
Sebbene in mani esperte la coronarografia presenti un bassissimo rischio di complicanze maggiori e una mortalità
inferiore allo 0,1%, essa prevede competenze specifiche,
pertanto va eseguita in ambiente specializzato.
Va sottolineato, inoltre, che l’esame coronarografico fornisce un’informazione quasi esclusivamente anatomica e
fondamentalmente statica dell’albero coronarico, mentre
va ancora ricordato che esistono pazienti con coronarie
angiograficamente normali ma evidenza clinico-strumentale di ischemia miocardica legata a fattori dinamici.
Inoltre la gravità della malattia coronarica non sempre
si correla con la gravità clinica della malattia; non è infrequente, infatti, riscontrare soggetti con aterosclerosi
anche diffusa, ma senza o con modesta evidenza clinica
119
1
120
Parte 1 - MALATTIE DEL SISTEMA CIRCOLATORIO
Figura 5.14
Angiografia
coronarica
normale
(proiezione
anteriore).
(a) Arteria coronaria sinistra, con il tronco comune (TC), l’arteria coronaria discendente anteriore sinistra (LAD) e l’arteria circonflessa (CX). (b) Arteria coronaria destra, con evidenziamento
dell’arteria discendente posteriore (DP). (Da: Falk E, Shah PK, de Feyter PJ, editors. Ischemic heart disease. London: Manson Publ.; 2007, modificata.)
e strumentale di ischemia miocardica grazie allo sviluppo
di circoli collaterali efficienti.
TC coronarica multistrato È oggi possibile ottenere
un quadro coronarografico in modo non invasivo, iniettando il mezzo di contrasto semplicemente in una vena
periferica e utilizzando come tecnica di visualizzazione
dell’albero coronarico la TC multistrato digitalizzata, che
consente di generare anche immagini tridimensionali del
circolo coronarico epicardico. Confrontata con la coronarografia standard, la tecnica ha un’elevata specificità e
una sensibilità anch’essa ormai piuttosto alta per coronaropatia ostruttiva. Pertanto può essere indicata in alcuni
casi in cui non si voglia ricorrere alla coronarografia, ma
si desideri ottenere una diagnosi anatomica sufficientemente sicura. Tuttavia, l’alto costo, la quantità elevata di
radiazioni (equivalente a circa 700 radiografie del torace) a
cui i pazienti sono sottoposti per l’esame e la non perfetta
valutazione di stenosi di gravità intermedia limitano al
momento le applicazioni di questo tipo di esame.
Paradigma diagnostico A conclusione di questo paragrafo, si ritiene utile dare indicazioni riassuntive su quale
dovrebbe essere l’approccio diagnostico al paziente con
sospetta angina stabile. Il clinico dovrebbe scegliere caso
per caso i test effettivamente più utili e appropriati per
chiarire il quesito diagnostico, tenendo presente che ogni
esame ha un costo per la collettività e che, nel caso della
coronarografia, vanno anche considerate le pur basse
mortalità e morbilità correlate alla metodica (Fig. 5.15).
In soggetti con dolore toracico atipico, o chiaramente di
tipo non cardiaco, assenza di particolari fattori di rischio,
obiettività ed ECG normali, la diagnosi di angina pectoris
può essere ragionevolmente esclusa senza ricorrere abitualmente a test di laboratorio. In pazienti con angina tipica o sospetta il primo accertamento da considerare nella
sequenza diagnostica è l’ECG da sforzo, il cui risultato può
guidare il successivo iter diagnostico-terapeutico.
• Se l’ECG da sforzo massimale è negativo
è improbabile la presenza di una coronaropatia
ostruttiva; in particolare, è molto improbabile
la presenza di una forma grave di malattia
coronarica, tale da necessitare di un qualche tipo
di intervento, per cui, in questo caso, non vi è
indicazione all’angiografia coronarica a scopo
diagnostico.
• Se l’ECG da sforzo è positivo la probabilità di
coronaropatia ostruttiva è alta, anche se la positività
del test può essere anche causata da una disfunzione
del microcircolo coronarico in assenza di stenosi
ostruttive (angina microvascolare). Se si sospetta
un’angina microvascolare si possono eseguire alcuni
test per avvalorare questa diagnosi (si veda oltre),
anche se solo una coronarografia potrebbe in molti
casi consentire una diagnosi certa.
• Se l’ECG da sforzo non può essere eseguito o dà un
risultato dubbio, può essere opportuno effettuare
una scintigrafia miocardica o un ecocardiogramma
da sforzo (o con stress farmacologico).
• La coronarografia a scopo diagnostico, infine, può
essere indicata nei casi in cui tutte le metodiche
non invasive non siano riuscite a dirimere con
ragionevole certezza il dubbio diagnostico ed è
importante essere certi dell’assenza di malattia
aterosclerotica coronarica ostruttiva, per esempio
per un particolare tipo di lavoro svolto dal paziente
(pilota di aerei, sportivo agonistico ecc.), per motivi
assicurativi o medico-legali o, talora, semplicemente
per espressa volontà del paziente di dirimere in
modo certo il dubbio diagnostico.
Prognosi e stratificazione del rischio
Mediamente la prognosi dell’angina cronica stabile è buona. Sia la mortalità sia gli eventi coronarici acuti hanno
un’incidenza ormai inferiore al 2% per anno. Alcuni sottogruppi di pazienti, tuttavia, presentano un rischio più
elevato, che può aggirarsi anche intorno al 5%.
Già alcuni dati clinici indicano un decorso peggiore, come
una maggiore gravità della sintomatologia anginosa e
Capitolo 5 - Cardiopatia ischemica
121
1
Figura 5.15
Algoritmo
diagnostico del
paziente con
angina stabile.
SCA = sindrome coronarica acuta. (Da: Camm AJ et al., 2009, op.cit., modificata.)
l’associazione al dolore toracico di dispnea, che suggerisce un’insufficienza ventricolare sinistra secondaria a
un’ischemia miocardica estesa.
Una valutazione più ampia del rischio si avvale, tuttavia, di
esami di laboratorio non invasivi e invasivi. Una significativa riduzione della funzione ventricolare sinistra, indicata
da una frazione di eiezione < 40% all’ecocardiogramma
bidimensionale o ad altro test di immagine, costituisce
uno dei maggiori predittori di eventi clinici in questi pazienti. La mortalità, infatti, aumenta esponenzialmente
con la progressiva riduzione della frazione di eiezione al
di sotto del valore del 40%.
Un’importanza prognostica di rilievo ha anche la capacità
fisica, valutata al test da sforzo. Il rischio di eventi cardiovascolari è tanto maggiore quanto minore è il carico
di lavoro a cui insorgono le manifestazioni ischemiche e
maggiore la gravità di queste ultime. Utilizzando la durata
della prova da sforzo, la presenza di angina e la gravità
del sottoslivellamento del tratto ST osservato durante il
test è possibile ottenere un punteggio che predice con
accuratezza il rischio di futuri eventi cardiovascolari gravi
(Fig. 5.16).
Nei pazienti che non possono sottoporsi a test da sforzo, indicazioni prognostiche possono provenire dall’esecuzione di uno stess test farmacologico scintigrafico o
ecocardiografico. L’estensione dei difetti di perfusione
e/o la comparsa di segni di disfunzione ventricolare sinistra globale alla scintigrafia da stress, e l’estensione delle
anomalie contrattili all’ecocardiogramma da stress sono,
infatti, tutti fattori associati a un significativo peggioramento della prognosi.
Infine, anche l’estensione della malattia aterosclerotica all’angiografia coronarica si associa a una peggiore
evoluzione clinica. Tuttavia, l’esecuzione di un esame
invasivo, quale la coronarografia, per la sola valutazione prognostica non è indicata. L’esame va eseguito solo
quando la stratificazione prognostica ottenuta utilizzando
i dati clinici e i risultati degli esami non invasivi indica
una condizione di medio o alto rischio che suggerisce un
potenziale beneficio dall’esecuzione di un intervento di
rivascolarizzazione miocardica (Fig. 5.17).
Terapia
Terapia medica Uno schema riassuntivo del
trattamento dell’angina stabile è illustrato nella
figura 5.18. Gli obiettivi del trattamento del paziente
con angina stabile e cardiopatia ischemica cronica in
generale sono due:
• riduzione del rischio di eventi coronarici gravi
(morte, infarto);
• riduzione della gravità dell’ischemia e dell’angina.
122
Parte 1 - MALATTIE DEL SISTEMA CIRCOLATORIO
Figura 5.16
Nomogramma
della Duke
University per il
calcolo del rischio
di mortalità in
pazienti con
cardiopatia
ischemica cronica.
Per il calcolo della sopravvivenza viene dapprima tracciata una retta (1 nell’esempio) che congiunge l’asse dell’entità del sottoslivellamento massimo del tratto ST al test da sforzo con l’asse della
gravità dell’angina da sforzo (0 = assenza di angina; 1 = angina che non ha limitato lo sforzo; 2 = angina che ha indotto l’interruzione dello sforzo). Questa retta incrocia l’asse dell’ischemia
in un certo punto. Da questo punto viene tracciata una seconda retta (2 nell’esempio) che si congiunge all’asse della durata di esercizio; questa linea incrocerà la linea della “prognosi” in un
punto che indicherà la sopravvivenza e il rischio del paziente. In basso è illustrato il calcolo del Treadmill Duke Score, che, in assenza del nomogramma, consente la stratificazione dei pazienti
in gruppi a rischio basso (score > 4), medio (score da −11 a +4) e alto (score < −11).
Figura 5.17
Algoritmo
prognosticoterapeutico del
paziente con
angina stabile.
(Da: Camm AJ et al., 2009, op. cit., modificata.)
Capitolo 5 - Cardiopatia ischemica
123
1
Figura 5.18
Algoritmo di
terapia medica
del paziente con
angina stabile.
(Da: Camm AJ et al., 2009, op. cit., modificata.)
Riduzione del rischio di eventi cardiovascolari gravi Il perseguimento di questo obiettivo è basato innanzitutto sulla correzione dello stile di vita allo
scopo di ridurre i fattori di rischio cardiovascolare.
In particolare, sono fondamentali l’astensione dal
fumo, il contenimento dell’indice di massa corporea
(peso in kg/altezza al quadrato in metri) a valori
< 25 kg/m2, un’attività fisica regolare e l’assunzione di
una dieta ricca di frutta e verdura. Il perseguimento di
questo obiettivo è anche basato sull’utilizzo di farmaci che correggono i fattori di rischio cardiovascolare, in particolare ipercolesterolemia (si veda il
Capitolo 4), ipertensione (si veda il Capitolo 2) e
diabete (si veda il Capitolo 68), quando l’ottimizzazione dello stile di vita non è stata sufficiente a
ottenerlo.
Tutti i pazienti con angina cronica stabile devono
inoltre ricevere una terapia antiaggregante con acido
acetilsalicilico, alla dose di 75-160 mg/die. Vi è infatti
evidenza che questa sostanza determina una riduzione significativa degli eventi cardiovascolari gravi.
L’acido acetilsalicilico è controindicato solo in caso
di una storia di allergia o intolleranza al farmaco, di
emorragie in atto o di ulcera peptica attiva. Gli effetti
collaterali più frequenti sono sintomi di irritazione
gastrica ed ecchimosi, quelli più gravi (rari) sono i
sanguinamenti maggiori (principalmente gastrointestinali). Nei pazienti in cui non è possibile utilizzare
l’acido acetilsalicilico si dovrebbe somministrare un
farmaco tienopiridinico, in particolare il clopidogrel,
che agisce antagonizzando il recettore piastrinico per
l’adenosin-difosfato.
L’utilizzo dei b-bloccanti allo scopo di migliorare la
prognosi è indicato solo nei pazienti con evidenza
di infarto miocardico pregresso e/o ridotta funzione
ventricolare sinistra. Infine, nei pazienti con disfunzione ventricolare sinistra o con ipertensione arteriosa è indicato l’uso di ACE-inibitori.
124
Parte 1 - MALATTIE DEL SISTEMA CIRCOLATORIO
Riduzione della gravità dell’ischemia e dell’angina La
terapia dell’attacco anginoso consiste nell’assunzione
di una perla di trinitrina o di un altro nitroderivato
ad azione rapida (per esempio, isosorbide dinitrato)
per via sublinguale o spray buccale. Questi farmaci
sono infatti assorbiti rapidamente attraverso la mucosa del cavo orale e agiscono in 2-5 min, con persistenza dell’effetto per circa 30 min-2 ore. La somministrazione può essere ripetuta dopo 5-10 min se
l’angina persiste. L’effetto antianginoso dei nitrati
si esplica principalmente riducendo il lavoro cardiaco mediante riduzione del precarico, conseguente
alla loro azione vasodilatatrice venosa periferica.
Essi, tuttavia, possono anche ridurre la pressione
arteriosa ed eliminare un’eventuale componente
vasocostrittrice coronarica dell’attacco anginoso.
Tra gli effetti collaterali sono frequenti la cefalea e
l’ipotensione, che talora può determinare lipotimia
o sincope, le quali possono essere evitate consigliando al paziente di assumere questi farmaci in
posizione seduta.
La profilassi farmacologica delle crisi anginose, d’altro
canto, si basa principalmente sull’uso di tre classi di
farmaci: b-bloccanti, calcio-antagonisti e nitrati a
lunga durata di azione.
I b-bloccanti sono i farmaci antischemici di prima
scelta nell’angina stabile. Grazie alla loro attività antiadrenergica, essi riducono il consumo miocardico di ossigeno, riducendo innanzitutto la frequenza
cardiaca, ma anche la pressione arteriosa e la contrattilità miocardica, sia a riposo sia durante sforzo e
stati di stress. Prolungando la diastole, inoltre, questi
farmaci possono anche migliorare la perfusione subendocardica. Tra gli effetti collaterali si ricordano
astenia, ipotensione, broncocostrizione (in soggetti
asmatici), depressione, calo della libido e il possibile
mascheramento di un’ipoglicemia indotta da farmaci
antidiabetici.
I calcio-antagonisti hanno efficacia antianginosa simile a quella dei β-bloccanti. Alcuni calcio-antagonisti
hanno principalmente un’azione vasodilatatrice, altri
invece riducono in prevalenza il consumo miocardico
di ossigeno. Sono farmaci di prima scelta in caso di
controindicazioni o intolleranza ai β-bloccanti, ma
andrebbero comunque evitati in presenza di una significativa depressione della funzione ventricolare sinistra,
in quanto il loro uso è stato associato a un aumento del
rischio di mortalità in questo sottogruppo di pazienti.
Gli effetti collaterali dei calcio-antagonisti comprendono edemi periferici, cefalea, ipotensione e stipsi.
Per la profilassi cronica degli episodi anginosi i nitrati
vengono utilizzati in preparazioni che consentono un
inizio graduale dell’effetto farmacologico con durata prolungata per alcune ore. I nitrati sono efficaci
nell’angina da sforzo nelle fasi iniziali del trattamento, ma il loro uso continuo si associa a una riduzione
del loro effetto a causa dello sviluppo di tolleranza.
È importante tenere presente che, quando un farmaco
antischemico di uno dei tre gruppi è insufficiente a
controllare adeguatamente da solo (monoterapia) gli
attacchi di angina, esso può essere variamente associato a farmaci di un altro gruppo (doppia terapia)
o di entrambi gli altri gruppi (tripla terapia). L’associazione ha maggiori probabilità di successo perché
sfrutta la combinazione dei diversi meccanismi di
azione dei tre gruppi di farmaci sui meccanismi responsabili dell’ischemia miocardica.
In pazienti sintomatici nonostante la migliore terapia
antischemica convenzionale tollerata, è possibile associare alcuni altri farmaci con attività antischemica,
di più recente introduzione e non tutti, peraltro, attualmente disponibili in Italia, come l’ivabradina (che
riduce la frequenza cardiaca inibendo selettivamente la
corrente di auto depolarizzazione del nodo del seno),
la trimetazidina (che migliora il metabolismo energetico cellulare), la ranolazina (un inibitore selettivo
della corrente tardiva del sodio) e il nicorandil (che ha
azione nitrato-simile e di apertura dei canali del K+).
Rivascolarizzazione miocardica per via percutanea o
mediante by-pass aorto-coronarico La rivascolarizzazione miocardica consiste nel ripristinare un flusso
coronarico normale nel territorio miocardico irrorato
da vasi coronarici epicardici con stenosi emodinamicamente significative.
La rivascolarizzazione miocardica può essere ottenuta mediante due forme di intervento, percutanea o
chirurgica, e, come la terapia medica, può avere due
principali indicazioni:
• migliorare i sintomi anginosi in pazienti in cui essi
non sono controllati dalla terapia farmacologica;
• migliorare la prognosi dei pazienti ad alto
­rischio.
Figura 5.19
Schema di
esecuzione di
un intervento
di angioplastica
coronarica con
impianto di stent.
Un catetere con palloncino rivestito da uno stent (rete metallica) è avanzato
a livello della stenosi (a). Il gonfiaggio del palloncino schiaccia la placca aterosclerotica
(b); il catetere con il palloncino viene ritirato mentre lo stent viene rilasciato dove verrà
progressivamente riendotelizzato e inglobato nella parete del vaso, contribuendo a
mantenerlo pervio (c).
Interventi per via percutanea Nella sua forma più semplice la rivascolarizzazione miocardica per via percutanea è rappresentata dall’angioplastica coronarica. La
procedura consiste nell’introdurre nell’arteria ­coronaria
Capitolo 5 - Cardiopatia ischemica
da trattare un apposito catetere munito all’estremo distale di un palloncino gonfiabile. Il palloncino, sgonfio
al momento dell’introduzione del catetere in coronaria, viene posizionato nella sede della stenosi e viene
quindi gonfiato a pressione elevata in modo da schiacciare contro la parete del vaso la placca aterosclerotica
che determina la stenosi, dilatando così il vaso e ripristinando una normale capacità di flusso. Attualmente, nella quasi totalità dei casi, alla dilatazione della
stenosi viene associato l’impianto di uno o più stent,
strutture cilindriche della lunghezza di pochi centimetri e larghezza di pochi millimetri, con parete metallica
a rete. Gli stent vengono espansi all’interno delle coronarie e fatti aderire alla parete del vaso, dove, nel giro
di alcune settimane, vengono rivestiti da endotelio e
diventano parte integrante della parete arteriosa (Fig.
5.19). Gli stent hanno contribuito a ridurre il rischio
di occlusione acuta che talvolta si verifica nella sede
dell’angioplastica, nonché il rischio di recidiva della
stenosi dilatata (ristenosi), un evento che si verifica
soprattutto nei primi 6 mesi dopo la procedura e che
è stato ridotto dall’uso degli stent dal 30-35% circa con
la sola angioplastica al 20-25%. Di recente il fenomeno
della ristenosi è stato ulteriormente ridotto dall’uso di
stent medicati, ovvero di stent che contengono nella
loro parete farmaci chemioterapici che, rilasciati localmente per un certo tempo, contrastano la riformazione
della stenosi grazie ai loro effetti antinfiammatori e
antiproliferativi. Con questi stent l’occorrenza di ristenosi si è assestata intorno al 10% a 6 mesi.
Va sottolineato che i pazienti che effettuano un intervento di rivascolarizzazione con impianto di stent
devono effettuare una terapia antiaggregante con due
farmaci (in genere, acido acetilsalicilico più clopidogrel) per un tempo variabile da 1 a 12 mesi a seconda
del tipo di sindrome coronarica, del tipo di procedura
e di stent usato. Nei primi mesi, infatti, vi è un certo rischio di trombosi acuta a livello del segmento
coronarico trattato, come conseguenza del danno
endoteliale e vascolare causato dall’intervento.
In pazienti con angina stabile il beneficio degli interventi coronarici percutanei consiste nella possibilità di eliminare o migliorare i sintomi anginosi
nei soggetti che non rispondono adeguatamente al
trattamento farmacologico.
By-pass aorto-coronarico Le procedure chirurgiche di
rivascolarizzazione miocardica si basano sull’innesto di
by-pass aorto-coronarici con vena safena o con arterie
autologhe. A tale scopo sono principalmente usate
l’arteria mammaria interna sinistra e, in misura minore,
la destra. In rari e selezionati casi sono stateutilizzate
anche l’arteria gastroepiploica e la radiale. I by-pass
arteriosi sono caratterizzati da un rischio di occlusione
a lungo termine molto più basso rispetto ai by-pass venosi e sono quindi, per quanto possibile, da preferire.
Attualmente è possibile operare con un rischio accettabile anche pazienti con grave compromissione
della funzione ventricolare sinistra ed effettuare bypass multipli senza aumentare il rischio operatorio,
consentendo una rivascolarizzazione completa di tutti
i distretti miocardici ischemici.
L’indicazione alla chirurgia coronarica è attualmente
accettata per tutti i pazienti con episodi anginosi
non controllati dalla terapia medica e giudicati non
trattabili con interventi per via percutanea. Anche in
alcune condizioni di alto rischio, caratterizzate da una
mortalità annuale superiore al 2%, la rivascolarizzazione chirurgica è attualmente il trattamento preferibile, in quanto vi è dimostrazione di una migliore
prognosi a lungo termine. Queste condizioni comprendono la stenosi del tronco comune dell’arteria
coronaria sinistra e la malattia multivasale con ridotta
funzione ventricolare sinistra e/o scarsa tolleranza per
lo sforzo, e/o interessamento della parte prossimale
dell’arteria coronaria discendente anteriore sinistra.
Tuttavia, studi recenti suggeriscono che anche in
alcuni sottogruppi di questi pazienti con cardiopatia
ischemica cronica a più alto rischio il decorso clinico è oggi sovrapponibile con la rivascolarizzazione
percutanea e con la chirurgia. Pertanto, la modalità
di trattamento e di rivascolarizzazione più idonea
per ogni singolo paziente andrebbe di volta in volta
attentamente discussa fra cardiologi clinici, emodinamisti e cardiochirurghi, sulla base del quadro
sintomatologico, clinico e angiografico.
Angina microvascolare
Il termine angina microvascolare vuole indicare un quadro clinico in cui l’angina è causata da disfunzione o
anomalie dei piccoli vasi coronarici arteriosi di resistenza.
Poiché questi vasi non sono visualizzabili alla coronarografia, la diagnosi è abitualmente posta dopo aver escluso
alterazioni anatomiche e funzionali dei vasi coronarici
epicardici. Durante la coronarografia, in realtà, sarebbe
anche possibile documentare direttamente un’alterazione della funzione vasodilatatrice e vasocostrittrice del
microcircolo coronarico studiando la risposta del flusso e
delle resistenze coronariche a stimoli farmacologici, ma
questi test sono indaginosi e richiedono tempo, quindi
non vengono eseguiti di routine.
Nella forma più tipica l’angina microvascolare è caratterizzata da: (1) angina esclusivamente o prevalentemente da
sforzo, sufficientemente tipica da far sospettare la presenza
di stenosi coronariche critiche; (2) sottoslivellamento del
tratto ST indicativo di ischemia miocardica al test da sforzo; (3) arterie coronarie normali all’angiografia, in assenza
di evidenza di spasmo coronarico spontaneo o provocato
(Fig. 5.20). Questo quadro clinico è comunemente noto
anche con il termine di sindrome X cardiaca.
I pazienti con angina microvascolare costituiscono fino al
20% di quelli che sono sottoposti a coronarografia per angina da sforzo e comprendono per la maggior parte donne
(circa il 70%). Sebbene vi siano diverse ipotesi sull’origine
del dolore toracico in questi pazienti, numerosi sono i dati
che indicano che la causa dei sintomi sia effettivamente
una condizione di ischemia miocardica dovuta a una
disfunzione dei piccoli vasi coronarici di resistenza.
125
1
126
Parte 1 - MALATTIE DEL SISTEMA CIRCOLATORIO
Figura 5.20
Sottoslivellamento
del tratto ST
diagnostico
di ischemia
miocardica
durante test da
sforzo in due
pazienti con
angina da sforzo.
L’angiografia coronarica in basso mostra nel primo caso (a) una stenosi significativa dell’arteria coronaria discendente anteriore sinistra (freccia); viceversa, nel secondo caso (b) l’angiografia
coronarica mostra arterie coronarie epicardiche completamente normali, suggerendo un’origine microvascolare dell’angina. (Da: Camm AJ et al., 2009, op. cit., modificata.)
In molti pazienti l’origine cardiaca ischemica è suggerita,
oltre che dalle alterazioni ECG durante dolore, anche da
alterazioni della perfusione miocardica alla scintigrafia
miocardica da sforzo e da alterazioni del flusso coronarico in risposta a stimoli sia vasodilatatori (dipiridamolo,
papaverina, pacing atriale, acetilcolina) sia vasocostrittori
(ergonovina, iperventilazione).
Un’obiezione all’origine ischemica del quadro clinico
della sindrome X cardiaca è rappresentata dall’assenza
di alterazioni della contrattilità miocardica all’ecocardiogramma durante angina. Tuttavia, una distribuzione
parcellare dell’alterazione del microcircolo può spiegare
l’assenza di tali alterazioni, a dispetto dell’induzione di
alterazioni ECG e sintomi.
Le cause della disfunzione microvascolare non sono completamente note. Alterazioni strutturali delle arteriole
sono rare, mentre sono state riportate diverse alterazioni
in grado di influenzare la funzione del microcircolo coronarico. Tra queste si ricordano alterazioni della funzione adrenergica, un deficit di produzione del fattore di
rilasciamento vascolare derivato dall’endotelio (EDRF),
un aumentato rilascio di endotelina 1 a livello coronarico, un aumento dell’attività dello scambiatore Na+-H+
di membrana, un’aumentata insulino-resistenza, un aumento dello stato infiammatorio e, nelle donne, un deficit
ormonale estrogenico. È probabile, comunque, che i meccanismi della disfunzione microvascolare siano differenti,
e possibilmente molteplici, nei diversi pazienti.
Diversi dati indicano che un numero significativo di pazienti con angina microvascolare presenta anche un’aumentata percezione dolorifica degli stimoli cardiaci (per
esempio, diversi pazienti riferiscono dolore tipico durante
pacing ventricolare o manipolazione intracardiaca di cateteri). Questa componente può facilitare la comparsa di
dolore anche per lievi gradi di ischemia, spiegando così la
forte sintomaticità di questi pazienti. Le cause dell’aumentata nocicettività cardiaca non sono attualmente note,
ma è possibile che essa sia facilitata dalla stessa ischemia
miocrovascolare cronica che può, a lungo termine, causare un’alterazione della responsività delle fibre afferenti
dolorifiche cardiache a stimoli abitualmente innocui.
La diagnosi di angina microvascolare si basa sul quadro
clinico e sulla dimostrazione di arterie coronarie normali
alla coronarografia. Il sospetto clinico sulla base dei soli
sintomi è in genere difficile, ma l’angina da sforzo può presentare caratteri di aspecificità, come, in particolare, una
durata prolungata del dolore dopo l’interruzione dello sforzo o la lenta e/o incostante risposta ai nitrati sublinguali.
Anche i test diagnostici non aiutano in genere nella diagnosi differenziale fra angina causata da stenosi coronariche e
angina microvascolare. Il sottoslivellamento del tratto ST
all’ECG da sforzo e i difetti di perfusione alla scintigrafia
miocardica da sforzo sono simili a quelli dei pazienti con
stenosi coronariche. Un mancato miglioramento delle
alterazioni ST al test da sforzo dopo preventiva somministrazione di nitrati sublinguali e l’assenza di alterazioni
Capitolo 5 - Cardiopatia ischemica
della contrattilità miocardica all’ecocardiogramma da stress
in presenza di angina e sottoslivellamento ST sono due importanti indizi di un’origine microvascolare dell’angina.
La prognosi di questi pazienti è ottima. L’incidenza di
eventi cardiaci maggiori (morte, infarto miocardico), infatti, è simile a quella della popolazione generale. Diversi
pazienti, tuttavia, vanno incontro a un peggioramento del
quadro clinico nel tempo, con episodi anginosi sempre
più frequenti, prolungati e insorgenti anche a riposo, che
diventano difficilmente trattabili e compromettono anche
le normali attività quotidiane. Per queste ragioni l’angina
microvascolare può essere una malattia importante dal
punto di vista individuale, sociale e anche economico.
La terapia degli episodi anginosi si basa sull’uso dei classici
farmaci antischemici (b-bloccanti, calcio-antagonisti e
nitrati), ma anche su alcuni farmaci alternativi, finalizzati
a migliorare la funzione del microcircolo e/o la nocicettività cardiaca. Tra questi si ricordano i derivati xantinici
(teofillina, bamifillina), gli ACE-inibitori, le statine, gli
a-bloccanti, l’imipramina e, nelle donne in menopausa,
la terapia estrogenica.
Angina variante
127
1
L’angina variante o angina di Prinzmetal è così detta in
quanto, in contrasto con la più comune angina da sforzo,
si verifica esclusivamente o prevalentemente a riposo e si
associa a sopraslivellamento, anziché a sottoslivellamento, del tratto ST all’ECG, segno, come visto, di ischemia
miocardica transmurale (Fig. 5.21). L’esecuzione dell’angiografia coronarica durante attacchi anginosi spontanei
Figura 5.21
Quadro tipico
dell’angina
variante di
Prinzmetal.
(a) Nell’ECG registrato durante un dolore anginoso insorto a riposo in corso di visita cardiologica, si osserva un sopraslivellamento del tratto ST in V1-V5, che regredisce rapidamente e
completamente dopo somministrazione di nitroglicerina per via sublinguale (b). (Da: Falk E et al., op. cit., modificata.)
128
Parte 1 - MALATTIE DEL SISTEMA CIRCOLATORIO
Figura 5.22
Altro esempio di
angina variante di
Prinzmetal.
(a) Si osservano, durante dolore anginoso insorto in corso di coronarografia, un’occlusione totale dell’arteria circonflessa (freccia sinistra) e una subocclusione dell’arteria discendente anteriore
(freccia destra), associate a marcato sopraslivellamento del tratto ST alle derivazioni ECG di monitoraggio (in basso). (b) Dopo nitroglicerina e.v. si osserva totale normalizzazione del quadro
angiografico (in alto) e dell’ECG (in basso), che confermano l’origine vasospastica delle occlusioni coronariche. (Da: Camm AJ et al., 2009, op. cit., modificata.)
o provocati ha dimostrato che essa è dovuta a uno spasm
oocclusivo o subocclusivo del segmento di un’arteria coronaria epicardica (Fig. 5.22).
Lo spasmo si può verificare sia a livello di una stenosi
coronarica, che può a sua volta essere significativa o non
significativa, sia in un vaso del tutto normale. In un piccolo numero di pazienti lo spasmo può coinvolgere più
vasi (spasmo multivasale). In alcuni pazienti, inoltre, lo
spasmo può essere diffuso.
Le cause dello spasmo coronarico non sono note. In particolare, i pazienti con angina variante non presentano
particolari fattori di rischio coronarico, sebbene molti
siano fumatori e alcuni riferiscano un aumentato consumo di alcol. L’uso di alcune sostanze (per esempio,
cocaina, sumatriptan e 5-fluorouracile) e la combinazione
contraccettivi-fumo, tuttavia, mostrano una significativa
associazione con lo sviluppo di un’angina vasospastica. In
ogni caso, appare chiaro che l’alterazione fondamentale
agisce determinando un’iperreattività locale delle cellule
muscolari lisce vasali a vari tipi di stimoli vasocostrittori
che agiscono attraverso meccanismi differenti e coinvolgono sistemi recettoriali diversi (catecolamine, acetilcolina, serotonina, istamina, alcalosi ecc.).
La diagnosi di angina variante è anzitutto clinica. Essa va
sempre sospettata quando un paziente riferisce episodi
anginosi a riposo, senza apparenti cause scatenanti. Gli
episodi durano in genere 2-10 min (ma a volte anche solo
30 sec), talora recidivano a breve distanza di tempo. Gli
attacchi anginosi possono mostrare anche un pattern
circadiano, con prevalenza più spesso notturna o nelle
prime ore del mattino (si veda Fig. 5.10). In circa un quarto dei casi lo spasmo può essere indotto anche da sforzi
intensi, per cui il paziente riferisce anche dolore durante
o immediatamente dopo uno sforzo. In alcuni pazienti gli
episodi anginosi possono scomparire anche per diverso
tempo (fasi fredde) per poi ricomparire inaspettatamente
con elevata frequenza (fasi calde).
L’occorrenza di palpitazioni, lipotimie o sincopi durante gli
attacchi anginosi deve fare sospettare la presenza di tachiaritmie o bradiaritmie potenzialmente pericolose per la vita.
In alcuni pazienti, inoltre, lo spasmo può essere prolungato,
predisponendo allo sviluppo di un infarto miocardico che
può essere favorito dal sovrapporsi di fenomeni trombotici a
livello dell’occlusione causata dallo spasmo. In questi ultimi
due gruppi di pazienti la diagnosi tempestiva di angina vasospastica è particolarmente importante, in quanto il pieno
controllo dello spasmo con appropriata terapia vasodilatatrice permette di prevenire le complicanze gravi.
La conferma diagnostica di angina variante può essere ottenuta dalla documentazione di un sopraslivellamento del
tratto ST all’ECG standard registrato durante un attacco
anginoso spontaneo. Il sopraslivellamento ST può variare
da 1-2 mm sino a 20 mm o più. In alcuni casi, anziché un
sopraslivellamento del tratto ST, l’ECG può evidenziare,
durante angina, una positivizzazione di onde T negative
di base (pseudonormalizzazione).
Quando non si riesce a registrare un ECG durante angina,
spesso la diagnosi può essere posta con un ECG dinamico
di 24-48 ore, che consente di documentare episodi di sopraslivellamento del tratto ST tipici anche in assenza di
Capitolo 5 - Cardiopatia ischemica
sintomi, essendo la maggior parte degli episodi di ischemia, anche in questo caso, silente. In alcuni casi una tipica
angina vasospastica può essere indotta dal test da sforzo.
In molti pazienti, tuttavia, il test da sforzo è completamente negativo, soprattutto nei pazienti che presentano
arterie coronarie normali all’angiografia.
Nei casi in cui rimangono dubbi, la diagnosi può essere
ottenuta mediante l’esecuzione di un test provocativo di
spasmo coronarico, in grado di riprodurre tipici sintomi e
alterazioni del tratto ST. Gli stimoli più utilizzati a questo
scopo sono l’ergonovina (endovena o intracoronarica),
l’acetilcolina (intracoronarica) e l’iperventilazione.
La terapia dell’attacco anginoso è costituita principalmente dalla somministrazione di un nitrato per via sub­
linguale (nitroglicerina, isosorbide dinitrato). Questi
­farmaci agiscono infatti rapidamente ed efficacemente
sullo spasmo. La profilassi, viceversa, è basata principalmente sull’uso di calcio-antagonisti, sia diidropiridinici sia
non diidropiridinici. Grazie alla loro elevata efficacia nel
prevenire lo spasmo, questi farmaci non solo controllano i
sintomi, ma migliorano in maniera sostanziale la prognosi
di questi pazienti.
Cardiomiopatia dilatativa
postischemica
In alcuni pazienti il quadro clinico di una malattia coronarica stabile o stabilizzata è dominato dai sintomi e/o
segni di disfunzione ventricolare sinistra, per cui questa
condizione è stata definita cardiomiopatia dilatativa postischemica, che costituisce la forma più frequente di
cardiomiopatia dilatativa nei Paesi occidentali.
La cardiomiopatia dilatativa postischemica può essere causata da un unico ampio infarto miocardico o da
piccoli infarti multipli. In alcuni casi, tuttavia, è la manifestazione iniziale di una malattia coronarica, la cui
patogenesi spesso non è chiara. Infatti, mentre in alcuni
di questi casi vi è evidenza di pregressi infarti (all’ECG
e/o ai test di immagine), evidentemente decorsi in modo
asintomatico, in altri casi non vi è evidenza di pregressi
infarti e l’ecocardiogramma mostra una compromissione diffusa della contrattilità ventricolare. In questi casi
un danno ischemico cronico, con variabili fenomeni
di necrosi focale, danno infiammatorio e apoptosi, è
verosimilmente alla base di una perdita progressiva di
miocardiociti.
I sintomi della cardiomiopatia dilatativa postischemica
sono tipicamente quelli della disfunzione sistolica ventricolare sinistra, principalmente dispnea da sforzo o parossistica notturna e astenia. L’esame obiettivo può evidenziare
edemi declivi e l’auscultazione cardiaca un I tono ridotto, la
presenza di un III tono e, a volte, un soffio sistolico da rigurgito mitralico, secondario alla dilatazione ventricolare sinistra o a disfunzione dei muscoli papillari. All’auscultazione
toracica si possono apprezzare piccoli rantoli basali.
L’ecocardiogramma bidimensionale consente di documentare la riduzione della contrattilità miocardica globale
e l’angiografia coronarica mostra di solito una malattia
coronarica multivasale.
Nei pazienti con cardiomiopatia dilatativa postischemica
è importante stabilire la presenza e l’entità di miocardio
vitale. È possibile, infatti, che in regioni acinetiche, e
quindi apparentemente prive di tessuto miocardico contrattile, sia di fatto ancora presente del miocardio vitale,
anche se meccanicamente inattivo per un adattamento
delle cellule miocardiche a una condizione di basso flusso
coronarico (miocardio ibernato: si veda in precedenza).
L’individuazione di miocardio vitale può essere effettuata
con varie tecniche, tra cui quelle scintigrafiche (utilizzando traccianti che vengono captati dai miocardiociti vitali),
l’eco-stress con dobutamina (che, a basse dosi, attiva la
contrazione di regioni con alterazioni contrattili ma vitali)
e la risonanza magnetica cardiaca (RMC).
La tecnica attualmente più affidabile per la valutazione della vitalità, tuttavia, è la tomografia a emissione di
positroni (PET), che utilizza un isotopo (18F2-fluoro-2desossiglucosio o FDG) in grado di individuare la presenza
di cellule miocardiche metabolicamente attive in quanto
esso viene captato da queste e utilizzato nel ciclo metabolico del glucosio.
La valutazione del miocardio vitale è importante ai fini
del trattamento del paziente. Se infatti il tessuto miocardico vitale in aree acinetiche è di una certa entità, può
essere recuperato ripristinando il flusso coronarico con
un intervento di rivascolarizzazione miocardica, il che
può anche determinare un miglioramento della prognosi.
D’altro canto l’assenza o la presenza limitata di tessuto
miocardico vitale rende inutile qualsiasi tentativo di recupero della contrattilità ventricolare con interventi di
rivascolarizzazione.
La cardiomiopatia dilatativa postischemica è associata a
una prognosi molto più grave rispetto a quella di pazienti
con cardiopatia ischemica cronica e funzione ventricolare
normale o quasi normale. Le ragioni dell’elevato rischio
sono diverse e comprendono la frequente comparsa di
aritmie ventricolari potenzialmente fatali, l’ulteriore compromissione della funzione ventricolare in caso di un
evento ischemico acuto e il rischio maggiore di complicanze tromboemboliche.
La terapia della cardiomiopatia dilatativa postischemica
è analoga a quella di altre forme di scompenso cardiaco
(si veda il Capitolo 12) e comprende l’uso di b-bloccanti
(carvedilolo, anzitutto), ACE-inibitori (o antagonisti del
recettore A1 dell’angiotensina) e diuretici (furosemide o
tiazidici). In pazienti con buona funzione renale (creatininemia < 2,5 mg/dL) e kaliemia < 5,5 mmol/L dovrebbe
essere considerata la somministrazione di un farmaco
antialdosteronico (per esempio, spironolattone), mentre la digossina può essere considerata nei pazienti con
fibrillazione atriale, nei quali è anche indicato l’uso di
anticoagulanti orali. Quando è necessario l’uso di un
antiaritmico, il farmaco di scelta è l’amiodarone.
Un numero significativo di questi pazienti, infine, ha
indicazione all’impianto di un defibrillatore automatico
(si veda il Capitolo 11), per la prevenzione della morte
improvvisa, e/o di un pacemaker biventricolare, in caso
di sintomi di scompenso refrattario alla terapia medica (si
veda il Capitolo 11).
Come già discusso, nei pazienti con evidenza di miocardio vitale è indicato un intervento di rivascolarizzazione
coronarica, prevalentemente con by-pass aorto-coronarico
o, in casi selezionati, con un intervento coronarico percutaneo.
129
1
130
Parte 1 - MALATTIE DEL SISTEMA CIRCOLATORIO
Sindromi coronariche acute senza
sopraslivellamento persistente
del tratto ST
Definizione
Le sindromi coronariche acute senza sopraslivellamento
persistente del tratto ST comprendono l’angina instabile
e l’infarto miocardico acuto senza sopraslivellamento del
tratto ST. Queste due entità nosologiche hanno costituito
sino a pochi anni fa due forme distinte di sindromi coronariche, ma da alcuni anni questi due gruppi di pazienti
sono sempre più inclusi insieme negli studi clinici.
La ragione di ciò risiede nel fatto che sia i meccanismi
fisiopatologici sia l’approccio clinico e terapeutico sono
simili. La maggiore differenza fra le due presentazioni
è che nell’angina instabile non si osserva un aumento
significativo degli indici ematici di necrosi miocardica,
mentre tale aumento viene rilevato nell’infarto.
La distinzione tra angina instabile e infarto miocardico
senza sopraslivellamento ST, peraltro, è stata negli ultimi
anni oggetto di revisione, soprattutto perché è stata proposta una nuova definizione di infarto miocardico sulla
base della quale una significativa proporzione di pazienti
con un quadro clinico classificato sino a qualche anno fa
come angina instabile dovrebbe oggi essere classificata
come infarto miocardico acuto.
La definizione clinica classica di infarto miocardico acuto è basata sulla presenza di almeno due di tre fattori:
(1) dolore toracico tipico di durata pari o superiore a
30 min; (2) alterazioni ECG tipiche; (3) aumento della
CK-MB nel siero di un valore almeno doppio rispetto al
normale.
Nella nuova definizione proposta, invece, l’infarto miocardico acuto dovrebbe essere diagnosticato ogni qualvolta si osserva un qualsiasi aumento, anche minimo, di un
Figura 5.23
Schema dei
meccanismi
fisiopatologici
coinvolti nella
genesi delle
sindromi
coronariche
acute.
indicatore di danno cellulare miocardico (di troponine
in particolare) in un paziente con dolore toracico tipico
anche di breve durata e senza alterazioni ECG.
Patogenesi e anatomia patologica
Negli anni recenti l’analisi congiunta dei reperti anatomopatologici, dei quadri coronarografici (e ora anche
coronaroscopici) e la più approfondita conoscenza dei
meccanismi fisiopatologici ha consentito di stabilire come
il meccanismo fisiopatologico principale comune delle
sindromi coronariche acute senza sopraslivellamento
del tratto ST sia costituito dalla trombosi intracoronarica
subocclusiva. La formazione di un trombo intracoronarico in questi pazienti si verifica abitualmente a livello
di placche aterosclerotiche, non necessariamente emodinamicamente gravi (stenosanti). Il trombo può essere sufficientemente ostruente da determinare ischemia
a riposo, ma, poiché esso non è in genere totalmente
occlusivo, l’ischemia che ne risulta è limitata agli strati
subendocardici. In altri casi, tuttavia, il trombo intracoronarico non è così ostruente da ridurre in modo critico
il flusso coronarico a riposo, ma determina una stenosi
grave che è causa di ischemia miocardica anche in caso di aumento solo modesto della domanda miocardica
di ossigeno. Un’aumentata vasocostrizione, dovuta al
rilascio di sostanze vasoattive a livello del trombo, in
particolare da parte delle piastrine attivate (per esempio,
trombossano A2), può modulare la gravità dell’ischemia.
Quando il trombo e la vasocostrizione sono così gravi da
ridurre in modo critico il flusso a livello subendocardico
per un periodo sufficientemente lungo si determinerà una
necrosi miocardica (infarto subendocardico). Va anche
osservato che un trombo coronarico, anche quando non
stenosante, può causare microinfarti per il verificarsi di
microembolizzazione coronarica distale.
Il substrato anatomopatologico alla base della trombogenesi è rappresentato da complicanze a livello di una
placca aterosclerotica che determinano l’esposizione del
tessuto subendoteliale della placca al sangue circolante;
ciò causa attivazione e aggregazione piastrinica a livello
della placca complicata, e la successiva formazione di un
trombo piastrinico più o meno grande. Le complicanze
in grado di promuovere lo sviluppo di questo processo
sono la rottura o l’ulcerazione della placca aterosclerotica, spesso favorite da un’emorragia intraplacca. Anche la
semplice erosione della superficie endoteliale, comunque,
può innescare i meccanismi trombogeni.
I meccanismi che determinano le complicanze di una
placca aterosclerotica sono ancora poco noti. Dati recenti indicano che un’attivazione di cellule infiammatorie
nella placca abbia un ruolo importante nell’innescare i
meccanismi che portano alla trombosi. Tuttavia, le cause
di questa attivazione sono ancora poco noti, ma potrebbero coinvolgere autoantigeni o agenti microbici. Anche fattori chimici o meccanici (anche questi poco noti)
possono avere un ruolo patogenetico nei pazienti con
sindrome coronarica acuta, soprattutto in quelli che non
presentano aumento degli indici di infiammazione. Una
grave disfunzione dell’endotelio, causata dai vari fattori
patogenetici, potrebbe spesso contribuire a facilitare la
genesi del trombo (Fig. 5.23).
Capitolo 5 - Cardiopatia ischemica
L’evoluzione del trombo condiziona l’evoluzione del quadro clinico delle sindromi coronariche acute senza sopraslivellamento ST. Nella maggior parte dei casi il trombo si
risolve e la lesione responsabile della trombosi si ripara,
per cui nel volgere di alcuni mesi il quadro istopatologico,
e quindi clinico, ritorna a quello esistente prima dell’evento acuto. In alcuni casi il trombo viene organizzato e incluso nella placca sulla quale si è formato, determinando
un aumento del grado di stenosi e, quindi, una riduzione
della soglia ischemica del paziente. In altri casi il trombo
può aumentare di volume e diventare totalmente occlusivo, e causare un infarto transmurale caratterizzato da
sopraslivellamento del tratto ST. Infine va sottolineato
che, risolto il trombo, la placca instabile può non guarire
in modo completo e pertanto essere causa di nuovi episodi
di instabilità coronarica nel breve-medio termine.
Gli episodi anginosi nel paziente con angina instabile
durano pochi minuti, e in ogni caso non più di 20-30 min,
indicando che essi hanno alla base un’ischemia transitoria,
non in grado abitualmente di causare necrosi miocardica
significativa. L’esame obiettivo al di fuori dell’episodio
ischemico (come già visto per l’angina stabile) può essere
normale, mentre anche in questo caso durante un episodio anginoso è importante valutare se compaiono segni
di scompenso cardiaco (dispnea, III tono cardiaco, rumori
umidi alle basi polmonari) che suggeriscono la presenza
di un esteso territorio ischemico a rischio. In accordo
con il quadro clinico, anche le alterazioni ECG associate
all’angina sono transitorie e reversibili. Queste consistono
abitualmente di un sottoslivellamento del tratto ST, indicativo di ischemia subendocardica, o di alterazioni, meno
specifiche, dell’onda T (negativizzazione). Lievi alterazioni
del tratto ST e/o dell’onda T possono talora persistere tra le
crisi. È da sottolineare che in qualche caso, in coincidenza
con l’angina, può aversi sopraslivellamento del tratto
ST, che suggerisce un’occlusione trombotica coronarica
completa ma transitoria.
Gli indici di necrosi miocardica, come la creatin-chinasi
MB (CK-MB) e le troponine (T e I) mostrano valori ematici nella norma o solo lievemente alterati, a indicare
l’assenza della perdita di una massa muscolare cardiaca
significativa. In effetti un qualche rialzo di troponine nei
pazienti che clinicamente hanno un quadro di angina instabile è rilevabile in circa due terzi dei casi. Questo rialzo
è verosimilmente da attribuire a fenomeni di microembolizzazione distale del trombo coronarico, che determina
necrosi cellulare focale (infarctlet). In base a quanto detto
in precedenza, nella nuova classificazione proposta per la
diagnosi di infarto miocardico questi pazienti sono classificati come affetti da infarto senza sopraslivellamento
del tratto ST.
Nei pazienti con angina instabile è importante escludere
o individuare possibili fattori extracardiaci (per esempio, anemia, ipertiroidismo) che possono contribuire a
determinare la comparsa del quadro clinico e possono
condizionarne la gravità. È importante inoltre eseguire
un esame del sangue completo per valutare la presenza
di fattori di rischio da trattare adeguatamente (ipercolesterolemia, diabete).
Manifestazioni cliniche e diagnosi
Angina instabile L’angina instabile è caratterizzata da
una recente variazione del quadro clinico anginoso, che
può essere costituito da un aumento della frequenza e/o
durata dell’angina, dalla sua comparsa per sforzi meno
intensi (angina in crescendo) o a riposo (quando prima
essa insorgeva solo da sforzo), o anche da una minore
sensibilità alla terapia con nitrati sublinguali. Una forma
di angina instabile è anche l’angina di recente insorgenza
(angina de novo), comparsa, cioè, negli ultimi 2 mesi in
un paziente precedentemente del tutto asintomatico e caratterizzata da angina a riposo e/o da sforzi lievi. Un’altra
forma di angina instabile, infine, è l’angina postinfartuale
(che si presenta, cioè, entro poche settimane da un infarto
miocardico acuto). Un’utile classificazione dell’angina
instabile è quella proposta da Braunwald (Tab. 5.2), nella
quale essa è suddivisa in tipo I, tipo II e tipo III, caratterizzati, rispettivamente, dall’assenza di angina a riposo,
dalla presenza di angina a riposo nelle ultime 2 settimane
ma non negli ultimi 2 giorni e dalla presenza di angina a
riposo negli ultimi 2 giorni. Inoltre, l’angina è suddivisa in
tipo A, tipo B e tipo C, caratterizzati rispettivamente dalla
presenza di fattori extracardiaci che esacerbano la gravità
dell’angina, dall’assenza di fattori aggravanti extracardiaci
o dalla presenza di un infarto nelle ultime 2 settimane.
Tabella 5.2 Classificazione dell’angina instabile (AI) di Braunwald
A. Si verifica in presenza di
condizioni extra-cardiache che
facilitano l’ischemia miocardica
(AI secondaria)
B. Si verifica in assenza di
condizioni extra-cardiache che
facilitano l’ischemia miocardica
(AI primaria)
C. Si verifica nelle prime 2
settimane dopo un infarto
acuto del miocardio
(AI postinfar­tuale)
I. Angina di recente insorgenza
o angina in crescendo;
non angina a riposo
IA
IB
IC
II. Angina a riposo nell’ultimo
mese, ma non nelle ultime 48
ore (angina a riposo subacuta)
IIA
IIB
IIC
III. Angina a riposo nelle ultime
48 ore (angina a riposo acuta)
IIIA
IIIB
IIIC
131
1
132
Parte 1 - MALATTIE DEL SISTEMA CIRCOLATORIO
Infarto miocardico acuto senza sopraslivellamento del
tratto ST L’infarto miocardico, in generale, consiste nella necrosi di un’area più o meno estesa di tessuto miocardico causata da un’ischemia grave e prolungata. Nel caso
dell’infarto miocardico acuto senza sopraslivellamento
del tratto ST, la necrosi interessa abitualmente solo gli
strati subendocardici di un distretto miocardico, per cui
questo tipo di infarto è anche detto comunemente infarto
subendocardico.
Clinicamente il paziente presenta dolore toracico prolungato, superiore a 20-30 min, un tempo che indica una durata
dell’ischemia sufficiente a causare un’apprezzabile necrosi
del tessuto miocardico, preceduto o meno nelle ore o nei
giorni precedenti da episodi anginosi transitori.
L’ECG durante il dolore toracico consiste principalmente
nella comparsa di un sottoslivellamento del tratto ST
più o meno marcato e diffuso, anche se in alcuni casi è
possibile che si abbiano solo alterazioni meno specifiche
dell’onda T (negativizzazione). In accordo con il quadro
clinico/anatomopatologico, inoltre, anche le alterazioni
ECG sono prolungate e tendono a regredire lentamente (nel volgere di ore o giorni). Tipica dell’infarto senza
sopraslivellamento ST è la mancata comparsa di onde Q
di necrosi, caratteristica dell’interessamento degli strati
subepicardici nel processo necrotico, per cui questo tipo
di infarto è spesso denominato anche infarto miocardico
non-Q.
Il dosaggio dell’enzima cardiaco creatin-chinasi (CK) totale e della sua isoforma cardiaca CK-MB in questi pazienti
mostra la tipica curva di aumento-decremento.
Analogamente, le troponine T e I mostrano un rialzo apprezzabile. Il dosaggio della troponina T o della troponina
I è ormai diventato, in effetti, il test di maggior riferimento per il rilevamento di un danno cellulare miocardico,
risultando esse più sensibili della CK-MB. Come detto in
precedenza, secondo la nuova classificazione proposta, il
riscontro di un aumento anche minimo di troponina in
un paziente con dolore toracico, in quanto indicativo di
una necrosi miocellulare, per quanto microscopica, dovrebbe portare a una diagnosi di infarto miocardico acuto
senza sopraslivellamento ST, indipendentemente dalla
durata del dolore, dalla presenza o meno di alterazioni
ECG e di variazioni della CK-MB.
Il comportamento tipico della CK/CK-MB, degli altri enzimi cardiaci e delle troponine in pazienti con infarto
Figura 5.24
Stratificazione
del rischio e
conseguenti
indicazioni per
la gestione
dei pazienti
con angina
instabile/infarto
miocardico senza
sopraslivellamento
del tratto ST.
­ iocardico acuto è descritto nel paragrafo Infarto miocarm
dico acuto con sopraslivellamento del tratto ST.
Prognosi e stratificazione del rischio
I pazienti con sindrome coronarica acuta senza sopraslivellamento del tratto ST hanno un’incidenza di eventi
clinici maggiori, morte e (re)infarto miocardico, nei primi
30 giorni che varia dal 2 al 10%. Il rischio si riduce poi
progressivamente entro pochi mesi. È possibile individuare, tra questi pazienti, alcuni gruppi a maggior rischio di
eventi, che necessitano di un trattamento più aggressivo,
mentre altri gruppi presentano caratteristiche di basso
rischio (Fig. 5.24).
Data la maggiore incidenza di eventi nelle fasi precoci
della malattia, una stratificazione precoce del rischio è
fondamentale per un trattamento ottimale dei singoli
pazienti. Ovviamente pazienti con sintomi o segni di
scompenso, con aritmie ventricolari gravi e quelli che
continuano ad avere episodi anginosi nonostante terapia
medica ottimale sono ad alto rischio di eventi gravi a
breve termine. Per i pazienti che non presentano queste
caratteristiche cliniche minacciose una prima valutazione
della gravità del quadro clinico può essere fatta sulla base
delle caratteristiche del quadro anginoso che ha portato
al ricovero, utilizzando la classificazione di Braunwald (si
veda Tab. 5.2). Infatti la prognosi a breve-medio termine
peggiora progressivamente dal tipo I al tipo III e dal tipo A
al tipo C. Sono inoltre a più alto rischio di eventi cardiovascolari anche i pazienti diabetici e nefropatici. L’esame
obiettivo è importante perché la presenza di segni e sintomi di scompenso si associa a una prognosi peggiore.
Un altro fattore predittivo di un peggiore decorso clinico
a breve-medio termine è la presenza di alterazioni del
tratto ST all’ECG standard e l’aumento di alcuni marker bioumorali, in particolare delle troponine. Anche
l’aumento di marker infiammatori, come la proteina C
reattiva, è associato a un rischio maggiore di eventi. In
studi recenti, infine, anche un aumento del peptide na-
Tabella 5.3 V
ariabili per il calcolo del TIMI (Thrombolysis
In Myocardial Infarction) risk score per
la stratificazione del rischio in pazienti
con sindromi coronariche acute senza
sopraslivellamento del tratto ST
d Età ≥ 65 anni
d ≥ 3 fattori di rischio di malattia coronarica
d Significativa stenosi coronarica (≥ 50%)
d Slivellamento significativo del tratto ST
Sintomi anginosi gravi (per esempio, ≥ 2 episodi di angina
nelle ultime 24 ore)
d d Uso di acido acetilsalicilico negli ultimi 7 giorni
d Aumento dei marker sierici di danno miocardico
Ogni variabile vale 1 punto. I pazienti possono essere classificati
a basso, medio o alto rischio in base a un punteggio basso (0-2),
intermedio (3-4) o elevato (5-7).
Capitolo 5 - Cardiopatia ischemica
triuretico di tipo B (BNP) o del pro-BNP (che vengono
rilasciati dal miocardio ventricolare in caso di aumentata
tensione intracardiaca) ha mostrato avere un significato
prognostico negativo.
L’esecuzione all’ingresso di un ECG Holter di 24-48 ore
potrebbe essere utile in questi pazienti, in quanto il riscontro di episodi di ischemia miocardica e di aritmie,
spesso silenti, è un importante predittore di rischio.
Per cercare di migliorare la stratificazione del rischio dei
pazienti con sindrome coronarica acuta senza sopraslivellamento ST sono stati anche proposti alcuni indici di
rischio compositi, derivanti dalla valutazione e combinazione di vari fattori prognostici individuali. Tra i più
utilizzati vi è il TIMI (Thrombolysis In Myocardial Infarction) risk score, che risulta dalla valutazione di 7 variabili
cliniche e di laboratorio (Tab. 5.3).
Nei pazienti che non presentano predittori di rischio di
eventi coronarici a breve termine, i quali indicano un
trattamento di rivascolarizzazione miocardica durante
il ricovero, è opportuna una rivalutazione del rischio al
momento della dimissione. Come nei pazienti con angina
stabile, i fattori prognosticamente più importanti sono a
questo proposito la funzione ventricolare sinistra (valutata
come frazione di eiezione all’ecocardiogramma), la capacità di esercizio (valutata con test da sforzo) e la risposta ai
test di induzione di ischemia miocardica (sempre all’ECG
da sforzo o a stress test di immagine).
Terapia
Nel caso delle sindromi coronariche acute senza sopraslivellamento del tratto ST è necessario il ricovero
ospedaliero, in quanto esiste un rischio significativo di
evoluzione a breve termine verso complicanze gravi.
Sulla base dei meccanismi fisiopatologici responsabili del quadro clinico, la terapia di prima linea è
costituita da farmaci che inibiscono l’aggregazione
piastrinica e la coagulazione, con la finalità principale di evitare l’evoluzione del trombo subocclusivo
verso un’occlusione trombotica coronarica completa
e prolungata. Altri interventi, d’altro canto, sono finalizzati principalmente a trattare e prevenire ulteriori
episodi di ischemia miocardica.
Antiaggreganti piastrinici L’acido acetilsalicilico è
il farmaco cardine del trattamento dei pazienti con
sindrome coronarica acuta senza sopraslivellamento
del tratto ST, essendosi mostrato in grado di migliorare la prognosi. Oggi, inoltre, a questi pazienti si tende
a somministrare una doppia terapia antiaggregante
piastrinica, associando all’acido acetilsalicilico un
antiaggregante tienopiridinico come il clopidogrel.
Nei pazienti sottoposti a interventi di rivascolarizzazione coronarica per via percutanea spesso viene
aggiunto un ulteriore farmaco antiaggregante, vale a
dire un inibitore della glicoproteina IIb-IIIa, che costituisce il recettore piastrinico che lega il fibrinogeno
e, quindi, la via finale comune di tutti i meccanismi
che stimolano l’aggregazione piastrinica.
Anticoagulanti Una terapia anticoagulante è somministrata per alcuni giorni a molti di questi pazienti. Si può, a questo proposito, utilizzare l’eparina
non frazionata, che esercita l’effetto anticoagulante
inibendo l’attivazione della trombina e del fattore
Xa da parte dell’antitrombina III, o un’eparina a
basso peso molecolare, che agisce principalmente
inattivando il fattore Xa. Le eparine a basso peso
molecolare hanno il vantaggio che la loro somministrazione non necessita, al contrario dell’eparina
non frazionata, di monitoraggio laboratoristico dello
stato della coagulabilità del sangue. Altri farmaci
anticoagulanti, di introduzione più recente, sono
gli inibitori diretti del fattore Xa, che sembrano dare meno complicanze emorragiche delle eparine,
e gli inibitori diretti della trombina, che possono
sostituire gli inibitori della glicoproteina IIb-IIIa in
pazienti che vanno incontro a interventi percutanei
di rivascolarizzazione.
Terapia antischemica La somministrazione sublinguale di nitrati rimane il trattamento di scelta
dell’attacco acuto di angina e la somministrazione
e.v. di nitroglicerina può contribuire a stabilizzare il
paziente nelle prime ore, ed è consigliabile soprattutto in presenza di altre condizioni (ipertensione,
insufficienza ventricolare sinistra) che ne rendono
più utile l’impiego.
I pazienti con angina instabile, a meno di controindicazioni, dovrebbero ricevere un b-bloccante, preferibilmente b1-selettivo, anche se mancano adeguati
studi controllati che abbiano dimostrato benefici
sulla prognosi da parte di questi farmaci in questo
ambito.
In presenza di controindicazioni ai b-bloccanti si
può ricorrere all’uso di calcio-antagonisti non diidropiridinici.
Statine L’uso di statine è attualmente incoraggiato
praticamente in tutti i pazienti con una sindrome coronarica acuta. Alcuni dati, inoltre, suggeriscono che
l’uso di alte dosi di questi farmaci potrebbe migliorare
ulteriormente il decorso clinico.
Rivascolarizzazione miocardica Negli ultimi anni
vi è stata una tendenza a un approccio più aggressivo
nei pazienti con sindromi coronariche acute con l’uso
di interventi di rivascolarizzazione miocardica per
via percutanea entro, di solito, 48 ore dal ricovero.
La conclusione che si trae da un’analisi obiettiva del
complesso degli studi disponibili indica, tuttavia, che
un tale approccio è utile solo nei pazienti a più alto
rischio, ovvero:
• pazienti che continuano a presentare episodi
transitori di ischemia miocardica con o senza
(ischemia silente) angina, nonostante terapia
farmacologica ottimale;
pazienti
che presentano segni e sintomi di scom•
penso cardiaco e/o grave disfunzione ventricolare
sinistra e/o gravi aritmie;
133
1
134
Parte 1 - MALATTIE DEL SISTEMA CIRCOLATORIO
• pazienti diabetici o con angina postinfartuale;
• pazienti che presentano significative alterazioni
ECG;
• pazienti che presentano un rialzo significativo
degli indici di necrosi miocardica (in particolare
troponina).
Nei pazienti che non necessitano di rivascolarizzazione miocardica urgente, l’indicazione a un intervento
di rivascolarizzazione elettiva è basata sugli stessi
principi già illustrati per l’angina cronica stabile.
Similmente, la scelta del tipo di rivascolarizzazione
(percutanea o chirurgica) va presa sulla base del quadro clinico e angiografico come descritto per l’angina
stabile.
Terapia alla dimissione La terapia prescritta alla
dimissione ha l’obiettivo di ridurre il rischio di eventi
cardiovascolari maggiori a distanza ed è basata sugli stessi principi e sugli stessi farmaci descritti per
l’angina stabile. L’unica differenza è rappresentata
dall’opportunità di aggiungere in questo caso il clopidogrel per 6-12 mesi, soprattutto in pazienti con
quadro clinico di maggiore rischio. Questo dipende
dal fatto che il rischio di recidiva di un’instabilità
coronarica è maggiore nei primi mesi dopo l’evento
acuto, mentre decresce progressivamente e marcatamente in seguito.
Infarto miocardico acuto con
sopraslivellamento del tratto ST
Definizione
L’infarto miocardico acuto con sopraslivellamento del
tratto ST identifica il quadro clinico considerato come la
più tipica espressione dell’infarto. È causato da un’ischemia grave e prolungata che, a differenza dell’infarto senza
sopraslivellamento ST, interessa una regione del miocardio
per tutto il suo spessore, una condizione indicata comunemente anche come infarto miocardico transmurale.
Il meccanismo responsabile dell’ischemia prolungata
che porta alla necrosi miocardica è rappresentato dalla
trombosi acuta di un vaso coronarico epicardico, che,
contrariamente a quanto visto nel caso dell’infarto senza
sopraslivellamento del tratto ST, è in questo caso totalmente occlusiva e persistente.
Patogenesi
Nella maggior parte degli infarti con sopraslivellamento
del tratto ST l’esame coronarografico eseguito nelle prime
ore evidenzia un’occlusione completa dell’arteria coronaria
che porta il sangue alla regione colpita (arteria correlata
all’infarto). L’occlusione, che avviene in modo acuto, è dovuta nella stragrande maggioranza dei casi a una trombosi
che si forma a livello di una placca aterosclerotica, non
necessariamente significativa, ma andata incontro a complicanze. In pazienti con storia clinica di angina vasospa-
stica l’occlusione è verosimilmente causata da uno spasmo
prolungato di un’arteria epicardica associato a stasi ematica
che, a sua volta, innesca la formazione del trombo.
Va sottolineato che trombosi e vasocostrizione possono
coesistere e potenziarsi vicendevolmente. Infatti, le piastrine, che hanno un’importanza fondamentale nella
genesi del trombo, liberano nel sito di attivazione sostanze
(come il trombossano A2) che possiedono una potente
azione vasocostrittrice. D’altro canto, la vasocostrizione
coronarica, alterando il flusso locale, può favorire l’attivazione piastrinica.
L’esame coronarografico eseguito a distanza di ore o di
giorni dall’esordio dell’infarto mostra una prevalenza di
occlusioni trombotiche inferiore rispetto alla fase acuta, anche in presenza di stenosi aterosclerotiche più o
meno significative, indicando che la ricanalizzazione di
un’arteria coronaria per lisi spontanea del trombo è un
evento frequente. Questo fatto spiega anche la minore
incidenza di occlusioni coronariche rilevate agli esami
autoptici in pazienti deceduti dopo ore da un infarto
miocardico acuto.
I meccanismi che determinano la trombosi coronarica
sono simili a quelli descritti per le sindromi coronariche
acute senza sopraslivellamento del tratto ST. Come detto, la differenza fondamentale è che nel primo caso la
trombosi non è di solito occlusiva ed è spontaneamente
reversibile in breve tempo, mentre nel secondo caso è
persistente. Le cause di questa diversa evoluzione della
trombosi nelle due sindromi sono ancora poco chiare.
Diversi fattori condizionano l’estensione dell’infarto miocardico, che è uno degli elementi prognostici principali
di questo quadro clinico. Più è esteso l’infarto, infatti,
maggiore è la quantità di muscolo cardiaco che viene
persa e, quindi, la compromissione dell’attività contrattile
globale del cuore.
Questi fattori sono:
• la sede dell’occlusione trombotica (più l’occlusione
è prossimale, più l’infarto sarà esteso);
• la durata dell’occlusione (più prolungata
è l’occlusione, e quindi l’ischemia, più estesa sarà
la necrosi);
• lo sviluppo di circolo collaterale verso la regione
colpita dall’infarto (più il circolo collaterale
è sviluppato, minore è l’estensione della necrosi);
• la reazione neurovegetativa ed emodinamica
all’infarto stesso; durante l’infarto, infatti, sia per
il dolore sia per un’eventuale compromissione
emodinamica, si può verificare un aumento
dell’attivazione del sistema nervoso adrenergico e
delle concentrazioni di catecolamine circolanti, che
determinano aumento della frequenza cardiaca e
delle resistenze periferiche, causando un aumento
del fabbisogno miocardico di ossigeno, e facilitando
quindi l’estensione dell’area di necrosi.
• la presenza di episodi anginosi nelle ore o nei
giorni precedenti l’infarto (angina preinfartuale);
come già visto, questi episodi possono indurre un
precondizionamentto ischemico che può limitare
marcatamente l’estensione dell’infarto.
Si deve notare che in circa il 5% dei pazienti con infarto miocardico acuto la coronarografia mostra arterie
Capitolo 5 - Cardiopatia ischemica
c­ oronarie indenni da stenosi. Le cause dell’infarto in questi casi sono verosimilmente diverse e non sempre facilmente identificabili. Uno spasmo coronarico o un trombo
occlusivo andato incontro a lisi spontanea e completa
sono tra i meccanismi più probabili. In alcuni pazienti è
possibile che il quadro clinico sia in effetti dovuto a una
miocardite focale con esordio pseudoinfartuale.
Anatomia patologica
La sede di un infarto miocardico dipende dall’arteria coronaria occlusa. Così, un’occlusione dell’arteria discendente
anteriore dà luogo a un infarto anteriore e del setto, un’occlusione dell’arteria circonflessa dà luogo a una necrosi in
sede laterale ed eventualmente posteriore, mentre un’occlusione dell’arteria coronaria destra dà origine a una necrosi della parete inferiore ed eventualmente posteriore.
Tuttavia le dimensioni dell’arteria circonflessa e della
coronaria destra, come notato nella descrizione dell’anatomia coronarica, variano molto da paziente a paziente e
ciò ha ovviamente ripercussioni sulla sede ed estensione
dell’infarto causato dall’occlusione di una di queste due
arterie. Abitualmente la necrosi interessa il miocardio
ventricolare sinistro e settale; tuttavia, circa un terzo degli infarti inferiori mostra anche un coinvolgimento del
miocardio del ventricolo destro.
Generalmente, le modificazioni macroscopiche nell’area
infartuata si rendono visibili solo dopo 18-24 ore dall’occlusione trombotica, e quindi dall’inizio della sintomatologia
dolorosa. Sulla superficie di taglio il miocardio colpito appare pallido e secco e spicca sul tessuto normale circostante.
Fra il 2° e il 4° giorno la zona dell’infarto mostra un sottile
alone giallo prodotto dall’infiltrazione neutrofila. Questa
zona si estende progressivamente, talora assumendo un
colorito giallo-verdastro, verso il centro, che viene raggiunto intorno al 5°-6° giorno.
Lo spessore della parete cardiaca nell’area infartuata appare ridotto come conseguenza della necrosi del tessuto
miocardico. Successivamente l’area infartuata appare delimitata da una linea depressa rosso porpora di tessuto di
granulazione, che intorno all’8°-10° giorno si estende rapidamente a tutta l’area. Dopo 4 settimane, l’area infartuale
acquista gradualmente un aspetto gelatinoso grigiastro,
sino a trasformarsi in cicatrice dura e retratta nel corso
dei successivi 3-4 mesi. Il tempo richiesto per una completa sostituzione del tessuto necrotico e cicatrizzazione
dipende dalle dimensioni dell’infarto.
Le modificazioni morfologiche macroscopiche corrispondono a precisi quadri microscopici. Le miocellule, danneggiate in modo irreversibile, vanno incontro a necrosi
coagulativa che con le normali colorazioni è visibile non
prima che siano trascorse 12-15 ore. Prima di tale tempo
possono essere visibili, ma non sempre, un certo grado di
edema, perdita delle strie trasversali, picnosi o cariolisi. La
necrosi del muscolo e la scomparsa delle fibre si rendono
evidenti dopo 48 ore, quando alla periferia dell’infarto
comincia ad apparire un essudato ricco di neutrofili che
si estende su tutta l’area infartuata nel 4°-5° giorno e che,
con la liberazione di enzimi proteolitici, determina la
digestione del materiale necrotico.
I neutrofili vengono sostituiti da macrofagi e linfociti e
contemporaneamente, intorno al 7° giorno, alla periferia
dell’infarto compare una sottile zona di tessuto di granulazione. Entro 6-7 settimane, la zona necrotica viene
totalmente sostituita dal tessuto di granulazione che si
fa sempre meno ricco di cellule e vasi, mentre ha luogo
un’abbondante neoformazione di fibre collagene. Entro
4-6 settimane la sclerosi cicatriziale è completata.
Si deve notare che studi recenti hanno evidenziato come
una percentuale significativa di miocardiociti muore per
apoptosi nelle ore, giorni e anche settimane successive
all’infarto. Questo tipo di morte cellulare non evoca una
risposta infiammatoria e il suo significato è ancora controverso.
Sintomatologia
In più della metà dei pazienti colpiti da infarto miocardico
l’anamnesi è negativa per precedenti sintomi cardiaci:
l’infarto, cioè, è la prima manifestazione della cardiopatia ischemica. In altri casi l’anamnesi rivela una storia
di angina stabile, uno o più episodi di angina instabile,
o anche un o più infarti pregressi. In circa metà dei casi
l’infarto è preceduto da angina preinfartuale nelle ore e
giorni precedenti l’insorgenza del dolore infartuale.
Nella maggior parte dei pazienti non è identificabile alcun
fattore scatenante. La maggior parte degli infarti, infatti,
avviene durante normali attività, o anche durante il riposo. Solo in una piccola percentuale dei casi, variabile dal
2 al 13%, l’evento si verifica durante un esercizio fisico
intenso. Nell’8-23% dei casi, d’altro canto, l’infarto si
manifesta durante il riposo notturno.
Anche l’insorgenza dell’infarto miocardico acuto presenta un ritmo circadiano, caratterizzato da una maggior
frequenza nelle ore del mattino, tra le 6 e le 10, con picco massimo attorno alle 8, ma con un picco secondario
nelle ore pomeridiane. Come detto per l’ischemia, questo
andamento circadiano si può spiegare con il fatto che
proprio in questi periodi si osserva un parallelo aumento
dell’intensità di alcuni fenomeni fisiologici, come un
aumento dell’aggregabilità piastrinica e il rilascio di catecolamine plasmatiche, in grado di influenzare la funzione
vascolare ed emostatica facilitando fenomeni trombotici
e vasocostrizione.
Il sintomo fondamentale dell’infarto miocardico acuto è
ancora una volta il dolore toracico. Esso è analogo per sede
(retrosternale, con frequente irradiazione al lato ulnare
del braccio sinistro, a entrambe le braccia e/o al giugulo)
e qualità (abitualmente costrittivo-gravativo) a quello
anginoso, ma abitualmente è più intenso e, soprattutto,
ha una durata prolungata, di solito diverse ore, e comunque non meno di mezz’ora. Al dolore in diversi casi si
associano astenia intensa, sudorazione algida, nausea e,
in alcuni casi, vomito. Quando l’infarto esordisce durante
uno sforzo, il dolore, diversamente da quello anginoso,
non regredisce con il riposo.
Sebbene il dolore toracico sia il sintomo fondamentale, esso non è sempre presente: come si è osservato in
precedenza, infatti, una percentuale variabile dal 15 al
20% dei casi di infarto miocardico si presenta senza dolore. L’incidenza degli infarti asintomatici aumenta con
l’avanzare dell’età e sembra più alta nei pazienti diabetici.
Inoltre, in questi gruppi di pazienti l’infarto sembra potersi presentare più spesso con astenia marcata o dispnea
135
1
136
Parte 1 - MALATTIE DEL SISTEMA CIRCOLATORIO
improvvisa, a volte ingravescente, sino al quadro di edema
polmonare acuto.
Altre forme meno comuni di presentazione dell’infarto
possono essere una sincope, un’ipotensione non giustificata da altra causa e la comparsa di aritmie.
Pneumotorace Il dolore è a insorgenza acuta, localizzato
all’emitorace interessato e proiettato alla spalla e all’arto
superiore omolaterale; al dolore si associa dispnea. L’esame obiettivo e una radiografia del torace confermano la
diagnosi.
Diagnosi differenziale del dolore infartuale
Pleurite Abitualmente la diagnosi differenziale è in questo caso semplice per la localizzazione e le caratteristiche
del dolore, che si accentua con gli atti respiratori; anche
l’obiettività toracica è in genere tipica.
Nella diagnosi differenziale del dolore toracico dell’infarto
miocardico acuto si devono prendere in considerazione
diverse patologie.
Pericardite Il dolore in questo caso presenta in genere
alcune caratteristiche tipiche; la localizzazione spesso è retrosternale, ma il dolore si accentua con gli atti del respiro
e, classicamente, si riduce con l’assunzione della posizione
seduta, mentre si esacerba in posizione clinostatica; la
diagnosi può essere confermata dal rilievo di sfregamenti
pericardici (che tuttavia sono spesso fugaci e quindi non
sempre rilevabili) e, soprattutto, dal rilievo di tipiche
alterazioni all’ECG (si veda il Capitolo 9) e, in molti casi,
di versamento pericardico all’ecocardiogramma.
Dissecazione aortica Il dolore, in questo caso, sebbene
spesso a localizzazione retrosternale, è in genere molto
più intenso, spesso intollerabile; esso esordisce improvvisamente e ha un’intensità massima sin dall’inizio, diversamente dal dolore ischemico, che ha un andamento in
crescendo; caratteristica è la proiezione del dolore al dorso
e a volte anche posteriormente in basso (se la dissecazione
progredisce verso l’aorta toracica discendente o addominale). Un attento esame clinico, che può rilevare pressione
arteriosa elevata e polsi asimmetrici, e la discrepanza tra
gravità del dolore e alterazioni ECG di solito modeste,
suggerisce la diagnosi corretta, che può essere confermata
con l’ecocardiografia transesofagea o con l’angiografia
digitale computerizzata.
Embolia polmonare Nel caso di embolia polmonare
massiva si può manifestare un improvviso dolore retrosternale, difficilmente distinguibile da quello miocardico
ischemico; a esso, tuttavia, si associano dispnea intensa,
cianosi e stato di shock; se l’embolia non interessa un
grosso tronco polmonare, il dolore toracico è meno intenso e ha le caratteristiche del dolore pleuritico, con
significativa accentuazione con gli atti del respiro. La
diagnosi viene ottenuta con l’angiografia polmonare digitale computerizzata.
Figura 5.25
Tipica evoluzione
temporale
dell’ECG
nell’infarto
miocardico con
sopraslivellamento
del tratto ST (si
veda il testo per i
dettagli).
(Da: Camm AJ, Serruys PW, Lüscher TF. The ESC textbook of cardiovascular medicine.
London: Blackwell Publ; 2007, modificata.)
Disturbi di origine gastrointestinale, neuromuscolare
e psicologica A questo riguardo valgono le stesse considerazioni fatte a proposito della diagnosi differenziale
dell’angina, in quanto queste patologie possono simulare
anche il dolore infartuale.
Esame obiettivo
A volte l’unico dato obiettivo rilevabile è la reazione al
dolore. Questo, sebbene intenso, è spesso stabile e discretamente tollerato. In diversi casi, tuttavia, il paziente si
presenta ansioso e agitato e cambia spesso posizione alla
ricerca di una postura che allevi il dolore.
Come detto, a volte il paziente può presentarsi pallido, con sudorazione fredda, come conseguenza di una
iperincrezione catecolaminica; in altri casi presenta
nausea e vomito, mediati, invece, da una stimolazione
vagale (che è piuttosto frequente nel caso di un infarto
inferiore).
Il polso può presentare bradicardia, tachicardia o normofrequenza e può rivelare la presenza di extrasistoli.
La palpazione del precordio, nel caso di necrosi anteriore
estesa, può rilevare un impulso precordiale. All’auscultazione cardiaca si possono rilevare eventuali aritmie già
constatate alla palpazione del polso; molto frequente è
la presenza di un IV tono, mentre la comparsa di un III
tono può essere espressione di una necrosi estesa con
compromissione della funzione ventricolare sinistra. In
presenza di un malfunzionamento dei muscoli papillari
è udibile alla punta un soffio meso-telesistolico da insufficienza mitralica.
L’auscultazione del torace nei casi non complicati non
mette in evidenza alterazioni particolari, ma in caso di
scompenso cardiaco può rivelare la presenza di rantoli
alle basi polmonari. Nei casi più gravi di insufficienza
cardiaca secondaria al danno miocardico infartuale si
può sviluppare rapidamente un edema polmonare acuto
caratterizzato da dispnea intensa e rantoli su tutto l’ambito polmonare.
Nei casi di infarto molto esteso, infine, in cui la compromissione della funzione di pompa del cuore è molto
marcata (perdita di muscolo cardiaco in proporzione superiore al 40% della massa totale), il quadro clinico di
presentazione è quello dello shock.
Nei casi non complicati, il comportamento della pressione arteriosa è variabile, potendo rimanere invariata,
aumentare o ridursi rispetto ai valori abituali del paziente.
La temperatura cutanea mostra un transitorio innalzamento, abitualmente non superiore ai 38 °C, che si manifesta dopo 24-48 ore dall’inizio dei sintomi.
Capitolo 5 - Cardiopatia ischemica
137
1
Figura 5.26
Esempio di
evoluzione
nel tempo del
quadro ECG di
un infarto della
parete inferiore
del miocardio.
Diagnosi
La diagnosi di infarto miocardico acuto si basa principalmente, oltre che sui sintomi, sull’analisi dell’ECG e sulla
valutazione degli indici di necrosi miocardica nel sangue.
Elettrocardiogramma L’ECG è il primo esame, da eseguire immediatamente, in un paziente che si presenta con
un dolore toracico sospetto per infarto miocardico acuto.
I segni ECG dell’infarto in fase acuta non sono stabili.
Come visto, infatti, la necrosi miocardica è un evento
dinamico, che evolve nel tempo, e l’ECG testimonia,
con la propria evoluzione, le alterazioni fisiopatologiche
che si verificano in tempi successivi a livello miocardico.
Nell’infarto miocardico transmurale si possono distinguere abitualmente quattro stadi principali di evoluzione
(Figg. 5.25, 5.26).
• I stadio. Le alterazioni elettrocardiografiche
del I stadio sono caratteristiche delle prime
ore dall’esordio dei sintomi. Esse consistono
principalmente in un sopraslivellamento del tratto
ST, indicativo di una grave ischemia transmurale
(nell’elettrocardiografia classica definito come
onda di lesione subepicardica), con o senza la
presenza di iniziali segni di necrosi (piccola
onda Q). In questa fase il sopraslivellamento
del tratto ST può essere talmente marcato da
tendere a inglobare l’onda T. Queste alterazioni
sono rilevabili nelle derivazioni che esplorano
la parete miocardica colpita dall’infarto. Nelle
derivazioni opposte a queste ultime si può spesso
rilevare un sottoslivellamento del tratto ST (per
esempio, in sede inferiore nel caso di un infarto
anteriore, in sede anteriore in caso di infarto
inferiore) che rappresenta un’immagine elettrica
speculare del sopralivellamento registrato nelle
derivazioni sede di ischemia (Figg. 5.27, 5.28). Si
deve notare che, poiché le derivazioni standard
dell’ECG non esplorano direttamente la parete
posteriore del ventricolo sinistro, un infarto
miocardico transmurale che colpisca questa
regione si può manifestare all’ECG standard solo
con alterazioni nelle derivazioni anteriori, ossia
con un sottoslivellamento del tratto ST in V1­V3, speculare di una corrente di lesione diretta
posteriormente (si veda Fig. 5.28); in questi casi
la documentazione diretta del sopraslivellamento
del tratto ST può essere ottenuta registrando le
derivazioni posteriori (V8-V9).
• II stadio. A distanza di alcune ore dall’esordio,
sempre nelle derivazioni che esplorano l’area
infartuata, l’ECG mostra un’evoluzione
caratterizzata dalla progressiva riduzione del
sopraslivellamento del tratto ST e dalla comparsa
di onde T negative e di onde Q profonde e
larghe, tipiche della necrosi miocardica. La
durata di questo stadio è molto variabile. Queste
alterazioni ECG, infatti, possono durare da poche
ore a parecchi giorni. La persistenza per lungo
tempo del sopraslivellamento del tratto ST,
particolarmente comune negli infarti anteriori, può
essere espressione dello sviluppo di un aneurisma
del ventricolo sinistro nella sede della necrosi.
• III stadio. Questa fase è caratterizzata dalla
normalizzazione del tratto ST, che torna
all’isoelettrica, e dall’approfondimento della
negatività dell’onda T, con persistenza delle onde
Q di necrosi. In molti casi questo stadio si prolunga
nel tempo, tanto da rimanere come segno definitivo
del pregresso infarto.
• IV stadio. In alcuni casi, dopo alcune settimane
o anche più precocemente, si può assistere alla
138
Parte 1 - MALATTIE DEL SISTEMA CIRCOLATORIO
Figura 5.27
Esempio di
infarto miocardico
antero-laterale in
fase acuta.
Si osservino il sopraslivellamento del tratto ST nelle derivazioni antero-laterali (V2-V6) e la presenza di complessi QS da V2 a V4.
Figura 5.28
Esempio di
infarto miocardico
infero-posteriore
in fase acuta
caratterizzato da
sopraslivellamento
del tratto ST
nelle derivazioni
diaframmatiche
(DII, DIII e aVF).
Si osservi il sottoslivellamento del tratto ST in sede anteriore (V1-V3), che è espressione in questo caso di un’onda di lesione transmurale (sopraslivellamento del tratto ST) posteriore.
Figura 5.29
Quadro ECG
di un infarto
miocardico
pregresso sia
della parete
antero-laterale
(QS in tutte
le derivazioni
precordiali) sia
della parete
inferiore (onde Q
in DII-DIII-aVF).
Capitolo 5 - Cardiopatia ischemica
Tabella 5.4 L ocalizzazione della sede dell’infarto
miocardico acuto con sopraslivellamento del
tratto ST sulla base dell’ECG. Le localizzazioni
ECG si combinano in caso di infarto che
interessi regioni miocardiche multiple (per
esempio, antero-laterale, infero-laterale ecc.)
Sede dell’infarto
Derivazioni ECG con ↑ST
Anteriore
V1-V5
Laterale
V5-V6, D1-aVL
Inferiore
D2-D3-aVF
Posteriore
V1-V3 (sottoslivellamento ST)
progressiva riduzione delle alterazioni dell’onda
T, che può anche normalizzarsi completamente. In
questi casi l’unico segno ECG dell’avvenuto infarto
è un’onda Q patologica o un compesso ventricolare
totalmente negativo (complesso QS) (Fig. 5.29).
Anche quest’ultima, con il tempo, può ridursi di
ampiezza e durata, diventando non diagnostica,
per cui l’ECG può tornare a essere sostanzialmente
nei limiti della normalità. È stato già sottolineato
come un’onda Q sia da ritenere anormale, e quindi
indicativa di una necrosi miocardica, solo quando
presenta alcune caratteristiche, ossia una durata ≥
0,04 sec e un’ampiezza ≥ 25% dell’ampiezza dell’onda R.
Va osservato che un’onda Q isolata in D3 non è di per sé
sufficiente, in genere, a far porre la diagnosi di necrosi
inferiore, richiedendo questa la presenza di un’onda Q
patologica almeno anche in aVF.
Sulla base di quanto detto prima, ne deriva che l’ECG
non solo consente la diagnosi di infarto miocardico,
ma permette anche di individuare la sua localizzazione
e di suggerire l’entità della sua estensione (in base al
numero di derivazioni coinvolte nelle alterazioni). Una
sintesi della classificazione della sede dell’infarto in base
all’ECG è riportata nella tabella 5.4. Questa classificazione, tuttavia, non è sempre adeguata a individuare a
livello di quale arteria coronarica si sia verificata l’occlusione. In linea di massima, tuttavia, si può essere
sostanzialmente certi che, in caso di infarto anteriore
(alterazioni ECG nelle derivazioni V1-V4) o antero-laterale (alterazioni ECG nelle derivazioni V1-V6), l’arteria
coronaria interessata dall’occlusione è la discendente
anteriore, mentre in quello laterale (D1-aVL, V5-V6) è la
circonflessa sinistra. In caso di infarto inferiore, tuttavia,
l’arteria occlusa è molto più frequentemente la coronaria destra, ma può anche essere l’arteria circonflessa.
Studi più accurati hanno consentito correlazioni ancora più precise tra alterazioni ECG e sede dell’occlusione
coronarica responsabile dell’infarto. Così, nel caso di un
infarto anteriore, un sopraslivellamento del tratto ST in
V1-V4 e in aVL, con un sottoslivellamento di più di 1 mm
in aVF, indica un’occlusione prossimale dell’arteria coronaria discendente anteriore sinistra, mentre il sopraslivellamento del tratto ST in V1-V3 senza alterazioni del
tratto ST in altre derivazioni indica un’occlusione più
distale (dopo l’origine del primo ramo diagonale) di questa stessa arteria.
Per quanto riguarda gli infarti inferiori, un sopraslivellamento del tratto ST in D3 di entità maggiore che in D2, e
con sottoslivellamento del tratto ST superiore a 1 mm in
D1 e aVL, indica un’occlusione dell’arteria coronaria destra. Viceversa, un sopraslivellamento del tratto ST in D3
non superiore a quello in D2, e con tratto ST isoelettrico
o sopraslivellato in aVL, indica un’occlusione dell’arteria
circonflessa.
L’evoluzione nel tempo delle alterazioni del tratto ST
durante la fase acuta di un infarto miocardico è anche un
ottimo indice di valutazione dell’occorrenza o meno di
riperfusione dell’arteria coronaria occlusa. Infatti, quanto più rapidamente il sopraslivellamento del tratto ST
regredisce tanto più precoce e migliore è la riperfusione
del miocardio della regione infartuale. Questo comportamento è particolarmente utile per valutare il successo
dei trattamenti di riperfusione coronarica (la fibrinolisi e
l’angioplastica primaria). Una riduzione di più del 70%
del sopraslivellamento del tratto ST entro 90 min da una
terapia riperfusiva, infatti, suggerisce una riperfusione
efficace ed è associata a un decorso clinico più favorevole.
La mancata riduzione del sopraslivellamento del tratto
ST entro questo tempo suggerisce, invece, l’assenza di
riperfusione miocardica.
Indici ematici di necrosi miocardica In condizioni normali gli enzimi abitualmente contenuti nelle cellule miocardiche sono assenti o presenti solo in minima quantità
in circolo. In caso di necrosi delle cellule miocardiche
queste sostanze vengono liberate nel sangue e quindi
raggiungono valori nettamente superiori a quelli del range
di normalità.
• Creatinin-chinasi: l’enzima utilizzato come riferimento
nella diagnosi di infarto miocardico acuto è
la creatin-chinasi (CK), o meglio ancora la sua forma
cardio-specifica CK-MB. La CK totale, infatti, presenta il
limite di non essere strettamente specifica
di un’origine cardiaca, in quanto può essere rilasciata
da diversi organi, tra cui, in particolare, le cellule
muscolari scheletriche. Essa può quindi aumentare in
seguito a un danno che colpisca queste cellule, come
un’infiammazione o un trauma di un muscolo, ma
anche, più banalmente, una puntura intramuscolare o
uno sforzo muscolare intenso. La CK, inoltre, aumenta
significativamente in caso di danno cerebrale (per
esempio, per un ictus). La CK-MB, invece,
è più specifica per il miocardio. Essa è uno dei tre
isoenzimi che compongono la CK totale: la CK-MM,
che costituisce la quasi totalità della CK presente
nelle cellule muscolari scheletriche; la CK-BB, che si
ritrova quasi essenzialmente nelle cellule cerebrali;
e la CK-MB, che si riscontra prevalentemente nelle
cellule miocardiche. Un aumento della CK-MB può
quindi essere considerato, almeno per quanto riguarda
l’utilizzo clinico, sufficientemente specifico di un
danno miocardico. In effetti, anche la CK-MB non
è di esclusiva origine cardiaca; essa è infatti presente
in minime quantità anche nella prostata, nell’utero,
nel diaframma e nel piccolo intestino; tuttavia, un suo
139
1
140
Figura 5.30
Andamento
temporale delle
concentrazioni
dei principali
indici di necrosi
miocardica
nell’infarto
miocardico acuto.
Parte 1 - MALATTIE DEL SISTEMA CIRCOLATORIO
Si veda il testo per i dettagli. (Da: Camm AJ et al., 2007, op. cit., modificata).
incremento nel plasma a partenza da questi organi
si ha in genere solo nel caso di interventi chirurgici che
li coinvolgano.
Per la diagnosi di infarto è importante non solo
la rilevazione di un aumento della concentrazione
plasmatica di questi enzimi, ma anche il loro
andamento temporale, vale a dire il tempo
di comparsa dell’aumento rispetto all’esordio
dei sintomi, il tempo di raggiungimento del picco
e il tempo di ritorno ai valori basali, che può essere
valutato con il dosaggio periodico. La CK inizia
ad aumentare apprezzabilmente dopo circa 6 ore
dall’esordio dei sintomi, raggiunge il picco a 24 ore
o poco più tardi, e ritorna a valori normali entro
72 ore. L’aumento della CK-MB, d’altro canto, può
cominciare a essere rilevato anche dopo solo 4 ore
dall’esordio dei sintomi e segue lo stesso andamento
(Fig. 5.30).
Il dosaggio della CK/CK-MB non consente soltanto di
confermare la diagnosi di infarto, ma permette anche
di fare una valutazione dell’entità della necrosi.
Infatti, quanto più alta è la concentrazione massima
che la CK e, ancor più, la CK-MB raggiungono
nel plasma, tanto più estesa è la necrosi, sebbene
una valutazione più precisa della massa miocardica
interessata dalla necrosi potrebbe essere ottenuta
dall’analisi della curva concentrazioni-tempo
degli stessi enzimi. Per poter ottenere un quadro
attendibile dell’andamento temporale e del picco
delle concentrazioni, la CK-MB dovrebbe essere
misurata nel siero almeno 3-4 volte al giorno nelle
prime 48 ore, e poi almeno una volta al giorno sino
alla sua normalizzazione.
Si deve sottolineare come un più rapido rialzo della
CK/CK-MB, dovuto a una più rapida immissione in
circolo, si verifica in caso di un’efficace riperfusione
precoce dell’arteria coronaria occlusa, ottenuta con
la fibrinolisi o con l’angioplastica primaria; anche
il picco della CK/CK-MB sarà, in questo caso, più
precoce (in media attorno alla 12ª ora) e in genere
maggiore. Pertanto, come la rapidità dell’evoluzione
del sopraslivellamento del tratto ST all’ECG, anche
la precocità del picco della CK/CK-MB può essere
utilizzata in clinica come elemento indiretto
di riperfusione.
• Troponine: le troponine cardiache (T e I) sono sia
più specifiche di necrosi miocardica rispetto alla
CK-MB sia anche più sensibili, a causa della loro
lunga emivita, che le rende in grado di individuare
un danno miocardico ischemico anche dopo alcuni
giorni dall’evento acuto, quando la CK-MB si è già
normalizzata. Le troponine possono essere dosate
facilmente con anticorpi monoclonali. La sequenza
aminoacidica delle troponine T e I cardiache è infatti
diversa da quella delle molecole corrispondenti che si
trovano in altri muscoli. Questo ha permesso
lo sviluppo di anticorpi monoclonali che ne
consentono il dosaggio. Normalmente la troponine
T e la troponina I cardiache non sono presenti,
o sono presenti a concentrazioni bassissime, nel
sangue. Viceversa, esse aumentano significativamente
anche in caso di una minima necrosi cellulare
miocardica. Come la CK/CK-MB, anche le
concentrazioni plasmatiche delle troponine
cardiache mostrano un tipico andamento temporale
in relazione a un infarto miocardico acuto. Esse
cominciano ad aumentare 4-6 ore dopo l’esordio dei
sintomi e raggiungono il picco a 24 ore o poco più.
Contrariamente alla CK e alla CK-MB, tuttavia, le
troponine, come detto, possono rimanere elevate nel
sangue per diversi giorni, e anche fino a 2 settimane
dopo l’infarto (si veda Fig. 5.30); anche il loro picco
dà un’indicazione dell’estensione della necrosi
miocardica. È da ricordare che un rialzo sia della CK/
CK-MB sia delle troponine non necessariamente
indica un danno cellulare miocardico ischemico.
Anche una necrosi cellulare secondaria ad altre
patologie (per esempio, infiammatoria, traumatica,
tossica) può causare un loro aumento nel sangue,
sebbene in questi casi manchi in genere la tipica
curva temporale che si osserva nell’infarto miocardico
acuto. In particolare, è importante ricordare che
anche una cardioversione elettrica ad alta energia
per una tachiaritmia (per esempio, una fibrillazione
o una tachicardia ventricolare) può fare aumentare
la concentrazione degli enzimi e delle troponine.
Capitolo 5 - Cardiopatia ischemica
• Altri indici di necrosi miocardica: insieme alla CK,
altri due enzimi subiscono un aumento con
un classico andamento temporale nell’infarto
miocardico acuto e possono, quindi, essere di
ausilio soprattutto nei casi di diagnosi dubbia: la
glutammico-ossalacetico transaminasi (GOT) e la
lattico-deidrogenasi (LDH). Questi enzimi iniziano
ad aumentare più tardivamente della CK/CK-MB
e persistono aumentati nel siero più a lungo, in
particolare la LDH (si veda Fig. 5.30). Una sostanza
che consentirebbe una diagnosi laboratoristica
piuttosto precoce dell’infarto miocardico, infine,
è la mioglobina, una proteina costitutiva del
muscolo cardiaco, che aumenta già entro 2 ore circa
dall’esordio dei sintomi. La mioglobina, tuttavia,
è facilmente rilasciata anche dalle cellule muscolari
scheletriche, anche in seguito a minimi traumi; ciò la
rende troppo poco specifica per un danno cardiaco,
e per questo è poco utilizzata nella pratica clinica.
interventi terapeutici), facendo quindi sovrastimare nelle
fasi iniziali la reale estensione della necrosi.
Oltre che per la valutazione delle alterazioni cinetiche,
l’ecocardiogramma è particolarmente utile per la diagnosi precoce, al letto del malato, della maggior parte delle
complicanze meccaniche dell’infarto, come difetto interventricolare, malfunzionamento o rottura di un muscolo
papillare, rottura della parete libera del ventricolo sinistro
ed evoluzione aneurismatica, come discusso in seguito.
Inoltre, l’ecocardiografia consente agevolmente di diagnosticare la presenza di un versamento pericardico o l’eventuale presenza di trombi nella cavità ventricolare sinistra.
Infine, essa consente di documentare e caratterizzare le
conseguenze emodinamiche di un infarto del ventricolo
destro, rilevando un’alterata motilità delle sue pareti,
una sua eventuale dilatazione e una riduzione della sua
frazione di eiezione.
Indici aspecifici di stress e infiammazione La necrosi
miocardica e la reazione infiammatoria che ne consegue
determinano un incremento di diversi indici di flogosi,
oltre ad alcune variazioni metaboliche. Queste, tuttavia,
non sono specifiche di infarto e quindi questi esami sono
di scarsa rilevanza ai fini diagnostici.
Tra le alterazioni più frequenti in corso di infarto si ricordano la leucocitosi (che inizia poche ore dopo l’infarto,
raggiunge il suo massimo dopo 2-4 giorni e si normalizza di solito entro una settimana), l’aumento della VES
(che si verifica dopo 1-2 giorni dall’inizio dei sintomi e
raggiunge i valori massimi dopo 4-5 giorni) e l’aumento
della glicemia (precoce e transitorio, legato all’iperincrezione catecolaminica spesso associata alla situazione
acuta infartuale).
Come nelle altre sindromi coronariche, anche in questi
pazienti le variabili maggiormente predittive di eventi
cardiaci comprendono una bassa frazione di eiezione
del ventricolo sinistro, una ridotta capacità di esercizio
e la presenza di ischemia miocardica inducibile. Altre
variabili che sono state associate a una riduzione della
sopravvivenza a lungo termine sono il riscontro di aritmie
ventricolari frequenti e un alterato bilancio autonomico cardiaco indicativo di una predominanza simpatica
sull’attività vagale.
Ecocardiogramma Se l’area infartuata del miocardio
è sufficientemente estesa, l’ecocardiogramma bidimensionale mette in evidenza un’alterazione della contrattilità della regione ischemica, che apparirà ipocinetica,
acinetica o anche discinetica rispetto alle altre regioni
miocardiche. Consentendo una valutazione visiva dell’alterazione contrattile regionale, l’ecocardiogramma permette di definire meglio dell’ECG la sede e l’estensione
dell’infarto. Oltre a presentare alterazioni della cinesi,
la zona infartuale può inoltre presentare uno spessore
minore rispetto alle zone di miocardio non necrotico.
L’ecocardiogramma, infine, consente di misurare in modo
non invasivo e piuttosto preciso la frazione di eiezione
del ventricolo sinistro, che è la stima migliore della funzione ventricolare sinistra globale ed è uno dei parametri
più importanti per la definizione prognostica del quadro
clinico infartuale.
Va osservato che la definizione dell’estensione ecocardiografica di un infarto miocardico va fatta a distanza di
qualche giorno dall’episodio acuto. Infatti, durante la fase
acuta una parte dell’alterazione cinetica è in molti casi
dovuta alla presenza di “stordimento” del tessuto miocardico perinfartuale. Questa area può impiegare diverse
ore, o addirittura giorni, prima di recuperare la propria
capacità di contrazione, anche a dispetto del ripristino
di un flusso coronarico adeguato (spontaneo o mediante
Valutazione prognostica predimissione
Terapia
Un sostanziale miglioramento della prognosi immediata di un infarto miocardico acuto è stato ottenuto
negli anni Settanta del secolo scorso con l’istituzione
delle Unità di Terapia Intensiva Coronarica (UTIC).
Questi reparti consentono l’osservazione clinica
continua, il monitoraggio elettrocardiografico, il
monitoraggio emodinamico (quando indicato) e un
immediato intervento terapeutico in caso di complicanze. Il settore in cui le UTIC hanno dato i migliori
risultati in termini di riduzione della mortalità è stato
quello delle aritmie. Il monitoraggio elettrocardiografico consente infatti l’immediato riconoscimento di
aritmie gravi o potenzialmente fatali e la disponibilità immediata di strumentazione adeguata consente di effettuare la cardioversione elettrica in caso di
fibrillazione ventricolare e la stimolazione cardiaca
temporanea per via transvenosa in caso di blocchi
atrioventricolari o intraventricolari.
Le UTIC hanno permesso anche di ridurre, seppur
in misura più limitata, la mortalità per complicanze emodinamiche. Il monitoraggio clinico e quello
emodinamico consentono, infatti, il rilievo precoce
dei segni di scompenso e shock e guidano in modo
razionale gli interventi terapeutici.
Negli ultimi 25 anni circa la terapia dell’infarto acuto
ha subito ulteriori avanzamenti grazie allo sviluppo
di interventi di riperfusione coronarica.
141
1
142
Parte 1 - MALATTIE DEL SISTEMA CIRCOLATORIO
Riperfusione miocardica Negli anni Ottanta una
serie di studi sull’infarto miocardico acuto ha chiarito
che (come già discusso): (1) la necrosi miocardica è
causata dall’occlusione trombotica di un’arteria coronaria; (2) la necrosi miocardica è un evento dinamico,
per cui prima che il danno ischemico irreversibile
raggiunga le sue dimensioni definitive passano alcune ore (Fig. 5.31); (3) uno dei fattori prognostici più
importanti del paziente che sopravvive alla fase acuta
dell’infarto è l’estensione della necrosi.
Sulla base di queste acquisizioni è apparso chiaro che
la ricanalizzazione del vaso coronarico occluso in un
paziente con infarto miocardico acuto avrebbe potuto consentire il salvataggio di almeno una parte del
miocardio ischemico in via di necrosi e, quindi, il miglioramento della prognosi. Si è tuttavia anche subito
compreso che, per ottenere un risultato adeguato,
l’intervento terapeutico di rivascolarizzazione deve
essere attuato il più precocemente possibile dall’insorgenza dei sintomi. Infatti, l’efficacia terapeutica è elevatissima se la terapia riperfusiva è attuata nelle prime
2 ore dopo l’infarto, rimane comunque piuttosto alta
nelle prime 6 ore, si attenua poi progressivamente
tra 6 e 12 ore ed è praticamente nulla dopo 12 ore.
Pertanto, è fondamentale che:
• i pazienti che sospettano di avere un infarto
si rechino il più rapidamente possibile al pronto
soccorso;
• la diagnosi elettrocardiografica di infarto ­miocardico
acuto sia fatta il più rapidamente possibile;
• la terapia riperfusiva sia attuata il più rapidamente
possibile dopo la diagnosi elettrocardiografica.
Attualmente la riperfusione coronarica può essere
ottenuta con due tipi di trattamento, uno farmacologico (fibrinolisi) e uno meccanico (angioplastica
primaria).
La fibrinolisi è ottenuta con farmaci (fibrinolitici)
che agiscono inducendo, in modo diretto o indiretto, la lisi dei legami di fibrina del trombo. I farmaci più studiati e più comunemente utilizzati nella
pratica clinica sono la streptochinasi e l’attivatore
tissutale del plasminogeno (alteplase) che si somministrano per infusione e.v. Più di recente sono
stati introdotti fibrinolitici, come il tenecteplase
Figura 5.31
Evoluzione
nel tempo
di un infarto
miocardico.
Si può osservare come, in assenza di interventi, l’area di necrosi (marrone) si estende con
il tempo, coinvolgendo progressivamente le regioni inizialmente ischemiche (arancione).
Un intervento precoce consente il salvataggio dell’area ischemica.
e il reteplase, che possono essere iniettati in bolo
e, quindi, sono più pratici da utilizzare. Numerosi
studi su larga scala hanno dimostrato come l’infusione e.v. di un farmaco fibrinolitico limita l’estensione dell’area di necrosi e riduce di circa il 20%
la mortalità. Da notare che il miglioramento della
sopravvivenza aumenta fino a circa il 50% nei soggetti trattati entro la prima ora dalla comparsa dei
sintomi. Questa relazione tra tempo di intervento
ed efficacia è, nel caso della fibrinolisi, legata non
solo al fatto che prima il vaso viene ricanalizzato,
maggiore è la quota di miocardio in via di necrosi
che si riesce a salvare, ma anche al fatto che più precoce è la somministrazione maggiore è la capacità
del fibrinolitico di lisare il trombo (che nelle fasi
più precoci è meno stabile ed esteso).
La terapia fibrinolitica presenta alcuni limiti. In primo luogo, in seguito al suo effetto, il trombo si può
frammentare e dare origine a microembolizzazione
distale. In secondo luogo, esso risolve soltanto la
parte ricca di fibrina del trombo rosso, mentre la
parte ricca di piastrine del trombo bianco non viene
dissolta. Infine, la fibrinolisi genera un aumento delle
concentrazioni di trombina libera, che attiva l’aggregazione piastrinica, e ciò può causare un ulteriore
peggioramento della microcircolazione e fornire il
substrato per recidive trombotiche.
Si deve ricordare, inoltre, che la fibrinolisi è controindicata nei pazienti che hanno avuto emorragie gravi
recenti e che è gravata da un rischio di emorragia
intracranica dello 0,5-1%.
L’angioplastica primaria (quasi sempre con impianto
di stent), laddove sia possibile effettuarla in tempi
rapidi, costituisce oggi il trattamento di scelta per
la ricanalizzazione dell’arteria occlusa responsabile
dell’infarto. Rispetto alla fibrinolisi, l’angioplastica
primaria presenta alcuni indubbi vantaggi: (1) consente la ricanalizzazione nella quasi totalità dei casi
e indipendentemente dal tempo trascorso dall’esordio dell’infarto (mentre la fibrinolisi ottiene questo
risultato al massimo nel 75% dei casi e, come detto,
la probabilità di successo si riduce con il passare del
tempo); (2) consente di trattare un’eventuale stenosi
residua critica nella sede della trombosi, riducendo
il rischio di riocclusione a breve termine; (3) non è
di per sé associata a un rischio di emorragia intracranica.
L’angioplastica primaria, tuttavia, presenta alcuni
inconvenienti rispetto alla fibrinolisi:
• può essere eseguita solo in centri provvisti
di emodinamica con operatori esperti;
• richiede un’adeguata organizzazione di reperibilità
del personale medico, tecnico e infermieristico per
garantire la possibilità di intervento 24 ore su 24;
• richiede tempi più lunghi per poter essere applicata rispetto alla fibrinolisi.
Nel complesso gli studi di confronto tra angioplastica primaria e fibrinolisi hanno evidenziato una
riduzione di mortalità e reinfarto con il trattamento
Capitolo 5 - Cardiopatia ischemica
interventistico, soprattutto in pazienti clinicamente
più compromessi. Anche in questo caso, tuttavia,
vi è una chiara relazione tra tempo di intervento e
beneficio sulla sopravvivenza, per cui l’angioplastica
primaria è preferibile solo quando si prevede che
il ritardo legato alla sua esecuzione sia inferiore a
120 min. In caso contrario, e soprattutto se il paziente arriva precocemente in ospedale (entro 120 min
dall’insorgenza dei sintomi), la fibrinolisi dovrebbe
costituire, in assenza di controindicazioni, la terapia
di scelta. Infine, l’angioplastica detta “di salvataggio”
è indicata nei pazienti che non presentano evidenza
di riperfusione miocardica all’ECG dopo fibrinolisi
(risoluzione del sopraslivellamento del tratto ST <
70% dopo trattamento).
È importante osservare a questo proposito che non
sempre, purtroppo, la ricanalizzazione mediante angioplastica primaria o fibrinolisi del vaso occluso responsabile dell’infarto si tramuta in una riperfusione miocardica efficace. In un certo numero di pazienti, infatti,
si instaurano nel territorio ischemico-infartuale gravi
alterazioni del microcircolo coronarico che impediscono al sangue di raggiungere il miocardio, vanificando i
vantaggi della riapertura del ramo epicardico. Questo
fenomeno è denominato “no-reflow”. Un segno di
no-reflow dopo un’angioplastica primaria eseguita con
successo è rappresentato dalla mancata risoluzione del
dolore e/o del sopraslivellamento del tratto ST. Analogamente, questi segni possono indicare lo sviluppo
di no-reflow dopo fibrinolisi, anche se in questo caso
il mancato miglioramento clinico-elettrocardiografico
può essere dovuto più semplicemente all’inefficacia
della fibrinolisi nel ricanalizzare la coronaria occlusa. L’incidenza di no-reflow è ridotta dall’aspirazione
del trombo coronarico, mediante un sottile catetere,
prima dell’angioplastica primaria. Il trattamento del
no-reflow è ancora controverso anche se l’infusione
intracoronarica o endovenosa di adenosina sembra
dare qualche vantaggio.
Terapia antipiastrinica e anticoagulante Tutti i
pazienti con infarto miocardico acuto, a meno di
controindicazioni, devono ricevere appena possibile
una terapia antipiastrinica con acido acetilsalicilico,
il quale si è dimostrato in grado di ridurre di circa il
20% la mortalità di questi pazienti, con un effetto
additivo a quello della fibrinolisi. L’aggiunta di un
antiaggregante piastrinico tienopiridinico, il clopidogrel, consente un ulteriore miglioramento del decorso
clinico, riducendo, in particolare, le recidive di infarto
miocardico.
Inoltre, nei pazienti sottoposti ad angioplastica primaria è opportuna la somministrazione di un inibitore della glicoproteina IIb/IIIa piastrinica, che, come
detto, rappresenta la via finale comune dei meccanismi in grado di attivare l’aggregazione piastrinica.
Infine, è considerata indicata una terapia anticoagulante (principalmente con eparina non frazionata o
eparina a basso peso molecolare, ma anche, in alcuni
casi, con inibitori diretti della trombina o con ini-
bitori del fattore X attivato) sia nei pazienti trattati
con fibrinolisi o con angioplastica primaria sia nei
pazienti che arrivano al ricovero troppo tardi per
trarre beneficio dalla riperfusione miocardica.
b-bloccanti Tutti i pazienti con infarto miocardico
acuto dovrebbero ricevere un b-bloccante. Anche
questi farmaci, infatti, migliorano la prognosi, soprattutto nei pazienti a più alto rischio e anche grazie a
una riduzione della morte improvvisa.
ACE-inibitori, sartani e antagonisti dell’aldosterone Un ACE-inibitore va senz’altro somministrato nei
pazienti a più alto rischio, come quelli con infarto
anteriore, segni di scompenso o ridotta funzione
ventricolare sinistra, in quanto questi farmaci migliorano la prognosi in questi gruppi di pazienti.
Bloccando la produzione di angiotensina II, questi
farmaci determinano vasodilatazione sia arteriosa
sia venosa, ma anche inibizione della secrezione di
aldosterone, con induzione di una lieve natriuresi e
una riduzione dell’escrezione di K+; essi aumentano,
inoltre, i livelli di bradichinina e la produzione di
prostaglandine vasodilatatrici renali ed endoteliali. In pazienti che non tollerano gli ACE-inibitori
è possibile usare gli antagonisti del recettore AT1
dell’angiotensina II (sartani). Dati recenti indicano che gli antagonisti dell’aldosterone potrebbero
trovare indicazione in pazienti con insufficienza
ventricolare sinistra e in assenza di insufficienza
renale e di iperkaliemia.
Statine Anche in questo caso alcuni studi recenti
suggeriscono che le statine, soprattutto se date ad
alte dosi già nella fase acuta di un infarto miocardico,
possono contribuire a migliorare la prognosi a brevemedio termine.
Nitrati e calcio-antagonisti La somministrazione
di nitroglicerina e.v. può essere utile in pazienti con
persistenza o riacutizzazione del dolore ischemico,
segni di disfunzione ventricolare sinistra o pressione arteriosa elevata. L’effetto sul dolore infartuale è
comunque in genere trascurabile. Gli effetti collaterali più frequenti sono la cefalea, l’ipotensione (in
particolare nell’infarto inferiore) e la tachicardia. Gli
studi controllati non hanno comunque dimostrato
un beneficio dei nitrati sulla prognosi dei pazienti
infartuati.
I calcio-antagonisti non diidropiridinici possono
trovare indicazione nei pazienti che non tollerano i
b-bloccanti in assenza di una disfunzione significativa
della funzione ventricolare sinistra.
Rivascolarizzazione miocardica Nei pazienti non
sottoposti ad angioplastica primaria, l’indicazione a
un intervento di rivascolarizzazione elettiva è basata
sugli stessi principi già illustrati per l’angina cronica
stabile. Similmente, la scelta del tipo di rivascolarizzazione (percutanea o chirurgica) va presa sulla base
143
1
144
Parte 1 - MALATTIE DEL SISTEMA CIRCOLATORIO
del quadro clinico e angiografico come descritto per
l’angina stabile.
Terapia alla dimissione La prevenzione secondaria
è basata sugli stessi principi proposti per i pazienti
dimessi dopo una sindrome coronarica acuta senza sopraslivellamento del tratto ST. In questo caso è comunque indicato aggiungere sempre un b-bloccante.
Complicanze dell’infarto miocardico
Sia l’infarto miocardico acuto senza sopraslivellamento
del tratto ST sia quello con sopraslivellamento del tratto
ST possono avere numerose complicanze, anche se queste
sono nettamente più frequenti, e alcune (in particolare quelle meccaniche) si verificano esclusivamente, in
quest’ultimo. Nell’infarto senza sopraslivellamento del
tratto ST, in effetti, le complicanze in fase acuta si osservano di solito in pazienti con infarti pregressi e/o in
pazienti che presentano già una grave compromissione
della funzione ventricolare sinistra.
Le complicanze dell’infarto miocardico possono essere
suddivise in tre grandi gruppi:
• aritmiche;
• emodinamiche/meccaniche;
• ischemiche.
A queste complicanze se ne aggiungono altre non inquadrabili unitariamente.
È importante tenere presente che molte di queste complicanze possono coesistere, complicando simultaneamente
o in tempi successivi l’infarto miocardico.
Complicanze aritmiche
Nella fase acuta di un infarto miocardico possono insorgere pressoché tutti i tipi di aritmie. In questo contesto, esse
possono assumere un significato particolarmente grave
perché: (1) possono influire negativamente sulla funzione
di pompa del cuore, che è già compromessa; (2) possono
portare a un’estensione della necrosi sia causando una
riduzione della perfusione coronarica, sia inducendo un
aumento del consumo di O2; (3) alcune forme meno gravi
possono evolvere verso forme aritmiche maggiori, come
la fibrillazione ventricolare, il blocco atrioventricolare
completo e l’asistolia, causando un arresto cardiaco e, in
caso di mancato intervento o inefficacia degli interventi,
la morte del paziente.
Si riportano di seguito le principali caratteristiche e implicazioni cliniche delle più importanti aritmie nell’ambito
dell’infarto miocardico, rimandando al Capitolo 11 per
una loro trattazione dettagliata.
Aritmie ipercinetiche ventricolari • Extrasistoli ventricolari: semplici extrasistoli
ventricolari si osservano in quasi tutti i casi. Esse,
tuttavia, sono associate a un significativo aumento
del rischio di sviluppare forme tachiaritmiche gravi
(tachicardia ventricolare sostenuta, fibrillazione
ventricolare) durante la fase acuta dell’infarto
quando sono frequenti (> 5/min), polimorfe,
ripetitive (coppie, tachicardia ventricolare non
sostenuta) o precoci (fenomeno R/T).
• Tachicardia ventricolare: brevi episodi di tachicardia
ventricolare in corso di infarto miocardico acuto
quasi mai hanno conseguenze emodinamiche. Il
rischio di degenerazione in fibrillazione ventricolare,
tuttavia, è più elevato nella fase più acuta
dell’infarto. Nel caso di tachicardia ventricolare
sostenuta, soprattutto se la frequenza
è significativamente elevata (per esempio,
150-200/min o più) si può verificare una riduzione
marcata della portata cardiaca, con conseguente
ipotensione e segni di ipoperfusione cerebrale, talora
con perdita di coscienza; la perfusione coronarica,
inoltre, si riduce e l’ischemia miocardica si accentua,
causando un’ulteriore depressione della funzione
ventricolare sinistra e della portata cardiaca. Si
instaura così un circolo vizioso che può rapidamente
aggravare il quadro clinico. Una tachicardia
ventricolare sostenuta in corso di infarto miocardico
va dunque trattata in modo tempestivo (con terapia
farmacologica o cardioversione elettrica). In caso di
aritmie ventricolari frequenti e/o complesse, a rischio
di degenerare in aritmie maggiori, si può decidere di
aggiungere un farmaco antiaritmico; gli antiaritmici
da considerare in questo contesto sono l’amiodarone
e la lidocaina.
• Ritmo idioventricolare: questo tipo di aritmia è molto
frequente in pazienti con infarto miocardio acuto,
ma esso è, in genere, ben tollerato e non comporta
un aumento significativo del rischio di aritmie gravi,
per cui non necessita abitualmente di un trattamento
specifico.
• Fibrillazione ventricolare: La fibrillazione ventricolare
costituisce la principale causa di morte precoce nei
pazienti con infarto miocardico acuto. Poiché può
essere risolta efficacemente con la defibrillazione
elettrica, il ricovero immediato con monitoraggio
del ritmo cardiaco in UTIC è l’unico modo
efficace per ridurre la mortalità precoce di questi
pazienti. Esso, infatti, consente di identificare e
trattare in modo immediato questa aritmia fatale
qualora essa compaia. Dal punto di vista clinico,
la fibrillazione ventricolare nell’infarto miocardico
acuto viene suddivisa in due tipi: primitiva e
secondaria. La fibrillazione ventricolare primitiva
è quella che si verifica nelle prime 24-48 ore
dall’insorgenza dell’infarto; essa è tipicamente legata
al danno ischemico in atto e quindi può insorgere
in qualunque momento in qualunque tipo di infarto;
i pazienti, infatti, possono non avere alcun tipo
di complicanza e presentano spesso, anzi, una buona
situazione emodinamica; una volta risolta con la
defibrillazione elettrica, questo tipo di fibrillazione
ventricolare non comporta alcun tipo di rischio
e non è indicativa di un decorso clinico sfavorevole
sia durante la fase acuta dell’infarto sia a distanza.
È detta fibrillazione ventricolare secondaria,
viceversa, quella che si verifica dopo 48 ore
dall’insorgenza dell’infarto. Poiché l’ischemia acuta
dopo questo periodo è già regredita, in genere la
comparsa di una fibrillazione ventricolare in questa
Capitolo 5 - Cardiopatia ischemica
fase indica la presenza di un quadro clinico più
complicato (come la presenza di un grave deficit
emodinamico o l’instaurarsi di alterazioni nell’area
perinfartuale), che favorisce l’insorgenza dell’aritmia.
In questo caso, quindi, la fibrillazione ventricolare
ha un significato prognostico infausto, sia perché
ha un apprezzabile rischio di recidivare a distanza
sia perché è un marker di un quadro clinico più
grave. Questi pazienti, contrariamente a quelli che
hanno subito una fibrillazione ventricolare primaria,
vanno trattati con l’impianto di un defibrillatore
automatico. È di fondamentale importanza ribadire
che nell’infarto miocardico acuto la quasi totalità
delle morti preospedaliere (che costituiscono di
fatto ben il 30-40% di tutte le morti per infarto)
è dovuta a una fibrillazione ventricolare primitiva,
che insorge immediatamente o entro alcune ore
dall’esordio dei sintomi. Perciò il ricovero più
precoce possibile dei pazienti con infarto miocardico,
grazie alla possibilità di trattare in modo efficace
la fibrillazione ventricolare, consentirebbe di salvare
molti dei pazienti che attualmente muoiono fuori
dall’ospedale perché ritardano il ricorso al ricovero.
Per tali motivi è assolutamente necessario ricoverare
urgentemente ogni paziente; non solo quelli con
diagnosi certa di infarto, ma anche quelli in cui, sulla
base della clinica, il sospetto diagnostico sia fondato.
È noto che la maggiore latenza nei tempi di ricovero
di un paziente con infarto miocardio acuto è legata
al ritardo con cui il paziente si rivolge al medico,
o comunque richiede un’assistenza; la soluzione di
questo problema, dunque, si basa fondamentalmente
su una corretta educazione sanitaria che informi
la popolazione sui sintomi di allarme di un attacco
coronarico acuto.
Aritmie ipercinetiche sopraventricolari Mentre la presenza di semplici extrasistoli sopaventricolari raramente
pone problemi clinici e terapeutici di rilievo e le tachicardie
sopraventricolari nella fase acuta dell’infarto sono rare, la
comparsa di fibrillazione atriale (o anche di flutter atriale)
può comportare conseguenze significative. Essa complica il
5-10% degli infarti miocardici e la sua insorgenza è spesso
espressione di una compromissione funzionale del ventricolo sinistro, con aumento della pressione telediastolica e
conseguente dilatazione dell’atrio sinistro; probabilmente
è proprio la dilatazione o l’aumento della pressione atriale
il meccanismo più comune di innesco di questa aritmia in
questo contesto. Anche un’ischemia del tessuto atriale o la
presenza di alterazioni metaboliche ed elettrolitiche può
tuttavia contribuire all’insorgenza dell’aritmia.
Pur essendo molto meno gravi delle aritmie ventricolari maggiori, le tachiaritmie sopraventricolari richiedono una diagnosi precoce e un trattamento immediato per due ragioni:
(1) l’elevata frequenza ventricolare, che caratterizza queste
aritmie nella maggior parte dei casi, comporta un aumento
del consumo miocardico di O2, e quindi tende ad aggravare
l’ischemia e può comportare un’estensione della necrosi; (2) la
mancanza della sistole atriale nel caso della fibrillazione/flutter
atriale può comportare (particolarmente nei casi con funzione
ventricolare sinistra depressa) una riduzione significativa della
portata cardiaca e peggiorare quindi il quadro emodinamico.
L’amiodarone è il farmaco di prima scelta per risolvere
la fibrillazione o il flutter atriale nell’infarto miocardico
acuto, data la sostanziale assenza di effetti negativi sulla
funzione ventricolare sinistra, che hanno invece diversi
altri farmaci antiaritmici. Esso è indicato anche per trattare eventuali tachicardie sopraventricolari. Quando si
opta per il semplice controllo della frequenza cardiaca in
corso di flutter/fibrillazione atriale, i b-bloccanti sono in
questo contesto i farmaci di scelta, anche se il verapamil
può essere utilizzato in assenza di una significativa compromissione della funzione ventricolare sinistra in caso
di controindicazioni ai b-bloccanti.
Aritmie ipocinetiche • Bradicardia sinusale: la bradicardia sinusale complica
più frequentemente le fasi iniziali di un infarto
inferiore e può essere causata da un riflesso vagale
a partenza dai meccanocettori della parete inferiore
del ventricolo sinistro (riflesso di Bezold-Jarisch), ma
può anche essere una spia di un’ischemia del nodo
seno-atriale. Di solito la bradicardia sinusale non ha
implicazioni cliniche rilevanti, ma, in rari casi, se di
grado elevato e in infarti estesi, può comportare una
riduzione della portata cardiaca.
• Blocchi atrioventricolari: dal punto di vista clinico,
è utile distinguere i blocchi che si verificano nel
nodo atrioventricolare (AV) (blocchi soprahissiani o
nodali) dai blocchi che si manifestano per alterazioni
a livello del fascio di His o della sua suddivisione
nelle branche (blocchi hissiani o sottohissiani).
I blocchi AV nodali si verificano in genere negli
infarti inferiori e sono raramente espressione di un
interessamento diretto del tessuto di conduzione da
parte della necrosi; più spesso sono infatti dovuti a
ischemia o edema perinfartuale. Essi sono pertanto
abitualmente transitori, risolvendosi entro qualche
giorno. All’ECG i blocchi AV nodali si presentano
come blocco AV di I grado, blocco AV di II grado
tipo Mobitz 1 (o di Luciani-Wenckebach), blocco AV
di II grado avanzato o anche blocco AV di III grado
(completo). Il ritmo di scappamento ventricolare
in quest’ultimo caso è nodale, per cui la frequenza
cardiaca rimane comunque accettabile (in genere
50-60 bpm). In caso di instabilità emodinamica
la somministrazione di atropina consente di
migliorare la conduzione AV, migliorando quindi
anche il quadro emodinamico. Più raramente, a
causa del limitato effetto dell’atropina, o se si vuole
evitare l’effetto tachicardizzante di quest’ultima,
può essere indicata l’applicazione di un pacemaker
temporaneo per via transvenosa. Come detto, la
prognosi di questi blocchi è di solito favorevole.
I blocchi sottohissiani, viceversa, si verificano
in caso di infarto anteriore, e in genere di infarti
particolarmente estesi; essi, inoltre, sono quasi
sempre dovuti a un interessamento diretto del
tessuto di conduzione da parte della necrosi. Essi si
presentano in genere come blocco AV di II grado tipo
Mobitz 2, blocco AV di II grado avanzato o blocco
AV completo; il QRS di base, inoltre, è in genere
largo per la presenza di un disturbo di conduzione
intraventricolare. La loro pericolosità sta nel fatto
145
1
146
Parte 1 - MALATTIE DEL SISTEMA CIRCOLATORIO
che hanno un notevole rischio di evoluzione
verso il blocco AV completo e che, quando ciò
avviene, il ritmo di scappamento è forzatamente
di origine ventricolare, e quindi a frequenza molto
bassa (< 30 bpm), che è spesso incompatibile,
nel contesto dell’infarto acuto, con un’adeguata
gittata cardiaca. In caso di blocco AV sottohissiano
l’unico trattamento possibile è l’impianto di uno
stimolatore artificiale; l’atropina è infatti inefficace
e l’uso di amine simpaticomimetiche dà al massimo
risultati transitori. La prognosi dei BAV sottohissiani
nell’infarto acuto è sfavorevole per l’elevato rischio
di asistolia, ma, ancor più, perché essi sono spia
di una necrosi miocardica particolarmente estesa.
Poiché, come visto, la premessa per lo sviluppo
di un blocco AV sottohissiano è in molti casi la
presenza di base di un disturbo della conduzione
intraventricolare, nei casi di comparsa di nuovi
blocchi intraventricolari durante un infarto
miocardico acuto può essere indicata l’applicazione
di un pacemaker temporaneo a scopo profilattico.
Complicanze emodinamiche/meccaniche
Scompenso cardiaco e shock cardiogeno Sia lo scompenso cardiaco sia lo shock cardiogeno sono espressione
di una grave compromissione della funzione contrattile
miocardica in pazienti con infarto miocardico acuto. Esistono peraltro vari gradi di passaggio dal quadro dello
scompenso a quello dello shock, secondo che prevalga
un aumento della pressione telediastolica del ventricolo
sinistro o una riduzione della portata cardiaca. Nei casi
più gravi sono presenti entrambi i fenomeni.
Clinicamente l’aumento della pressione telediastolica del
ventricolo sinistro si manifesta con un aumento della
pressione a livello dei capillari polmonari. Quando questa
pressione supera il valore di 15 mmHg può comparire una
congestione vascolare polmonare (rilevabile alla radiografia del torace); quando supera i 20 mmHg, d’altro canto,
può verificarsi trasudazione di liquido negli alveoli, per cui
all’auscultazione toracica si apprezzano piccoli rantoli alle
basi polmonari; quando infine la pressione nei capillari
polmonari supera i 25 mmHg si può manifestare il quadro
dell’edema polmonare.
Tabella 5.5 C
lassificazione del paziente con infarto
miocardico acuto secondo Killip
Classe I
Non segni di insufficienza
cardiaca
Classe II
Insufficienza cardiaca lieve: III
tono cardiaco e/o rantoli la
cui estensione non supera il
50% dei campi polmonari
Classe III
Insufficienza cardiaca grave:
rantoli la cui estensione
supera il 50% dei campi
polmonari
Classe IV
Shock cardiogeno
La riduzione della portata cardiaca è caratterizzata clinicamente da ipotensione (PA sistolica < 90 mmHg) con segni
di ipoperfusione periferica, quali cute fredda, subcianosi,
tachicardia, confusione mentale e oliguria. Queste manifestazioni cliniche di shock conclamato non si evidenziano
abitualmente sino a che l’indice cardiaco (cioè la portata
cardiaca per m2 di superficie corporea) non scende sotto
il valore di 2,0 L/min/m2.
Una valutazione clinica dello stato funzionale dell’attività
contrattile cardiaca e della gravità della sua ­compromissione
può essere fatta all’ingresso con la classificazione clinica di
Killip, che divide i pazienti in quattro classi, che indicano
un quadro clinico progressivamente peggiore e gravato di
una mortalità progressivamente maggiore (Tab. 5.5). La
classificazione di Killip ha anche l’utile scopo di orientare
la terapia.
È possibile anche effettuare in UTIC un monitoraggio
emodinamico, introducendo da una vena del braccio
un catetere sottile e flessibile munito in punta di un palloncino gonfiabile. Questo catetere, noto come catetere
di Swan-Ganz, viene fatto procedere con relativa facilità
sino a un ramo periferico dell’arteria polmonare destra o
sinistra (si veda anche il Capitolo 12). Gonfiando il palloncino, si occlude temporaneamente il ramo periferico
dell’arteria polmonare e quindi si può rilevare la pressione
capillare polmonare che rispecchia fedelmente la pressione telediastolica del ventricolo sinistro. In alcuni casi con
lo stesso catetere è possibile misurare anche la portata
cardiaca con il metodo della termodiluizione. In questo
modo è possibile effettuare una valutazione emodinamica
sufficientemente precisa direttamente al letto del malato,
misurando sia la portata sia la pressione telediastolica del
ventricolo sinistro. Tuttavia, il monitoraggio invasivo
della pressione polmonare mediante catetere di SwanGanz è sempre meno utilizzato, in quanto un’accurata
valutazione clinica ed ecocardiografica (che consente di
avere una stima della pressione polmonare e della funzione ventricolare sinistra) dà informazioni sovrapponibili e
consente di evitare manovre invasive.
I pazienti con scompenso cardiaco grave o shock cardiogeno richiedono spesso un trattamento complesso, basato
sull’utilizzazione di diuretici, vasodilatatori e/o farmaci
inotropi positivi i cui effetti vanno valutati costantemente
mediante monitoraggio continuo dello stato emodinamico, oltre che clinico, onde aggiustare o modificare la
terapia in base alla risposta. In particolare, può essere
indicata la somministrazione di farmaci inotropi (dobutamina, dopamina) e/o vasodilatatori (in particolare,
nitroprussiato di sodio), anche se, nei casi conclamati
di compromissione della funzione ventricolare sinistra
conseguente a necrosi miocardica estesa, la terapia farmacologica riesce a ottenere successi solo parziali e la
prognosi rimane quindi molto grave.
Talvolta, in centri altamente specializzati, in caso di shock
cardiogeno si ricorre alla contropulsazione aortica. Questa
consiste nell’inserimento nell’aorta discendente di un
palloncino che si sgonfia in sistole e si gonfia in diastole,
aumentando la pressione aortica e migliorando così la
perfusione cardiaca durante questa fase. Tuttavia, questo
approccio è riservato solo a pazienti per i quali è programmato un intervento di rivascolarizzazione miocardica
nella speranza che una quota di miocardio disfunzionante
Capitolo 5 - Cardiopatia ischemica
sia vitale e recuperi dopo rivascolarizzazione (miocardio
ibernato o stordito).
La mortalità intraospedaliera dei pazienti infartuati con
compromissione della funzione contrattile cardiaca è
considerevolmente più elevata di quella dei pazienti che
non presentano evidenza di insufficienza ventricolare
sinistra.
È da sottolineare che alcuni casi di grave ipotensione che
si verificano nel corso di un infarto miocardico acuto
possono essere dovuti a ipovolemia, piuttosto che rappresentare veri stati di shock cardiogeno. La diagnosi
differenziale, dal punto di vista clinico, è fondamentale
in quando lo shock ipovolemico ha una prognosi molto
più favorevole rispetto a quella dello shock cardiogeno.
Fattori che contribuiscono al manifestarsi di uno shock
ipovolemico nell’infarto miocardico acuto sono la comparsa di vomito, sudorazione profusa e aumentato tono
vagale con vasodilatazione secondaria. Inoltre, anche
l’uso inappropriato di diuretici e di vasodilatatori può
facilitarne l’insorgenza. L’importanza di discriminare tra
i due tipi di shock è importante anche dal punto di vista
terapeutico. Nel caso di shock ipovolemico, infatti, l’infusione di liquidi può rapidamente portare alla normalità
il quadro emodinamico.
Infarto del ventricolo destro Un infarto miocardico del
ventricolo destro si verifica in circa un terzo dei pazienti
con infarto della parete inferiore. Esso, tuttavia, passa
spesso inosservato in quanto ha solitamente scarse conseguenze cliniche e non è rilevabile con l’ECG standard.
Quando l’infarto del ventricolo destro è esteso, tuttavia, il
quadro clinico può essere dominato dalla sua compromissione. Il sintomo principale in questo caso è rappresentato
dall’ipotensione e possono inoltre essere evidenti segni
di scompenso destro (congestione giugulare ed epatica).
L’ECG consente in genere di fare una diagnosi corretta,
mostrando un sopraslivellamento del tratto ST nelle derivazioni precordiali destre (V3R-V4R). L’ecocardiografia
bidimensionale consente di confermare la diagnosi visualizzando la dilatazione della camera ventricolare destra e
un’alterazione cinetica della parete ventricolare destra. In
questi casi bisogna evitare la somministrazione di nitrati
o altri vasodilatatori e di diuretici, mentre può essere utile
la somministrazione di liquidi.
Rottura del setto interventricolare Quando la necrosi
interessa il setto interventricolare è possibile che nella
sua porzione muscolare si verifichi una rottura. Il quadro
emodinamico è caratterizzato da un brusco aumento della
portata a livello del circolo polmonare per l’instaurarsi di
uno shunt sinistro-destro; la portata sistemica si riduce e
il ventricolo sinistro è sottoposto a un improvviso sovraccarico di volume. Ne consegue rapidamente un quadro
di scompenso e/o di shock. Clinicamente la diagnosi può
essere posta in base alla comparsa di un soffio olosistolico
abitualmente di intensità elevata, udibile principalmente al
mesocardio, a volte irradiato verso destra e spesso associato
a un fremito. Il secondo tono può apparire ampiamente
sdoppiato a causa del sovraccarico del ventricolo destro.
La diagnosi è di solito agevolmente confermata con l’ecocardiografia bidimensionale e color Doppler (Fig. 5.32), che
consente di rilevare lo shunt e anche la discontinuità del setto
interventricolare, oltre a dare informazioni sull’entità del
sovraccarico pressorio del ventricolo destro. Nei casi dubbi la
diagnosi può essere confermata con l’ausilio del cateterismo
cardiaco destro, che evidenzia, in particolare, la presenza di un
alto contenuto di ossigeno nel sangue in arteria polmonare.
L’evoluzione può essere rapidamente peggiorativa nell’arco
di poche ore. In questo caso l’unica possibilità terapeutica
è la correzione chirurgica urgente, che è però gravata da
un’elevata mortalità. In altri casi si riesce a ottenere la stabilizzazione del quadro emodinamico con la terapia farmacologica, e l’intervento correttivo può essere posticipato di
alcune settimane, il che consente di ridurre il rischio dell’intervento, che in questa fase risulta associato a una mortalità
più bassa rispetto a quella osservata in fase acuta.
147
1
Rottura o malfunzionamento di un muscolo papillare Quando la necrosi interessa anche uno dei muscoli
papillari, sono possibili due evenienze: (1) malfunzionamento del muscolo, con conseguente disfunzione dell’apparato valvolare mitralico e comparsa di un rigurgito
mitralico di variabile entità; (2) rottura del muscolo, con
rigurgito mitralico massivo.
Figura 5.32
Documentazione
all’ecocardio­
gramma
bidimensionale
e color Doppler
di un difetto
interventricolare
in un paziente
con infarto
miocardico acuto.
(a) Si può osservare una soluzione di continuità nella porzione basale del setto (freccia), sotto il lembo anteriore della valvola mitrale (VM). (b) Si può osservare la documentazione con
color Doppler della presenza di flusso (in rosso) attraverso il difetto, diretto dal ventricolo sinistro (VS) al ventricolo destro (VD).
148
Parte 1 - MALATTIE DEL SISTEMA CIRCOLATORIO
La prima evenienza è relativamente comune ed è diagnosticabile clinicamente per la comparsa di un soffio
meso-telesistolico alla punta; il grado di compromissione emodinamica è funzione dell’entità del rigurgito. Il
fenomeno, inoltre, può essere transitorio, perché legato
a un’ischemia, piuttosto che alla necrosi del muscolo
papillare. La seconda evenienza è per fortuna rara e si
diagnostica per la comparsa di un soffio olosistolico alla
punta, che si associa a un quadro di scompenso acuto
per l’improvviso sovraccarico di volume del ventricolo
sinistro, con secondario sovraccarico di pressione nel
circolo polmonare.
L’ecocardiografia bidimensionale e color Doppler consente di evidenziare lo sviluppo e l’entità di un’insufficienza
mitralica e, nel caso della rottura del muscolo, mostra
un parziale o totale spostamento del lembo mitralico
posteriore in atrio sinistro durante la sistole, insieme a
un massivo rigurgito mitralico. Essa consente anche di
porre la diagnosi differenziale con la perforazione del
setto interventricolare. Il cateterismo cardiaco può essere
utile per una valutazione accurata delle alterazioni emodinamiche.
L’evoluzione è quasi sempre rapidamente peggiorativa;
l’unica terapia efficace è quella chirurgica, con la sostituzione della valvola mitrale.
Rottura della parete libera del ventricolo sinistro Questa complicanza è causa di circa il 10% delle morti in
ospedale dei pazienti con sopraslivellamento del tratto
ST. È più frequente nelle persone anziane (oltre i 70 anni)
e nel sesso femminile, e compare abitualmente tra la 3ª e
la 10ª giornata dell’infarto. I segni clinici sono quelli del
tamponamento cardiaco acuto. Un caratteristico aspetto è
quello della dissociazione elettromeccanica: mentre il polso è completamente assente, l’attività elettrica del cuore è
mantenuta e all’ECG si rileva la persistenza di complessi
ventricolari. Questa complicanza è di solito rapidamente
mortale. In rari casi il rapido aumento della pressione
in pericardio e l’organizzazione di un coagulo a livello
della breccia possono determinare una stabilizzazione del
quadro clinico che può dare il tempo di intervenire chirurgicamente per riparare la rottura. Il rischio operatorio,
comunque, rimane elevato.
Aneurisma ventricolare sinistro Questa evoluzione
dell’infarto miocardico acuto si osserva sempre meno frequentemente da quando sono utilizzate efficaci terapie di
riperfusione coronarica. L’aneurisma è rappresentato da
una zona della parete ventricolare che non solo rimane
acinetica, ma diviene discinetica, cioè si estroflette durante la sistole. Le zone più frequentemente interessate
sono la punta e la parete anteriore del ventricolo sinistro.
Le conseguenze di un aneurisma ventricolare possono
essere di tre tipi: (1) la sua presenza compromette la
regolare dinamica di contrazione e riduce ulteriormente
la frazione di eiezione del ventricolo sinistro, facilitando
la comparsa di un quadro di scompenso cardiaco; (2)
in presenza di un aneurisma sono più frequenti le aritmie ventricolari minacciose (per esempio, la tachicardia
ventricolare ricorrente), in quanto l’area aneurismatica
spesso costituisce una sede per fenomeni di rientro; (3)
all’interno dell’aneurisma si formano più facilmente
trombi murali che possono dare origine a episodi embolici sistemici.
All’obiettività può rilevarsi un itto sollevante o un evidente impulso sistolico precordiale; quasi sempre è presente
un III tono. All’ECG un segno comune è la persistenza di
sopraslivellamento del tratto ST nella sede della necrosi,
anche a distanza di tempo dalla fase acuta. La radiografia
del torace può evidenziare un’alterazione del contorno del
margine ventricolare; tuttavia un aneurisma può essere
presente anche con un’ombra cardiaca assolutamente normale. L’ecocardiografia consente facilmente la conferma
della diagnosi, permettendo di valutare accuratamente
anche la localizzazione ed estensione dell’aneurisma.
Con l’ecocardiografia è anche possibile evidenziare se
sono presenti trombi adesi alla parete ventricolare nella
regione aneurismatica.
Complicanze ischemiche
Le complicanze ischemiche sono rappresentate dal reinfarto e dall’angina postinfartuale. La maggior parte dei
pazienti non lamenta dolori anginosi nell’immediato periodo postinfartuale. Tuttavia, alcuni possono presentare
dolori spontanei o per sforzi modesti al momento della
mobilizzazione. L’angina precoce postinfartuale è la forma
di angina instabile gravata del più elevato rischio di eventi
coronarici maggiori, come già notato nell’esposizione
dell’angina instabile. È più frequente dopo fibrinolisi che
dopo angioplastica primaria.
Altre complicanze
Pericardite epistenocardica Questa complicanza si
verifica abitualmente tra il 2° e il 4° giorno dall’infarto.
In circa un sesto dei pazienti con infarto miocardico
transmurale si rilevano sfregamenti pericardici; questa
percentuale, tuttavia, sottostima la reale incidenza della
pericardite, perché spesso gli sfregamenti sono fugaci e
quindi sfuggono all’esame obiettivo. Clinicamente la
pericardite si manifesta con dolore toracico, che spesso
pone problemi di diagnosi differenziale con la ripresa o
la persistenza del dolore ischemico, soprattutto se non si
rilevano sfregamenti; tuttavia, le caratteristiche del dolore pericardico (aumento con l’inspirazione, riduzione
con l’assunzione della posizione seduta) consentono in
genere la differenziazione. L’ECG può non presentare
modificazioni, oppure mostrare un’accentuazione del
sopraslivellamento ST, che tuttavia può essere più diffuso
rispetto alla precedente lesione ischemica. La presenza
di un versamento pericardico anche lieve all’ecocardiogramma consente di confermare la diagnosi. Tuttavia,
nel caso di una reazione pericarditica localizzata o semplicemente fibrinosa l’ecocardiogramma non è diagnostico. Il riconoscimento della pericardite epistenocardica è importante perché è un’indicazione a sospendere
un’eventuale terapia anticoagulante in corso a causa del
rischio di emopericardio.
Sindrome di Dressler o pericardite postinfartuale La
sindrome di Dressler si ritiene dovuta a un meccanismo
di reazione autoimmune al tessuto pericardico alterato in
seguito al coinvolgimento nel processo patologico dell’infarto. Questa forma di pericardite insorge da 1 a 6, o anche
12 settimane, dopo un infarto miocardico transmurale.
Capitolo 5 - Cardiopatia ischemica
Essa si presenta con il classico dolore della pericardite, ed
eventualmente della pleurite, insieme a febbre. All’auscultazione si possono apprezzare sfregamenti pericardici,­
che tuttavia sono, come in precedenza, spesso fugaci, per
cui possono sfuggire. L’ECG può mostrare i segni distintivi
della pericardite; in questo caso essi sono più facilmente
riconoscibili rispetto alla pericardite epistenocardica, in
quanto compaiono quando ormai i segni ECG della lesione ischemica sono regrediti. L’esame diagnostico più
importante è costituito dall’ecocardiogramma, che quasi
sempre mostra la presenza di un versamento pericardico
di variabile entità.
Tromboembolia L’infarto miocardico è una situazione
favorevole all’insorgenza di embolia polmonare e sistemica. L’embolia è più frequente negli infarti estesi, complicati da shock e scompenso.
L’embolia polmonare era un reperto più frequente in passato, quando i pazienti con infarto miocardico acuto erano
mobilizzati solo dopo diversi giorni dall’evento acuto e
non erano trattati con antiaggreganti e anticoagulanti;
l’attuale mobilizzazione precoce, oltre all’uso estensivo
di terapie antitrombotiche, ne ha praticamente azzerato
l’incidenza.
L’embolia sistemica consegue in genere alla formazione di
trombi intracavitari murali che si formano a livello di aree
aneurismatiche o anche solo acinetiche o discinetiche,
del ventricolo sinistro; essa è più frequente nell’infarto
anteriore e della punta, particolarmente in presenza di
aneurisma.
Morte improvvisa coronarica
La morte improvvisa costituisce il quadro di esordio della
cardiopatia ischemica in circa il 10-20% dei casi. La morte
improvvisa è definita come una morte che avviene in modo inatteso senza alcun apparente sintomo o, comunque,
entro un’ora dalla comparsa di sintomi. Sebbene diverse
malattie cardiache possano determinare morte improvvisa, la cardiopatia ischemica ne è la causa più frequente.
Una fibrillazione ventricolare in corso di ischemia transmurale causata da trombosi o da spasmo coronarico occlusivi è di solito l’aritmia responsabile della morte improvvisa ischemica, sebbene questa possa anche essere causata
da asistolia, soprattutto in pazienti con malattia cardiaca
avanzata.
In pazienti con pregresso infarto, soprattutto se complicato da disfunzione ventricolare sinistra, la fibrillazione
ventricolare e la morte improvvisa sono dovute più frequentemente a meccanismi indipendenti dall’occorrenza
di ischemia e più legati a fenomeni aritmici favoriti dalla
disomogeneità dei processi di depolarizzazione e ripolarizzazione in zone perinfartuali con anomalie elettrofisiologiche della cellule miocardiche (si veda il Capitolo 11).
I pazienti resuscitati da morte improvvisa che non hanno
evidenza di una causa ischemica acuta hanno sempre indicazione all’impianto di un ICD. Nei pazienti risuscitati da
morte improvvisa che presentano evidenza di una causa
ischemica acuta (infarto acuto, spasmo coronarico) la
terapia segue le indicazioni discusse nei paragrafi relativi
alle singole sindromi cliniche.
Bibliografia
Braunwald E. Control of myocardial oxygen consumption:
physiologic and clinical considerations. Am J Cardiol
1971;27:416–32.
Camici PG, Crea F. Coronary microvascular dysfunction. Coronary
microvascular dysfunction. N Engl J Med 2007;356:830–40.
Crea F, Gaspardone A. New look to an old symptom: angina
pectoris. Circulation 1997;96:3766–73.
Heidenreich PA, McDonald KM, Hastie T et al. Meta-analysis of
trials comparing beta-blockers, calcium antagonists, and nitrates
for stable angina. JAMA 1999;281:1927–36.
Jones CJH, Kuo L, Davies MJ et al. Regulation of coronary blood
flow: coordination of heterogeneous control mechanisms in
vascular microdomains. Cardiovasc Res 1995;29:585–96.
Katritsis DG, Ioannidis JP. Percutaneous coronary intervention
versus conservative therapy in nonacute coronary artery disease:
a meta-analysis. Circulation 2005;111:2906–12.
Lanza GA, Sestito A, Sgueglia GA et al. Current clinical features,
diagnostic assessment and prognostic determinants of patients
with variant angina. Int J Cardiol 2007;118:41–7.
Lanza GA. Cardiac syndrome X: a critical overview and future
perspectives. Heart 2007;93:159–66.
Libby P, Ridker PM, Maseri A. Inflammation and atherosclerosis.
Circulation 2002;105:1135–43.
Mark DB, Shaw L, Harrell FE Jr. et al. Prognostic value of a Treadmill
exercise score in outpatients with suspected coronary artery
disease. N Engl J Med 1991;325:849–53.
Maseri A, Davies G, Hackett D et al. Coronary artery spasm and
vasoconstriction. The case for a distinction. Circulation
1990;81:1983–91.
149
Maseri A. Ischemic heart disease. New York: Churchill Livingstone
Inc; 1995.
Mercado N, Wijns W, Serruys PW et al. One-year outcomes
of CABG surgery versus PCI with multiple stenting for
multisystem disease: a meta-analysis of individual patient
data from randomised clinical trials. J Thorac Cardiovasc Surg
2005;130:512–9.
Serruys PW, Morice MC, Kappetein AP et al. SYNTAX Investigators.
Percutaneous coronary intervention versus coronary-artery
bypass grafting for severe coronary artery disease. N Engl J Med
2009;360:961–72.
The Task Force for the Diagnosis and Treatment of non-STelevation acute coronary syndromes of the European Society
of Cardiology. Guidelines for the diagnosis and treatment
of non-ST-elevation acute coronary syndromes. Eur Heart J
2007;28:1598–660.
The Task Force on the Management of Stable Angina Pectoris of the
European Society of Cardiology. Guidelines on the management
of stable angina pectoris: executive summary. Eur Heart J
2006;27:1341–81.
The Task Force on the Management of ST-segment elevation acute
myocardial infarction of the European Society of Cardiology.
Management of acute myocardial infarction in patients
presenting with persistent ST-segment elevation. Eur Heart J
2008;29:2909–45.
Yusuf S, Zucker D, Peduzzi P et al. Effect of coronary artery bypass
graft surgery on survival: overview of 10-year results from
randomised trials by the Coronary Artery Bypass Graft Surgery
Trialists Collaboration. Lancet 1994;344:563–70.
1