Esercizi
•
Tra biossido di carbonio e superossido di sodio avviene la
seguente reazione:
4NaO2 + 2CO2 2Na2CO3 + 3O2
Calcolare:
I grammi di NaO2 che reagiscono con 1 l di CO2 ad 1 atm e
27°C.
I litri a STP di ossigeno e il numero delle molecole d’ossigeno
che si formano in questa reazione.
Esercizi
Sia data la reazione
3CuO(S) + 2NH3(g) 3Cu(s) +N2(g) + 3H2O(g)
11.4 g di CuO furono fatti reagire con 4 l di NH3 a STP, Calcolare:
a) Quale specie è in eccesso ed in quale quantità
b) I litri a 130°C e 1.2 atm di N2 e H2O prodotti
c) Le pressioni parziali del miscuglio gassoso alla pressione di 42
atm
Calcolate il volume di H2(g), espresso a 26°C e 751 Torr,
richiesto per reagire con 28.5 L di CO(g) misurato a 0°C e
760 Torr, nella seguente reazione:
CO(g) + H2(g) C3H8(g) + H2O(l)
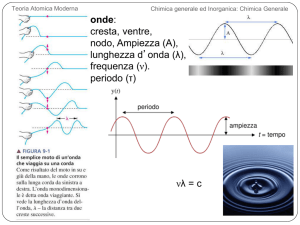
Teoria Atomica Moderna
Chimica generale ed Inorganica: Chimica Generale
onde:
cresta, ventre,
FIGURA 9-1 Il semplice moto di un’onda che viaggia su una corda
nodo, Ampiezza (A),
lunghezza d’onda (λ),
frequenza (ν).
periodo (τ)
νλ = c
Teoria Atomica Moderna
Chimica generale ed Inorganica: Chimica Generale
luce e radiazioni elettromagnetiche
νλ = c
Teoria Atomica Moderna
Ångstrom
Chimica generale ed Inorganica: Chimica Generale
Spettro elettromagnetico
Teoria Atomica Moderna
Chimica generale ed Inorganica: Chimica Generale
Teoria Atomica Moderna
Chimica generale ed Inorganica: Chimica Generale
Interferenza:
è dovuta alla sovrapposizione, in un punto dello spazio, di due
FIGURA può
9-4 Esempi
di interferenza
o più onde,
essere
costruttiva o distruttiva: onde in fase
o fuori fase
Diffrazione:
è un fenomeno legato
all’interazione di un’onda
con un ostacolo di dimensioni
comparabili alla sua λ
Reticolo di diffrazione
Teoria Atomica Moderna
Chimica generale ed Inorganica: Chimica Generale
Rifrazione:
è la deviazione che si manifesta nel
FIGURA 9-6 Rifrazione della luce
cammino di un’onda al passaggio da un
mezzo fisico ad un altro nel quale cambia la
sua velocità di propagazione
Dispersione (ottica):
è un fenomeno legato alla separazione delle componenti spettrali di
un’onda che si propagano con diversa velocità in un dato mezzo
Teoria Atomica Moderna
Chimica generale ed Inorganica: Chimica Generale
sorgenti di emissione di luce
E = hν
νλ = c
E = mc2
Assorbimento di luce
analita
Lo Spettrofotometro sfrutta
questo fenomeno
Teoria Atomica Moderna
Chimica generale ed Inorganica: Chimica Generale
FIGURA 9-9 Spettro atomico, o a righe, dell’elio
Spettri Atomici:
emissione, assorbimento
Teoria Atomica Moderna
Chimica generale ed Inorganica: Chimica Generale
FIGURA 9-10 La serie di Balmer per gli atomi di idrogeno - spettro a righe
serie di Balmer
equazione di Rydberg
νλ = c
costante di Rydberg
æ 1 1ö
- ÷;
è 22 n2 ø
n>2
s-1
æ 1 1ö
= 1,097 ´107 ç 2 - 2 ÷;
è2 n ø
l
n>2
m-1
n = 3,2881´1015 ç
1
RH = 1,097x107 m-1
Teoria Atomica Moderna
Chimica generale ed Inorganica: Chimica Generale
Modello di Bohr
FIGURA 9-13 Modello di Bohr dell’atomo di idrogeno
serie di
Balmer, Paschen, Bracket,
Pfund
E = hν νλ = c → E = hc/λ ↔ RY = hcRH
Teoria Atomica Moderna
Chimica generale ed Inorganica: Chimica Generale
modello di Bohr
Z
Teoria Atomica Moderna
Chimica generale ed Inorganica: Chimica Generale
FIGURA 9-15 Spettroscopia di emissione e di assorbimento
Spettroscopia:
di assorbimento
di emissione
Teoria Atomica Moderna
correzioni al modello di Bohr
modello di Bohr-Sommerfeld
Chimica generale ed Inorganica: Chimica Generale
Teoria Atomica Moderna
Chimica generale ed Inorganica: Chimica Generale
Teoria Atomica Moderna
Chimica generale ed Inorganica: Chimica Generale
Onde Stazionarie
y=y0[sen(kx+ωt)+sen(kx–ωt)]
y=2y0[sen(kx)cos(ωt)]
lunghezza d’onda quantizzata
1,2,…
n=
onde stazionarie bidimensionali e tridimensionali
Teoria Atomica Moderna
Chimica generale ed Inorganica: Chimica Generale
Diffrazione di raggi-X e di fasci di elettroni
esperimento di Davisson-Germer su cristallo di Ni e fogli di metallo
verifica sperimentale dell’ipotesi di De Broglie
G.P. Thomson - Nobel 1937 l’elettrone ha natura ondulatoria
esperimenti su fogli di Sn
J.J. Thomson - Nobel 1906 l’elettrone ha natura corpuscolare
Teoria Atomica Moderna
Chimica generale ed Inorganica: Chimica Generale
oggetti macroscopici e microscopici
ℏ = 1,054571628(53)×10-34
Teoria Atomica Moderna
Chimica generale ed Inorganica: Chimica Generale
principio d’indeterminazione
Teoria Atomica Moderna
Chimica generale ed Inorganica: Chimica Generale
Meccanica Ondulatoria – Schrödinger
equazione agli autovalori
autovalori e autofunzioni
Meccanica Matriciale: Born – Heisenberg – Jordan, Dirac
Teoria Atomica Moderna
Chimica generale ed Inorganica: Chimica Generale
Equazione di Schrödinger - approccio postulativo
i)
ii)
iii)
iv)
FIGURA 9-18 L’elettrone come onda materiale
esiste una funzione delle coordinate delle particelle in un
sistema - Ψ(x1,y1,z1, …., xn,yn,zn,t)- che descrive lo stato del
sistema nella sua evoluzione temporale. La funzione
contiene tutta l’informazione relativa al sistema;
si può sempre trovare un’equazione che descriva l’evoluzione
temporale del sistema;
gli osservabili sperimentali possono essere calcolati
attraverso l’opportuna definizione di operatori quantomeccanici;
la funzione |Ψ|2 rappresenta una densità di probabilità - per
esempio riferendoci ad un sistema uni-particellare la
probabilità di trovare la particella in una data regione di
spazio in un dato tempo.
Teoria Atomica Moderna
Chimica generale ed Inorganica: Chimica Generale
Equazione di Schrödinger - note sui precedenti punti
i)
ii)
FIGURA 9-18 L’elettrone come onda materiale
le Ψ(r,t) devono essere a singolo valore, con la loro derivata
prima devono essere continue, devono tendere a 0 per r
tendente ad ∞, devono essere normalizzate - ∫ Ψa*Ψadr=1 - e
ortogonali - ∫Ψa*Ψbdr=0 - quadraticamente integrabili.
l’equazione dell’evoluzione temporale - riferendoci
dell’energia di un sistema uni-particellare in uno spazio monodimensionale - è:
iii)
Energia del sistema:
iv)
con le premesse del punto ii) la probabilità di trovare la
particella nella regione di spazio x, x+dx al tempo t è:
Teoria Atomica Moderna
Chimica generale ed Inorganica: Chimica Generale
Teoria Atomica Moderna
Chimica generale ed Inorganica: Chimica Generale
n 1,2, ... ∞
l 0,1, ... n-1
ml -l, -l+1, ... 0, ...+l
Teoria Atomica Moderna
Chimica generale ed Inorganica: Chimica Generale
FIGURA 9-22 Livelli e sottolivelli di un atomo di idrogeno
orbitali idrogenoidi
Teoria Atomica Moderna
Chimica generale ed Inorganica: Chimica Generale
n 1,2, ... ∞
l 0,1, ... n-1
ml -l, -l+1, ... 0, ...+l
Teoria Atomica Moderna
Chimica generale ed Inorganica: Chimica Generale
rappresentazione radiale
Teoria Atomica Moderna
Chimica generale ed Inorganica: Chimica Generale
rappresentazione angolare
Teoria Atomica Moderna
Chimica generale ed Inorganica: Chimica Generale
isoipse
FIGURA 9-24 Due rappresentazioni della funzione angolare dell’orbitale p
Teoria Atomica Moderna
Chimica generale ed Inorganica: Chimica Generale
isoipse
FIGURA 9-24 Due rappresentazioni della funzione angolare dell’orbitale p
Teoria Atomica Moderna
Chimica generale ed Inorganica: Chimica Generale
isoipse
FIGURA 9-24 Due rappresentazioni della funzione angolare dell’orbitale p
Teoria Atomica Moderna
Chimica generale ed Inorganica: Chimica Generale
isoipse
FIGURA 9-24 Due rappresentazioni della funzione angolare dell’orbitale p
Teoria Atomica Moderna
Chimica generale ed Inorganica: Chimica Generale
isoipse
ψ=±
.01
ψ=±
.01
Teoria Atomica Moderna
Chimica generale ed Inorganica: Chimica Generale
isoipseFIGURA 9-24 Due rappresentazioni della funzione angolare dell’orbitale p
Teoria Atomica Moderna
FIGURA 9-26 I tre orbitali 2p
Chimica generale ed Inorganica: Chimica Generale
Teoria Atomica Moderna
FIGURA 9-27 Sezioni dei cinque orbitali d
Chimica generale ed Inorganica: Chimica Generale
Teoria Atomica Moderna
Chimica generale ed Inorganica: Chimica Generale
FIGURA 9-22 Livelli e sottolivelli di un atomo di idrogeno
nodi angolari e radiali
nodi angolari
nodi radiali
l
s, l = 0; p, l = 1; d, l = 2; f, l = 3
n − l − 1 1s, 0; 2p, 0; 2s, 1; 3s, 2; 4f, 0
nodi totali n − 1
n = 1, 0; n = 2, 1; n = 3, 2
n = 4, 3
4s, 3; 4p, 3; 4d, 3; 4f, 3
Teoria Atomica Moderna
probabilità di trovare l’elettrone
e
densità di probabilità
e
densità di carica
ψ2dv e ψ2
Chimica generale ed Inorganica: Chimica Generale
Teoria Atomica Moderna
Chimica generale ed Inorganica: Chimica Generale
FIGURA 9-25 Tre rappresentazioni della probabilità di trovare l’elettrone e della densità di carica per un orbitale
2p
Teoria Atomica Moderna
Chimica generale ed Inorganica: Chimica Generale
distribuzione radiale di probabilità
4π r2R2(r)
Teoria Atomica Moderna
FIGURA 9-29 Lo spin elettronico visualizzato
esperimento di Stern-Gerlach
spin dell’elettrone
Chimica generale ed Inorganica: Chimica Generale
Teoria Atomica Moderna
Chimica generale ed Inorganica: Chimica Generale
equazione di Schrödinger e livelli di energia
E
:: :: :: :: :
:: :: :: :: :
Teoria Atomica Moderna
un inciso sui numeri quantici
Chimica generale ed Inorganica: Chimica Generale
Teoria Atomica Moderna
livelli di energia: dettagli
E
:: :: :: :: :
:: :: :: :: :
Chimica generale ed Inorganica: Chimica Generale
Teoria Atomica Moderna
Chimica generale ed Inorganica: Chimica Generale
atomo idrogenoide e metodo auf-bau
FIGURA 9-33 Diagramma dell’energia degli orbitali dei primi tre gusci elettronici
principio di esclusione di Pauli
regola della massima
molteplicità di Hund
Teoria Atomica Moderna
Chimica generale ed Inorganica: Chimica Generale
Teoria Atomica Moderna
Chimica generale ed Inorganica: Chimica Generale
Teoria Atomica Moderna
Chimica generale ed Inorganica: Chimica Generale