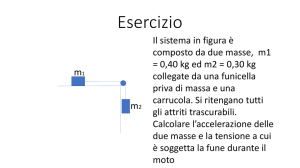
La massa del nucleo
Z protoni + N neutroni → A nucleoni
Equivalenza massa – energia
→ Massa A = somma masse P + N – energia di legame
EB in atomo H è 13.6 eV (≈ 10-8 energia a riposo totale dell’atomo)
EB in deuterio d è 2.2 MeV (≈10-3 energia a riposo totale del nucleo)
Lo studio sistematico delle masse nucleari fornisce importanti informazioni
sulla struttura nucleare e sulle forze nucleari.
1
Le masse atomiche
1u = 1.66043 * 10 -27 kg
1u → 931.480 MeV
12C → 12.000 u
Particella
massa
( Kg )
massa
(u)
Energia equivalente
( MeV )
e
0.000911.10-27
p
1.67252*10-27
1.007277
938.258
n
1.67482*10-27
1.008665
939.551
2p+2n→α
0.000548
0.512
6.69468*10-27 Kg
4.031884 u
3755.618 MeV
misuro:
α
Differenza
6.644221*10-27 Kg
0.050459*10-27 Kg
4.001506 u
0.030378 u
3727.323 MeV
28.295 MeV
2
Le masse atomiche
Particella
massa
( Kg )
massa
(u)
Energia equivalente
( MeV )
e
0.000911.10-27
0.000548
0.512
p
1.67252*10-27
1.007277
938.258
n
1.67482*10-27
1.008665
939.551
α
6.644221*10-27
4.001506
3727.323
Energia di legame di un nucleo AX =
Energia di legame di α =
Energia di legame di d =
{ Zm
[
A
+
Nm
−
m
(
X ) − Zme
p
n
1876.516 + 1879.102 − [3727.323]
938.258 + 939.551 − [1875.612]
] }c
2
} c 2 = 28.295MeV
} c 2 = 2.197 MeV
3
Le masse atomiche
∆M A = M A − ZM H − NM n
1u → 931.480 MeV
4
La massa del nucleo
energia di legame → stabilità o instabilità del nucleo.
Stabilità e altre proprietà fondamentali sono indicate nella Carta dei Nuclidi
P
Nuclei instabili
Nuclei stabili
Z
N
N
5
La massa dei nuclei
Isotopi (=Z)
Isobari (=A)
Isotoni (=N)
6
La massa dei nuclei
A
P
A
P
X N → PA−−24 X N − 2 + 24He2
A
P
X N → P +A1 X N −1 + e − + υ
A
P
XN →
A− y
P −z
X N −w + X w
y
z
A
P
A
P
X N → P −A1 X N +1 + e + + υ
XN →
XN →
A −1
P −1
A −1
P
XN + p
X N −1 + n
7
La massa dei nuclei
8
La massa dei nuclei
Massa
atomica
standard
Modo di
decadimento
Vita media
9
La massa dei nuclei
Presenza di isomeri, vita media
dell’isomero e suo decadimento
Abbondanza relativa dell’isotopo
10
Le masse atomiche
Formula semi empirica delle masse:
2
Z
(
Z
−
1
)
(
N
−
Z
)
M = Nmn + Zmz − av A + as A2 / 3 + ac
+ aa
+ ∆( A)
1/ 3
A
A
Volume
Superficie
Coulombiano
Simmetria
Pairing
B = Nmn + Zmz − M
11
masse e stabilità
E B = aZ 2 + bZ ± d / A3 / 4
A costante
Minimo per Z =
2A
4 + ( ac / a a ) A 2 / 3
Z
Z
12
masse e stabilità
Nuclei stabili con N è P pari: più numerosi
In alcuni casi non esistono
isotopi stabili: Tc, Pm
Number of Stable Isotopes
157
52
50
5
Num. P
Even
Even
Odd
Odd
Num. N
Even
Odd
Even
Odd
13
Le masse atomiche
14
masse e stabilità
Esempio: Promezio (Z=61)
Per Z=61 la curva di stabilità presenta un minimo vicino a
A=146.
Il nucleo 146Pm è dispari-dispari, decade agli isobari adiacenti.
146Pm
Gli isotopi adiacenti, 145Pm e 147Pm, sono dispari: esiste un
solo nucleo stabile per ogni A. Per A=145 il nucleo stabile è
146Sm
146Nd
Z
60
61
145Nd,
per A=147 invece è 147Sm
62
Esiste anche un altro caso:
Tecnezio (Z=43)
15
Le masse atomiche
Per A>16, EB/A è quasi costante
4He
→ saturazione della forza nucleare
Per nuclei leggeri ci sono dei picchi per
4He, 8Be, 12C, 16O, 20Ne, 24Mg
8Be
Mp= 1.007825 u
Mn= 1.008665 u
M(8Be)= 8.0053051 u
M(4n+4p)= 8.0659598 u
instabile: eccezione?
EB/A (MeV)
0
4n+4p
∆M = 0.060654 u = 56.49MeV
EB/A= 7.061 MeV
positivo: stato legato!
M(4He)= 4.002603
6
∆M= 0.030376 u = 28.29 MeV
Per 2 α =56.59 MeV
EB/A= 7.074 MeV
3
la configurazione con 2 α è
energeticamente favorita: il 8Be
decade in 2 α
8Be
2α
16
Nuclei speculari
N=Z
Nuclei speculari
A=dispari
Z=
A 1
2
N=
A ±1
2
17
Nuclei speculari
Esempio:
Z=6
6
π
N=7
6
ν
13C
Z=7
6
π
N=6
Formula semi empirica delle masse:
M = Nmn + Zmz − av A + as A
6
ν
2/3
Z ( Z − 1)
( N − Z )2
+ ac
+ aa
+ ∆( A)
1/ 3
A
A
B = Nmn + Zmz − M
13N
Energia elettrostatica per Z protoni in una sfera di raggio R:
Z2
3 Z ( Z − 1)e 2
Ec =
;
≈k
R
5 4πε 0 R
k ≈ 0.86 MeV fm
k
R0
Parametro:
ac =
Differenza tra EB:
∆E c ∝ A−1/ 3 Z 2 − ( Z − 1) 2 = A−1/ 3 (2 Z − 1) ≅ A−1/ 3 A ⇒ A2 / 3
[
]
18
Nuclei speculari
Z
BE/A (keV)
BE (ke)
∆BE (MeV)
3H
1
2827.266
8481.798
0.763755
3He
2
2572.681
7718.043
7Li
3
5606.29
39244.03
7Be
4
5371.4
37599.8
13C
6
7469.849
97108.037
13N
7
7238.863
94105.219
19F
9
7779.015
147801.285
19Ne
10
7567.375
143780.125
37Ar
18
8527.139
315504.143
37K
19
8339.847
308574.339
1.64423
∆Ec
8.00
(MeV)
∆E B ≅ ac A
R0 ≈ 0.86
2/3
6.00
slope≈0.704
3.002818
4.00
4.02116
6.929804
2.00
0.00
0
4
A2/3
8
12
k 2/3
A2 / 3
⇒ ∆E B ≅
A ⇒ R0 = k
∆E B
R0
1
= 1.22 fm
0.704
In accordo con altre misure
19
La misura delle masse
La spettrometria di massa risale a poco prima del 1920. Nel 1919, Francis Aston
mise a punto uno spettrografo di massa con cui dimostrò che le masse
atomiche possono essere espresse, in prima approssimazione, da numeri interi.
Gli spettroscopi di massa sfruttano la dipendenza dalla massa della forza
magnetica. Vengono detti spettrografi se gli ioni vengono raccolti su lastra
fotografica, spettrometri se raccolti da un rivelatore.
Una particella carica di massa m che si muove con velocità v in un campo
magnetico uniforme perpendicolare alla direzione del moto subisce una forza
F = qvB
v
La particella segue una traiettoria circolare di raggio
mv 2 mv
r=
=
qvB qB
+
F
r
20
La misura delle masse
Le particelle cariche vengono
accelerate da un potenziale
elettrico V, fino a raggiungere la
velocità v.
Per la conservazione dell’energia:
∆K + ∆U = 0
1 2
mv − qV = 0
2
v=
2qV
m
Le particelle accelerate entrano in un campo magnetico B perpendicolare al loro
moto, e compiono una traiettoria circolare di raggio:
r=
mv
qB
1 2mV
r=
B
q
All’uscita dal campo magnetico vengono rivelate da un sistema di rivelazione
sensibile alla posizione della particella
21
La misura delle masse
Esempio: il campo magnetico è B = 0.05 T;
Le particelle vengono accelerate da un
potenziale V = 1000V ;
q = 1.602*10-19C;
Misuro la posizione sulla lastra:
x = r =0.473 m
A quale massa corrisponde?
1 2 MV
r=
B
q
r 2 B 2q
M=
2V
r 2 B 2 q (0.473) 2 * (0.05) 2 *1.602 *10 −19
M=
=
= 44.801 ∗10 − 25.... ?
2V
2 *1000
2
1
r 2 B 2q
m2 *T 2 * C
2 ( Ns )
⇒
=m
=
M=
C
2
2V
(Cm)
( Nm / C )
V
Ns 2 Kg ⋅ m ⋅ s 2
26
=
=
=
Kg
=
6
.
024
⋅
10
u
2
m
s m
−25
M = 44.801*10
kg = 26.982u
22
La misura delle masse
Per misurare le masse con una precisione dell’ordine di 10-6 bisogna usare
strumenti sofisticati, per ridurre l’errore il più possibile.
Un sorgente di ioni produce un fascio di atomi ionizzati, ad esempio, mediante
bombardamento di elettroni dell’elemento in forma di vapore, o inducendo una
scarica tra elettrodi rivestiti dal materiale sotto studio.
Gli ioni prodotti dalla sorgente hanno una distribuzione ampia di velocità e
possono includere elementi di massa diversa.
Una selezione degli ioni da misurare può essere fatta mediante l’applicazione di un
campo elettrico uniforme:
+
+
+
+
+
y∝
-
-
-
-
-
qE
mv 2
23
La misura delle masse
+
+
+
+
+
E
Consideriamo una particella carica di massa m e velocità
y
m,v,q
-
-
-
-
v=vx che attraversa un campo elettrico uniforme verticale.
-
L
Accelerazione della particella dovuta al campo elettrico:
F = qE
⇒
ay =
F qE
=
m m
Se la forza viene esercitata per una lunghezza L, il tempo di attraversamento del campo è:
t = L / vx
Quando esce dal campo la posizione in y della particella è:
1
y = a yt 2
2
qEL2
y=
2mv 2
L’angolo di deflessione in prima approssimazione è:
ϕ=
qEL
2mv 2
24
La misura delle masse
Gli ioni selezionati mediante un diaframma vengono poi deflessi da un campo
magnetico.
Deflettore
elettrostatico
Sorgente
collimatori
fenditura
Deflettore
magnetico
25
La misura delle masse
Una particella di carica q, massa m e velocità v=vx in un campo magnetico uniforme è
sottoposta a una forza F:
F = qvB
e percorre una traiettoria circolare:
v2
F =m
r
mv 2
mv 2
⇒ qvB =
⇒r=
r
qvB
Se L è l’arco di circonferenza percorso dalla
particella, l’angolo di deflessione è:
φ=
L
qBL
=
r
mv
26
La misura delle masse
E’ possibile migliorare la risoluzione facendo in
modo che masse uguali con velocità diverse arrivino
nello stesso punto del rivelatore:
φm
B
Le
A
In A:
forza centrifuga = forza
elettrostatica
mv 2
re
= qE
Deflessione angolare:
φe =
Le
re
qELe
=
2mv 2
φe
re
In B: forza centrifuga = forza
magnetica
mv 2
rm
= qvB
Deflessione angolare:
φm =
Lm
rm
qBLm
=
mv
Deriviamo rispetto alla velocità e alla massa:
27
φe =
dφe
dv
dφe
dm
qELe
mv 2
2qELe
=−
mv 3
qELe
=− 2 2
m v
Le
re
=
qBLm
φm =
=
mv
dφm
qBLm
=−
dv
mv 2
dφm
qBLm
=− 2
dm
m v
Lm
rm
1 dφe
2
mv 2 2qELe
=−
= −
3
φe dv
qELe mv
v
1 dφe
1
mv 2 qELe
=−
= −
2 2
φe dm
qELe m v
m
1 dφ m
1
mv qBLm
=−
=
−
φm dv
qBLm mv 2
v
1 dφ m
1
mv qBLm
=−
= −
2
φm dm
qBLm m v
m
1 dφe
2 dφm
=
φe dv φm dv
1 dφe
1 dφm
=
φe dm φm dm
28
La misura delle masse
1 dφe
2 dφm
=
φe dv φm dv
1 dφe
1 dφm
=
φe dm φm dm
φm
B
Le
A
φe
re
dφe dφm
+
= 0 ), ma c’è
Quando φm = −2φe non c’è dispersione in velocità (
dv
dv
dispersione in massa. Gli ioni con diversa velocità emergono da B con
traiettorie parallele.
Se
φm>
2φe le traiettorie convergono.
Nell’esempio in figura: φe = 31 51’ e φm = 90 .
29
La misura delle masse
Una precisione ancora migliore si ottiene mediante una doppia focalizzazione: gli
ioni sono focalizzati in energia in S3, vengono poi focalizzati in momento in S4 . La
dimensione dei deflettori e la posizione dei diaframmi sono scelti in modo che la
dispersione totale in velocità sia nulla e la dispersione totale in m sia diversa da
zero.
In questo modo si possono misurare masse con una precisione dell’ordine di 10-5
30
La misura delle masse
In genere si misurano differenze di massa per ottenere una precisione migliore.
Il riferimento è l’atomo di 12C (u=12.000000).
Ad esempio, per misurare la massa del 160Gd la si confronta con la massa
della molecola C12H16. Entrambe le particelle raggiungono il piano focale e la
differenza di massa corrispondente alla differenza di posizione può essere
misurata.
C12H16 –Gd160 = 198.05
0.09 mu (1 mu = 10-3 u)
Dobbiamo conoscere anche la massa dell’H.
L’idrogeno, insieme all’ossigeno, e altri atomi sono considerati “standard”, cioè
masse di riferimento.
31
La misura delle masse
La massa dell’H può essere ricavata dai seguenti cicli di misure:
a = CH4 - O = 36381.5
0.9 µu (1 µu = 10-6 u)
b = C4 – SO = 33016.4
1.3 µu
c = O2 – S = 17754.3
0.9 µu
12H – C = 3a + c – b
H = 1 + (1/12 ) (3a + c – b) = 1.0078235 u
con incertezza:
1
(3∆a ) 2 + (∆b) 2 + ( ∆c) 2 ≅ 0.3µu
12
32
La misura delle masse
Tornando al Gd160, avevo misurato la differenza:
C12H16 –Gd160 = 198.05
0.09 mu (1 mu = 10-3 u)
m(Gd160) = 144 + 16 x 1.0078235 – 0.19805 = 159.92713 u
0.00009
La precisione è ∆m/m ~ 5x10-7
Abbiamo trascurato l’energia di legame molecolare, che è dell’ordine di
10-9 u.
Inoltre non abbiamo tenuto conto del fatto che il carbonio contiene circa
l’1.11% di 13C, che potrebbe sostituire un atomo di 12C più un H a
formare una molecola di massa molto vicina.
33
La misura delle masse
Sorgente di ioni
Campo
magnetico B
Mass Synchrometer
Gli ioni prodotti e accelerati passano attraverso
S1, ed entrano in un campo magnetico uniforme
B. Gli ioni con momento mv=qBρ passano
attraverso S2, S3, S4. In S3 ricevono un impulso
da un campo di radiofrequenza che modifica il
raggio di curvatura R della traiettoria. Se
l’impulso è negativo, il raggio è minore. Gli ioni
passano in S5 e tornano in S2. Se la frequenza f
del campo è multiplo della frequenza di
ciclotrone (numero di rivoluzioni al secondo):
fc=qB/2πm, gli ioni in S2 sentono sempre lo
stesso impulso e passano in S6 e poi in S7, dove
vengono rivelati.
f= n fc ,con n circa 200 → una piccola variazione
di fc corrisponde a grande differenza di R, gli ioni
non passano attraverso i diaframmi.
34
La misura delle masse
Sorgente di ioni
Se utilizzato per misurare differenze di massa può
arrivare ad una precisione dell’ordine di 10-7.
M1 ed M2 sono focalizzati in S7 con una variazione
della frequenza di oscillazione del campo ∆f
misurabile con grande precisione.
Campo
magnetico B
∆M si ricava da
∆f ∆M
=
f2
M1
o
∆f ∆M
=
f1
M2
35
La misura delle masse
Un altro metodo per misurare differenze di massa è misurare l’energia delle
particelle emesse nelle reazioni nucleari.
Considera la reazione:
x+X →y+Y
Se Y è formato nello stato fondamentale, la differenza di energia cinetica è
uguale alla differenza di energia a riposo. Misurando l’energia delle
particelle posso ricavare il Q-valore della reazione:
Q = [m(x) + m(X) – m(y) – m(Y)]c2 = Tfin – Tini
L’accuratezza di ∆T può essere ~keV, che corrisponde a ∆m=∆T/c2 ~ µu
36
La misura delle masse
Esempio:
1
H +14N →12N + 3H
o
14
12
N ( p, t ) N
Da altre misure conosco:
m(p) = 1.007825 u
m(14N) = 14.003074 u
m(t) = 3.016049 u
Conosco la velocità iniziale di p, misuro la velocità finale di t e ricavo:
Q = -22.1355
0.0010 MeV
m(12N ) = m( p ) + m(14N ) − m(t ) − Q / c 2
= 12.018613
0.000001 u
37
La misura delle masse
In una reazione nucleare, un fascio di particelle a viene fatto collidere con un
bersaglio di nuclei X , fermo nel sistema del laboratorio. Dopo la reazione i prodotti b
e Y vengono emessi con angoli θ e ξ.
b
a
pb
Tenendo conto della conservazione di
θ
pa
X
energia e momento:
ξ
Y
pY
M + MY
Q = b
MY
MY − M a
2( M a Ea M b Eb )1/ 2
Ea −
Eb −
cos θ
MY
MY
Le masse Ma, Mb, MY sono note da altre misure, la velocità iniziale di a è nota e
selezionata, la misura di Eb deve tener conto di correzioni dovute a perdita di
energia e straggling nel target. Dobbiamo anche considerare correzioni
relativistiche. Il peso maggiore nell’errore è dovuto alla precisione dell’angolo θ.
Per θ= 90° , l’indeterminazione ∆θ corrisponde ad un errore in Q pari a
2( M a Ea M b Eb )1/ 2
∆Q =
∆θ
MY
38
La misura delle masse
Misuro anche nuclei instabili
1963
39
La misura delle masse
9Be(d,α)7Li e 9Be(d,7Li)α
La differenza tra i due valori
(≈7 keV) è dovuta
principalmente a effetti di
contaminazione della
superficie del target.
40
La misura delle masse
Lo spettrometro può essere utilizzato anche per misurare l’abbondanza relativa
di isotopi di un dato elemento.
Un fascio di Krypton naturale produce lo spettro mostrato in figura.
Dalle aree relative dei picchi si ricava:
78Kr
0.36%
80Kr
2.27%
82Kr
11.6%
83Kr
11.5%
84Kr
57.0%
86Kr
17.3%
Gli isotopi assenti nello spettro sono instabili e quindi non sono presenti nel
Krypton naturale.
Facendo la somma pesata delle masse dei sei isotopi si ottiene la massa media
del Krypton, che è tabulata nella tavola periodica degli elementi.
41
La misura delle masse
La misura dell’abbondanza relativa può fornire in alcuni casi una misura dell’età
di un particolare campione.
Un classico esempio:
Datazione con 14C:
Questo isotopo non è stabile, ha vita media τ = 8266 anni e decade (β-) in 14N.
Viene prodotto in atmosfera per effetto del bombardamento di raggi cosmici
mediante la reazione:
14
N + n→14C + p
Con un ritmo di produzione medio di 2.2 cm-2s-1.
l’ossigeno e forma anidride carbonica radioattiva
Il 14C si combina con
14CO2,
presente in atmosfera
con una concentrazione atomica relativa di circa 1.18 x10-12.
42
La misura delle masse
Attraverso la fotosintesi viene assorbito dagli esseri viventi. Quando i processi
metabolici finiscono, il 14C non viene più assorbito e la sua concentrazione
diminuisce nel tempo.
[ C]
14
t
=
[ C]
14
− t /τ
e
0
τ ≅ 8266 anni
[ C]
14
0
≅ 1.2 × 10 −12
Limite: 60000 anni
Il materiale da datare viene usato
come sorgente di ioni per un
acceleratore e analizzato in uno
spettrometro magnetico.
43
La misura delle masse
Per misure di datazione con un range di tempo più ampio bisogna utilizzare isotopi
con vita media più lunga. Sfortunatamente tali isotopi non vengono metabolizzati
dagli esseri viventi.
44
La misura delle masse
Ad esempio:
Il Rubidio naturale è composto da:
72%
85Rb
stabile
28%
87Rb
decade β- con TD = 4.7•1010 anni
Il prodotto di decadimento è 87Sr.
Nei minerali contenenti Rb ci sarà una percentuale di 87Sr rispetto a 86Rb più
alta del normale. La misura dell’abbondanza relativa dei due isotopi di Sr può
essere usata per determinare l’età del minerale.
45
La misura delle masse
Conteggi
Esempio: lo Xenon
Spettro di massa degli isotopi del
xenon trovati in un campione di gneiss
avente 2.7 miliardi di anni estratto
dalla penisola di Kola
Spettro degli isotopi dello xenon
presenti in atmosfera
Lo Xe nello gneiss è stato prodotto
dalla fissione spontanea dell’uranio
(K.Schafer, MPI Heidelberg)
46
Numero di massa
La misura delle masse
137Te
97Zr
137I
97Nb
137Xe
137Cs
97Mo
La fissione di un determinato nucleo può
avvenire in diversi modi e questo a
causa del fatto che i neutroni ed i
protoni del nucleo originario, quando
avviene la fissione, si possono ripartire
in modi diversi per formare nuclei più
leggeri (prodotti di fissione), neutroni e
radiazione.
Ad esempio, le possibili reazioni nucleari
che hanno luogo bombardando con
neutroni nuclei di 235U sono oltre 40.
Nella figura è riportata una delle tante
reazioni che riguardano l' 235U, con i
successivi decadimenti fino ad arrivare
ad isotopi stabili.
137Ba
47