VERIFICA DI CHIMICA
NOME COGNOME ………..
2^PC
DATA…………
INDICA LA RISPOSTA CORRETTA
1. SECONDO LA TEORIA ATOMICA DI DALTON:
GLI ATOMI SI MODIFICANO NEL CORSO DELLE REAZIONI CHIMICHE
GLI ATOMI DI UN DATO ELEMENTO SONO UGUALI, MA VARIANO DA
UN ELEMENTO AL’ALTRO
TALVOLTA, ANCHE SE RARAMENTE, GLI ATOMI DI ELEMENTI DIVERSI
SONO UGUALI
DUE COMPOSTI DIVERSI SONO SEMPRE FORMATI DA ATOMI DIVERSI
2. INDIVIDUA L’AFFERMAZIONE ERRATA
I RAPPORTI IN MASSA FRA GLI ELEMENTI SONO COSTANTI NEI
DIVERSI CAMPIONI DELLO STESSO COMPOSTO
I RAPPORTI IN MASSA FRA LE SOSTANZE DISCIOLTE VARIANO
NELLE DIVERSE SOLUZIONI ACQUOSE
I RAPPORTI IN MASSA FRA LE SOSTANZE DISCIOLTE VARIANO
NELLE DIVERSE ALIQUOTE DI UNA DATA SOLUZIONE
QUANDO DUE ELEMENTI FORMANO PIU’ COMPOSTI, I RAPPORTI IN
MASSA FRA GLI ELEMENTI VARIANO DA UN COMPOSTO
ALL’ALTRO
3. INDIVIDUA L’AFFERMAZIONE CORRETTA
LE MOLELCOLE DEGLI ELEMENTI SONO SEMPRE
MONOATOMICHE
TUTTI I COMPOSTI SONO FORMATI DA MOLECOLE
TUTTI GLI ELEMENTI SONO FORMATI DA MOLECOLE
GLI ATOMI DELLO STESSO ELEMENTO POSSONO AVEVRE MASSE
DIVERSE
4. QUALE FORMULA CHIMICA E’ SCRITTA
CORRETTAMENTE ?
Na 1 Br 1
MGSO 4
Ba (ClO 3)2
K 2 cr 2 O 7
5. LA FORMULA CHIMICA DI UN COMPOSTO IONICO
MOSTRA:
IL NUMERO DEGLI IONI PRESENTI IN UN CRISTALLO DEL
COMPOSTO
LA POSIZIONE DEGLI IONI NEL RETICOLO CRISTALLINO
SOLO IL TIPO DI IONI CHE FORMANO IL COMPOSTO
IL TIPO DI IONI PRESENTI NEL COMPOSTO E I LORO RAPPORTI
NUMERICI
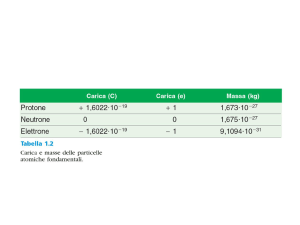
6. GLI IONI H- E H+ DIFFERISCONO NEL NUMERO
DI PROTONI
DI ELETTRONI
DI NEUTRONI
DI MASSA
7. L’ISOTOPO 188O E’ FORMATO DA:
18 PROTONI E 8 NEUTRONI
8 PROTONI E 10 NEUTRONI
8 PROTONI E 18 NEUTRONI
10 PROTONI E 8 NEUTRONI
8. IL CARBONIO –12 E IO CARBONIO –14 DIFFERISCONO NEL
NUMERO
ATOMICO
DI
NEUTRONI
DI
PROTONI
DI
ELETTRONI
9. IL KILOGRAMMO E I SUOI SOTTOMULTIPLI SONO
IMPIEGATI PER ESPRIMERE
LE MASSE ATOMICHE RELATIVE
LE MASSE MOLECOLARI RELATIVE
LE MASSE ATOMICHE ASSOLUTE E LE
MASSE MOLECOLARI ASSOLUTE
IL NUMERO
DI MASSA
DEGLI ISOTOPI
10.
LA MASSA
ATOMICA
RELATIVA DEL CARBONIO –12 E’ PARI
DI UN DATO ELEMENTO
A:
1u
6,022 . 10 23 u
12 u
12 . 6,022 .1023 u
11. IL PESO ATOMICO DI UN ELEMENTO E’ PARI :
AL NUMERO DI MASSA DELL’ISOTOPO PIU’ ABBONDANTE
ALLA MASSA ATOMICA RELATIVA DELL’ISOTOPO PIU’ ABBONDANTE
ALLA MEDIA PONDERATA DELLE MASSE DEI SUOI ISOTOPI ESPRESSE IN U
AL RAPPORTO FRA LA MEDIA PONDERATA DELLE MASSE DEI SUOI ISOTOPI
E LA MASSA DI UN ATOMO DI CARBONIO -12
12. IL PESO MOLECOLARE DI UNA SOSTANZA E’ CIRCA TRE
VOLTE LA MASSA ATOMICA RELATIVA DEL CARBONIO –12.
TALE PESO E’ QUINDI:
3u
36 u
3g
36 g
13. QUALE MATERIALE E’ UN COMPOSTO?
L’ARIA
L’ACQUA
L’ACQUA
SALATA
IL FOSFORO
14. ASSEGNA OGNI MATERIALE ALL’ESATTA CATEGORIA
D’APPARTENENZA
BICARBONATO DI SODIO
SOSTANZA
SOLUZIONE
MISCUGLIO
SALE
SOSTANZA
SOLUZIONE
MISCUGLIO
OLIO LUBRIFICANTE
SOSTANZA
SOLUZIONE
MISCUGLIO
SOLUZIONE
MISCUGLIO
SOLUZIONE
MISCUGLIO
SOLUZIONE
MISCUGLIO
PANE
SOSTANZA
TERRENO
SOSTANZA
ACQUA MINERALE
SOSTANZA
15. SE L’ISOTOPO 3517Cl ACQUISTA UN ELETTRONE, CAMBIA:
IL NUMERO
ATOMICO
LA CARICA DEL
NUCLEO
IL NUMERO
DI MASSA
LA CARICA
COMPLESSIVA
DELL’ATOMO
16. LA MASSA DI DUE ISOTOPI DI CARBONIO –12 E’ PARI A :
2u
24 u
2g
24 g
COS’E’ UN MISCUGLIO OMOGENEO?
…
COS’E’ UN MISCUGLIO ETEROGENEO?
…
COS’E’ UNA MOLECOLA
….
QUALI PARTI COMPONGONO UNA SOLUZIONE?
….