caricato da
common.user16004
Radioterapia e Terapia Metabolica: Diagnostica e Tecniche

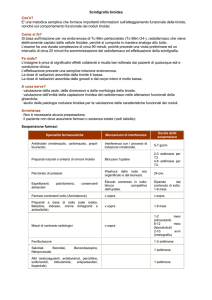
Radioterapia e Terapia Metabolica DIAGNOSTICA PER IMMAGINI IN RADIOTERAPIA Nell’approccio ad un paziente con tumore maligno la chirurgia e la radioterapia possono essere alternative nei tumori della testa e del collo, della prostata e del polmone o complementari nei tumori del retto, della mammella, della prostata. Per i tumori della testa, del collo, della prostata, della mammella e del retto l‘approccio multidisciplinare, in cui abbiamo la collaborazione tra più specialisti, dà una prognosi migliore, avviene attraverso diverse fasi: inquadramento globale, opzioni terapeutiche, valutazione dell’indice terapeutico e proposta al paziente. Nella fase dell’inquadramento terapeutico con la diagnosi istologica possiamo avere importanti indicazioni biologiche e molecolari (specifici antigeni, recettori presenti). A questo si aggiungono le informazioni cliniche, la comorbidità, se ad esempio un paziente con tumore è affetto da Crohn può scegliere tra chirurgia e radioterapia assicurandosi la stessa out-come. Radioimmunoterapia Adroterapia Brachiterapia La RADIOTERAPIA è la branca clinica che si serve di radiazioni ionizzanti, lo scopo fondamentale è convogliare l’agente fisico sull’obiettivo andando a risparmiare altre parti del corpo, soprattutto le aree ad esso adiacenti, garantendo un basso rischio di tossicità per il paziente. La radioterapia a fasci esterni (conformazionale, ad intensità modulata, stereotassica, intraoperatoria, radiochirurgica) si può praticare con un acceleratore lineare, che permette di arrivare in profondità al bersaglio, o con elettroni, che non è in grado di arrivare in profondità, infatti è utilizzata spesso per i tumori cutanei. Una specifica forma di radioterapia, l’adroterapia, usata a Pavia: gli adroni cedono energia, possiamo conoscere a quale profondità vogliamo precisamente convogliarli. La brachiterapia o terapia endocavitaria, endoluminale, endovascolare. Quella endocavitaria è la più frequentemente utilizzata, soprattutto per i tumori della cervice, con Iridio192. Può essere anche interstiziale, utilizzata soprattutto per la prostata con Palladio 103 e Iodio 125. A contatto è molto utilizzata per il melanoma dell’occhio con Oro 198. Per quanto riguarda la terapia con radionuclidi, lo Iodio 131, rappresenta la storia di questa radioterapia, utilizzata soprattutto per il ca.papillifero e per il ca.follicolare della tiroide, è estremamente specifica solo per la tiroide e per questo estremamente efficace. Lo stronzio 89 è utilizzato per le metastasi ossee, così come il samario. Il radio 223 è utilizzato per il tumore metastatico della prostata ed è risultato più efficace del taxotene. La radioimmunoterapia rappresenta una tecnica molto all’avanguardia e anche molto selettiva, la più usata è quella con l’anticorpo anti-CD20 Rituximab, legato ad un isotopo radioattivo, è molto più efficace delle altre terapie, proprio in virtù dell’alta instabilità genetica presente a livello tumorale, viene praticata soprattutto per il linfoma di Hodgkin di alto grado, così da evitare la radioterapia convenzionale. Un altro tipo di radioterapia molto specifica è la terapia recettoriale, utilizzata soprattutto per i tumori neuroendocrini del pancreas. RADIOTERAPIA A FASCI ESTERNI La radioterapia a fasci esterni in oncologia ha ottenuto un ampliamento della finestra terapeutica con aumento del controllo locale e riduzione degli eventi avversi. Si è venuta delineando come un’alternativa alla chirurgia sempre più competitiva soprattutto in considerazione dell’incremento della popolazione anziana. Nell’approccio al paziente neoplastico è necessaria una discussione preliminare tra le varie specialità coinvolte nel trattamento, per capire la terapia più appropriata, considerando comorbidità, età, aspettative e possibilità di guarigione. Si usa l’imaging per lo staging della malattia e quindi per fornire informazioni sulla possibilità da parte della terapia di avere un impatto sulla sopravvivenza del paziente Ci dobbiamo servire di tecniche tomografiche computerizzate per avere immagini che poi possiamo ricostruire tridimensionalmente (TC, RMN, PET-TC), che permettono di definire molto più accuratamente la situazione del paziente da un punto di vista morfologico e funzionale. Fasi della radioterapia Nella FASE DI CENTRATURA c’è l’acquisizione di immagini (CT) relative al paziente e registrazione dei dati della sua posizione, vengono definiti il bersaglio del trattamento e la posizione del paziente. Le macchine che irradiano il paziente hanno infatti un punto di riferimento (isocentro), su cui basano il loro orientamento per irradiare il bersaglio. Vengono utilizzati dei reperi sulla pelle del paziente di modo che possa essere riposizionato allo stesso modo nel bunker dell’acceleratore (c’è un sistema di laser che localizza le tre posizioni nello spazio x, y, z e banalmente vengono segnate delle croci sul paziente date dall’incrocio dei laser alla TC). Vengono inoltre utilizzati dei sistemi di immobilizzazione per riproporre la stessa posizione nelle sedute di trattamento successive, garantiscono la riproducibilità del trattamento e la stabilità del paziente durante la somministrazione con riduzione della variabilità inter e intra-frazione (maschere termoplastiche, sistemi di immobilizzazione di arti, tronco, ecc). Le immagini TC vengono trasferite a una stazione di contouring per la definizione del tumore e degli organi circostanti (viene disegnato sia il bersaglio che gli organi critici, che possono essere responsabili della tossicità). Dobbiamo disegnare il target alla TAC, definire i volumi d’interesse (VOI) e gli organi a rischio (OAR). I vari volumi si definiscono come: o GTV (gross tumor volume): quello che effettivamente vediamo della malattia. Per identificare il GTV dobbiamo servirci dell’imaging più accurato possibile, ad esempio se il GTV sta nel cervello dobbiamo usare la risonanza per disegnarlo e quindi fondere la TC di centraggio con la RNM; nel polmone è invece molto utile la PET che consente di distinguere una massa densa atelettasica dalla massa tumorale vera e propria. o CTV (clinical target volume): quello che immaginiamo ci possa essere come malattia microscopica. Una volta disegnato il GTV sulla base dell’imaging dobbiamo fornire un margine sulla base delle conoscenze cliniche della malattia (es. nei tumori testa-collo gli spazi faringei possono essere sede di malattia microscopica) o ITV (internal taget volume): tiene conto dei possibili movimenti d’organo (es. polmone, intestino) ed è la somma del CTV + internal margin (margine tiene conto delle variazioni del contorno, posizione e dimensione del CTV) o PTV (planning target volume): contempla l’errore di posizionamento o inerente alla macchina, è il volume finale sul quale viene pianificata la dose da erogare ed è la somma di CTV + IM + SM (margine che tiene conto delle incertezze/variazioni interne ed esterne intra e inter-frazione) o OAR (organ at risk): tessuti sani la cui sensibilità alle radiazioni e posizione in prossimità del target possono influenzare significativamente l’esecuzione di un piano di cura e il livello di dose assorbita dal CTV o PRV (planning organ at risk volume) dato dalla somma di OAR + IM + SM È stato ipotizzato per trattamenti più sofisticati anche un target volume biologico (biological-TV), molto utile per grandi CTV (es. zona che capta molto alla PET può avere una dose più alta senza variare la tossicità), per la cui definizione è molto usata la PET. Le FASI DI IMAGE REGISTRATION AND FUSION consentono di allineare le immagini rispetto a uno stesso punto di riferimento che vanno poi integrate e fuse in maniera tale che il sistema possa sovrapporle con il rispetto della sede di malattia. Ci sono vari modi di registrazione, quello attualmente più obiettivabile è basato sui voxel, che comparano le differenze tra i numeri trasformandoli in immagini. Il CTV deve tenere conto di fattori diversi nei vari tumori, una volta disegnato il GTV sulla base dell’imaging dobbiamo fornire un margine sulla base delle conoscenze cliniche della malattia (es. nei tumori testa-collo gli spazi faringei possono essere sede di malattia microscopica). Nella FASE DI PIANIFICAZIONE DEL TRATTAMENTO partendo dalla prescrizione di dose e dalla scelta della tecnica di irradiazione si elabora il piano di trattamento. Si posizionano i campi e si procede all’ottimizzazione basata sull’analisi delle curve di isodose. Il calcolo della dose avviene sulla base della densità elettronica dei tessuti espressa in unità di Hunsfield della TAC. Nella FASE DI SET-UP, riposizionato il paziente come durante la fase di centratura (sistemi di immobilizzazione, reperi cutanei), vanno poi seguite le istruzioni del fisico che consentono di far coincidere l’isocentro del piano (punto in cui si intersecano i fasci), con l’isocentro della macchina (punto in cui si intersecano asse di rotazione del gantry e asse del fascio). Esiste un sistema per fare delle radiografie digitali (con l’occhio del fascio) che possono essere poi comparate con quelle simulate dal fisico con la TC, per verificare che effettivamente la posizione del paziente è quella che deve essere per il trattamento. Nella FASE DI VERIFICA DI SET-UP si fa un confronto delle immagini di centratura con le immagini acquisite all’unità di trattamento sulla base dei DRR (digitally reconstructed radiograph) messe a confronto con le immagini ottenute alla TC. FASE DI EROGAZIONE: In corso di trattamento è necessario eseguire verifiche di posizionamento e in alcuni casi riprogrammare l’intero intervento a causa di un notevole calo ponderale del paziente, progressione di malattia o segni di tossicità acuta non compatibili con quanto pianificato. Nella radioterapia a fasci esterni, utilizzando i raggi X, abbiamo la possibilità di avere la maggiore precisione e gradiente possibile tra la dose data al bersaglio e quella data agli organi critici. Ci sono diverse modalità per conformare la dose (la forma del fascio): se irradiamo il polmone possiamo avere escursioni anche molto ampie del bersaglio, esistono oggi dei sistemi di gating respiratorio che consentono di sparare i raggi soltanto in una fase della respirazione. La radioterapia stereotassica invece si avvale di una tecnica di mappatura tridimensionale molto precisa al fine di guidare un trattamento con campi che entrano da molteplici dimensioni e creano un grosso gradiente di dose (una regione di alta dose molto piccola intorno al bersaglio e una regione di bassa dose subito intorno). Nella radioterapia ad intensità modulata (IMRT) c’è un’elevata conformazione della dose al bersaglio con riduzione significativa della dose ai tessuti sani circostanti. Tramite il movimento del collimatore multilamellare vengono erogati multipli campi di irradiazione di ridotte dimensioni di intensità non omogenea che consentono di ottenere ripidi gradienti di dose. Gli organi a rischio pur essendo presenti nel PTV vengono colpiti da dosi più basse, con miglioramento della finestra terapeutica. Il SIB (multiple simultaneous infield boost) consente di aumentare la dose per alcune strutture anche simultaneamente con l’intensità modulate, oggi possiamo dare questa aggiunta di dose sul volume più piccolo contemporaneamente (dose al bersaglio più grande + supplemento di dose volume più piccolo). Il Cyberknife è una macchina con acceleratore lineare su braccio robotico con porte multiple che potrebbero rendere il trattamento troppo lungo con possibilità di spostamento da parte del paziente. Con queste tecnologie arriviamo a disegnare istogrammi dose- volume che consentono di calcolare le dosi che prende il bersaglio e il volume di bersaglio che effettivamente prende la dose di prescrizione e la dose e volume che prendono gli organi critici. L’istogramma dose-volume dà un’idea di che tipo di trattamento stiamo offrendo al paziente. Il -knife è il primo strumento usato per la radiochirurgia (MAV e piccoli tumori) che utilizza 201 sorgenti di cobalto isofocalizzate distribuite in un’emicirconferenza. La IORT (intraoperative radioterapy) è utilizzata nella radioterapia intraoperatoria, sparando raggi X da 50 kW poco penetranti, per irradiare la cavità dopo quadrantectomia del tumore della mammella. L’adroterapia è utilizzata in Italia al momento solo a Pavia, è un acceleratore di particelle che ha un diametro di circa 30 metri, le radiazioni tendono a deporre l’energia in una maniera più selettiva e precisa. Y-Knife e cyber knife RADIOTERAPIA CON RADIONUCLIDI: La radioattività può essere sfruttata per irradiare un bersaglio nell’organismo: l’approccio metabolico con radionuclidi è molto diverso dalla radioterapia a fasci esterni, dove la sorgente di radiazione è esterna al paziente nel caso della radioterapia metabolica, invece, si inietta una dose terapeutica di un composto radio attivo per colpire determinati bersagli. La dose iniettata si distribuisce a tutto quanto l’organismo, quindi la specificità con cui questa radioattività va a colpire il bersaglio è legata non al fatto che si indirizza il fascio di irradazione su un volume, ma alla specificità del radiofarmaco, cioè quanto questo radiofarmaco sia capace di identificare il bersaglio una volta iniettato nell’ organismo. NB: non è possibile schermare nessun organo, perché il radiofarmaco per via endovenosa attraverso il torrente circolatorio può arrivare a tutti gli organi e a tutti i tessuti. L’ obiettivo principale della radioterapia metabolica è quello di dare una dose al tumore sufficiente dose per uccidere le cellule tumorali, e minima o nulla ai tessuti sani. Per fare questo, occorrono: Veicoli specifici, che riconoscono in maniera selettiva le cellule tumorali: questo veicolo può essere un peptide, un anticorpo, una molecola bioattiva. A questo veicolo devo unire in maniera stabile un radionuclide, che sarà la mia sorgente di radioattività, e il composto che così si forma, che si chiama radiofarmaco, lo devo iniettare al paziente. Si utilizzano radionuclidi emettitori di particelle beta o alfa, perché le radiazioni corpuscolate sono poco penetranti, cioè percorrono nella materia vivente una distanza molto piccola, però in questo tragitto che percorrono cedono molta energia; infatti sono radiazioni caratterizzate da un alto Linear Energy Transfer (LET). Queste particelle quando viaggiano nella materia ionizzano, e ionizzando provocano danni letali alle cellule che quindi muoiono; questa energia rilasciata viene sfruttata a scopo terapeutico. Queste particelle non possono essere usate a scopo diagnostico perché non escono dal corpo, la particella percorre pochi millimetri nella materia vivente quindi non è possibile rilevare la radioattività dall’esterno ma si sfrutta la loro capacità di rilasciare energia all’interno dell’organismo. Le PARTICELLE ALFA hanno un range molto più piccolo, perché sono più pesanti e più cariche, però in questo brevissimo tragitto le cellule con cui interagiscono vengono sicuramente danneggiate in maniera letale; dato il piccolo range della particella alfa, essa deve essere convogliata proprio sulla cellula per poter dare un danno letale. Può colpire la singola cellula per tumori di piccole dimensioni. Tra gli alfa emettitori ritroviamo il radio 223 per uso sperimentale per terapia delle metastasi ossee. Le PARTICELLE BETA possono arrivare ad una energia massima di 1 MEV, hanno un range in acqua che può arrivare massimo a 4 mm, il che consente alle particelle beta di espletare la propria capacità di ionizzazione su molte cellule. Si utilizzano su tumori grandi, tenendo conto della loro energia perché maggiore è energia, più lungo sarà il percorso nella materia. NB: Ci sono alcuni radionuclidi emettitori di particella beta-meno, come lo Iodio131, che oltre ad avere questo tipo di emissione, emettono anche fotoni gamma per cui viene sfruttato a scopo terapeutico. Nel caso dello Iodio131 l’emissione beta viene sfruttata a scopo terapeutico, l’emissione gamma viene sfruttata per l’ imaging, per il total body. Gli ELETTRONI AUGER: hanno un range limitato più delle particelle alfa, si usano quando il bersaglio è direttamente il nucleo della cellula Il radionuclide più utilizzato è lo IODIO131, che ha un’emivita di 8 giorni, un’energia di 606 KEV e un range in acqua di 2,3 mm, cioè le particelle coprono in acqua un percorso di 2,3 mm. Lo Iodio131 può essere utilizzato senza veicolo, nella terapia delle patologie tiroidee perché è assolutamente analogo allo iodio naturale. Una volta all’ interno delle cellule tiroidee queste particelle beta-meno emesse dallo iodio possono determinare danni letali alle cellule follicolari. Lo Iodio131 ha anche un’emissione gamma, e posso sfruttare questi fotoni gamma che fuoriescono dal paziente per avere una scansione totale del corpo, e quindi della distribuzione dello iodio all’ interno dell’organismo. Una volta che si localizza all’ interno delle cellule follicolari, dopo un breve periodo di latenza, i danni provocati dalle particelle beta inducono necrosi cellulare, si ha una reazione infiammatoria letale con distruzione di follicoli, gli ormoni vengono immessi in circolo, e alla fine di questo processo, si ha la fibrosi della ghiandola, e quindi scompaiono le cellule tiroidee Il danno è a carico del DNA in quanto provoca la rottura singola o doppia della catena con danno irreparabile. TRATTAMENTO DEI CARCINOMI DIFFERENZIATI DELLA TIROIDE: Nel 1940 c’è stato il primo impiego dei radionuclidi a scopo terapeutico su soggetti ipertiroidei, per poi, pochi anni dopo, essere utilizzati anche sui carcinomi differenziati. Lo I131 è stato scelto come farmaco perché viene attivamente captato dalle cellule della ghiandola tiroidea è il primo agente TERANOSTICO, una parola che mette insieme due termini quali terapeutico e diagnostico. Lo I131 è il radionuclide con caratteristiche biocinetiche ottimali per queste patologie: L’emivita è di 8 giorni. Non ha una penetranza profonda nei tessuti molli (percorso medio di 0.8mm), a differenza di chemio o radioterapia a fasci esterni, per cui con lo I131 cerchiamo di essere più mirati possibili : ad esempio, può essere utilizzato per rimuovere residui tiroidei. Per questo percorso così breve lo I131 non ha effetti collaterali gravi, non distrugge le cellule limitrofe, si può accumulare in aree fisiologiche ma non ha un effetto fortemente dannoso. L’effetto terapeutico è dovuto al 94% alle radiazioni β, con le quali si può fare sia diagnosi che terapia, a differenza delle γ, con le quali faccio solo diagnosi. Lo I131 può essere quindi usato per distruggere, per ablare, il tessuto tiroideo residuo, per distruggere focolai neoplastici metastatici, oppure per eseguire una scintigrafia post-terapia ad alta sensibilità, allo scopo di ottenere una riduzione di recidive e mortalità tumore-specifica e allo scopo di facilitare il successivo follow-up e misura della Tg (tireoglobulina marker dei CDT) NB: La scintigrafia post-ablativa normalmente si fa 7 giorni dopo la terapia con il radioiodio obbligatoriamente in regime di ricovero di almeno 2 giorni e anche in presenza di grossi residui iodio-captanti può dimostrare la presenza di metastasi. I Carcinomi tiroidei differenziati sono tumori abbastanza rari, però se consideriamo le neoplasie tiroidee nel loro insieme costituiscono la neoplasia più frequente della tiroide (Si sottolinea che la terapia può essere fatta solo nei differenziati, altrimenti il tessuto non capterebbe). I carcinomi differenziati della tiroide si dividono grossolanamente in papillare e follicolare, che si distinguono anche per il modo di dare metastasi : il primo diffonde per via linfatica, con metastasi linfoghiandolari, in particolar modo ai linfonodi della catena latero-cervicale, giugulare e mediastinica, il secondo diffonde per via ematica e metastatizza principalmente in polmoni e ossa. Tra i siti più frequenti di metastasi del follicolare, quelle ossee sono le più resistenti e la terapia con lo iodio131 dev’essere spesso associata alla radioterapia a fasci esternilogicamente si utilizza prima lo I131 e poi a distanza di mesi la radioterapia a fasci esterni, se così non fosse la ghiandola perderebbe il suo potere captante e lo iodio non avrebbe più alcun effetto terapeutico. Se follicolare e papillare rappresentano i due estremi tra i CDT, esistono alcune varianti intermedie come la forma a cellule sclerosanti, a cellule trabecolari, il carcinoma insulare o il carcinoma di Hurthle, che sono importanti perché molto aggressive, in quanto il tumore tende a diventare ‘sdifferenziare’ e, non captando più lo iodio, andrebbe poi instaurato un regime terapeutico più aggressivo. Per la diagnosi nei confronti di un nodulo tiroideo, l’indagine di prima linea è l’ecografia, ma la diagnosi alla fine è comunque citologica con un agoaspirato eco-guidato: in questo modo si rivela il carcinoma differenziato della tiroide. A questo punto la tiroide va asportata con un intervento di tiroidectomia totale, quindi il paziente si sottopone ad una serie di indagini pre-chirurgiche, viene operato, sulla base del campione istologico rimosso all’intervento, viene eseguito un esame anatomopatologico e quindi si completa la stadiazione con i parametri del sistema internazionale T e N. Il parametro M viene stabilito sulla base di indagini strumentali e essenzialmente con il total body con Iodio131. Dopo l’intervento il paziente deve sottoporsi a terapia con Iodio131 per l’ablazione del residuo post-chirurgico, dopo di che viene sottoposto a un periodo di follow-up che può durare anche diversi anni, e che serve per identificare precocemente le recidive loco-regionali e le eventuali metastasi a distanza. Il carcinoma differenziato della tiroide è a buona prognosi, il paziente guarisce in più del 90% dei papilliferi, in più dell’ 80% dei follicolari. Anche se si fa una tiroidectomia totale, il residuo c’è sempre, e deve essere ablato in primo luogo perché può essere sede di microfoci tumorali che potrebbero diventare delle recidive loco-regionali; in secondo luogo bisogna ablare il residuo tiroideo, anche se è costituito da tessuto normale, per poter poi monitorare il paziente con il dosaggio della tireoglobulina e con il total body con Iodio131. Infatti se non si togliesse il residuo tiroideo, si ritroverebbe in circolo la tireoglobulina; se invece lo si distrugge la tireoglobulina sarà indosabile; se i livelli di tireoglobulina cominciano a crescere vuol dire che c’è una recidiva o una metastasi. La stessa cosa per il total body con Iodio131: se lasciassi il residuo tiroideo, lo Iodio131 che somministro al paziente a scopo diagnostico, cioè per vedere come si distribuisce nell’ organismo e se va a localizzarsi in sedi metastatiche di carcinoma tiroideo, sarebbe inficiato dal fatto che questo iodio viene captato dal residuo e non dalle metastasi. Se do una dose terapeutica al paziente di Iodio131 per ablare il residuo, dopo una settimana posso fare una scansione total-body e visualizzare eventuali lesioni a distanza, ossee o linfonodali. Importante è la distinzione tra i pazienti che si avvantaggerebbero della terapia ablante post-chirurgica e quelli che, pur avendo un CDT, non se ne avvantaggerebbero. L’ ablazione del residuo è obbligatoria in tutti quei soggetti a medio ed alto rischio di recidiva, quindi tutti i carcinomi tiroidei differenziati con stadiazione superiore a T1aN0M0, i carcinomi follicolari e tutte le varianti aggressive del carcinoma papillifero, mentre non vengono sottoposti ad ablazione del residuo i soggetti a basso rischio, cioè i carcinomi papillari monofocali, senza metastasi linfonodali o a distanza pari o inferiori a 1cm quindi fino a T1AN0M0. Oggi si sta cercando di rendere la terapia radiometabolica più restrittiva, i pazienti vengono stadiati e divisi in tre categorie: - Rischio molto basso→ no terapia con radioiodio - Rischio basso→ terapia con radioiodio - Alto rischio→ terapia con radioiodio Come si esegue l’ablazione del residuo? 1. Preparazione del paziente: Dopo l’intervento non dovrebbero essere somministrati ormoni tiroidei sostitutivi (L-tiroxina), perché in questo modo il TSH si innalza (per mancanza del feedback negativo) e quando ha raggiunto valori ≥25-30 μU/mL la captazione con lo iodio diventa tale da poter eseguire il trattamento con Iodio131, dose terapeutica. In alternativa alla sospensione della terapia ormonale, c’è la possibilità di somministrare il TSH ricombinante, che come il TSH endogeno stimola le cellule tiroidee a captare lo Iodio131. La dose di ricombinante è di circa 0,9 mg al giorno per due giorni, prima della somministrazione dello iodio, due giorni prima. Altra accortezza per la preparazione: il paziente non deve assumere attraverso la dieta, sostanze contenenti iodio, perché queste sostanze andrebbero a saturare il pool degli ioduri del residuo, e quindi lo iodio radioattivo somministrato in un secondo momento non trova posto per entrare nelle cellule tiroidee, perché il pool degli ioduri è saturo. Bisogna fare molta attenzione alle sostanze che contengono iodio, perché sostanze insospettabili possono contenere elevati livelli di iodio, come i dentifrici, le tinture per capelli, alcune creme di bellezza. Prima della somministrazione di Iodio131 viene comunque fatta una ioduria per vedere se il paziente ha avuto contatto con iodio in eccesso nei giorni precedenti alla somministrazione. Inoltre bisogna escludere uno stato di gravidanza, perché lo Iodio131 passa la placenta controindicazioni assolute: gravidanza e allattamento. Prima della somministrazione bisogna eseguire un test di captazione con scintifigrafia: prima si faceva con tecnezio mentre oggi viene fatto con lo iodio per valutare la distrubuzione del composto all’interno della ghiandola tiroidea. Prima di dare lo iodio si misura sia l’emissione della capsula sia l’attività di fondo (cioè dell’ambiente) e questi dati vengono inseriti nel computer della macchina. Poi si dà una capsula di iodio in quantità irrilevanti (0,01 mCi) e inizia il test di captazione che si può fare a 2-4h, 24h e 48h. Si ottiene una curva di distribuzione e si valuta la percentuale la tiroide che ha captato il tracciante: se è bassa il nodulo non capterà lo iodio e quindi la terapia non serve. In realtà non è più necessario un total body diagnostico prima della somministrazione della dose terapeutica di iodio perché si è visto che può dare un fenomeno di stunning, cioè questa dose di iodio stordisce le cellule tiroidee tumorali, non le uccide ma le impedisce di captare la dose terapeutica di Iodio131. Si esegue invece sempre un total body a distanza di 7 giorni dopo una dose terapeutica di Iodio131. Scintigrafia Totale Corporea con iodio 131 Anche in questa immagine è evidenziabile lo stesso concetto precedente : dopo aver usato lo I131 con dosaggio terapeutico, appare inutile utilizzarlo a scopo diagnostico, con dosaggio minore, per la peggiore risoluzione delle immagini che andremmo ad ottenere. 131 I pre-terapia (TB diagnostico) Sensibilità : 56% Università degli Studi di Napoli Federico I I 131 I post-terapia (TB terapeutico) Sensibilità: 79% 2. La dose di Iodio131 è tra 1110 e 3700 megaBecquerel (MBq), varia tra i 30 milliCurie (mCi) e i 100 mCi. La somministrazione di Iodio131 viene fatta in regime di ricovero protetto, cioè il paziente deve ricoverarsi in stanze di degenza piombate, con tutti i sistemi di dismissione di urine, feci e connessione di tutti i servizi igienici con vasche di decontaminazione e di decadimento, con il rispetto di norme radioprotezionistiche anche per tutto il personale a contatto con questi soggetti. Infatti lo Iodio131 si ritroverà oltre che nelle urine e nelle feci, in tutti i liquidi organici, quindi anche la biancheria, gli asciugamani devono essere ricondotti a norme di radioprotezione. Il soggetto deve essere digiuno prima di assumere lo Iodio131, e deve rimanere digiuno almeno per 3 ore dopo, perché se lo vomita non sappiamo qual è la dose che ha assunto: dobbiamo essere certi che gli abbiamo dato quella dose, e che non venga persa. A 5-7 giorni dalla somministrazione esegue un total body con Iodio131 che fotografa la distribuzione in quel momento e serve a completare la stadiazione: in questa fase possono venire fuori localizzazioni ed accumuli a polmoni, ossa, linfonodi. In questo caso le iper-captazioni dello iodio corrispondono alle ipercaptazioni di FDG. In alcuni casi lo iodio è completamente negativo (non si evidenzia presenza di residuo o di metastasi), invece all’FDG si ha iper- captazione alla zona della tiroide ma soprattutto a livello dei linfonodi latero-cervicali, quindi in alcuni casi può essere utile associare le due procedure. Il paziente viene dimesso quando la sua radioattività è scesa al di sotto dei limiti stabiliti, cioè al di sotto di 25 milli-sievert all’ ora (mSv/h) a 1 metro. Bisogna comunque considerare che anche se la dimissione avviene a questo punto, se il paziente per esempio va in aeroporto e passa ai controlli la radioattività è ancora rilevabile, quindi in genere questi pazienti viaggiano con una certificazione che dice che si sono sottoposti a questo trattamento con Iodio131. NB: Per capire che dose dare al paziente si fanno vari calcoli: - Calcolo dosimetrico: si applica la dosimetria, un modello matematico che viene fuori dalle dimensioni dell’eventuale residuo, da una costante fisica, dal calcolo dei tre diametri trasversali all’ecografia, dall’emivita e si ottiene un valore che non può essere superato, altrimenti si bersaglia troppo la tiroide o il midollo (tossicità). Ma questo calcolo è troppo laborioso e non molto affidabile - Calcolo empirico: è quello più usato, cioè la dose è scelta in base alla categoria del paziente: o In caso di residuo la dose è da 30-50 a 100 mCi o In caso di metastasi linfonodali si arriva a 120 mCi o In caso di metastasi ossee da 200 mCi a salire 3. Dopo la somministrazione di Iodio131 il paziente può riprendere la terapia sostitutiva con levotiroxina, anzi la deve fare se no andrà incontro a sintomi di ipotiroidismo. Il dosaggio della levotiroxina è mantenuto alto per consentire la soppressione del TSH, quindi a livelli inferiori a 0,1 mU/L, e dopo un certo periodo di tempo, quando cioè la remissione completa è stata accertata, cioè il residuo è stato ablato, il dosaggio può essere di tipo sostitutivo. 4. Dopo 8-12 mesi dalla somministrazione di Iodio131 dobbiamo verificare l’efficacia del trattamento. Si fa il dosaggio della tireoglobulina e un total body con Iodio131 con dose diagnostica. Se abbiamo distrutto il residuo non c’è più tireoglobulina circolante, e questo dovrebbe essere confermato anche dalla negatività del total body con Iodio131 Effetti indesiderati possono essere precoci: dolorabilità della regione tiroidea, perdita temporanea del gusto, nausea e vomito, scialoadenite (perché lo iodio va anche nelle ghiandole salivari infatti nella preparazione si dà al paziente un po’ di cortisone a dosi antiinfiammatorie e si dice di masticare molto a partire dal giorno dopo la terapia, per far produrre molta saliva.) In casi più gravi la scialoadenite può evolvere a xerostomia (occlusione dei dotti). Effetti tardivi: il rischio di seconde neoplasie è abbastanza basso, infatti la terapia con Iodio131 viene considerata una delle più sicure da questo punto di vista NB: Per pazienti che assumono più di 1 mCi c’è rischio di sviluppo di leucemia secondaria al trattamento con I131. Non c’è nessun incremento di malformazioni nella progenie, la fertilità femminile, purchè il concepimenyo avvenga dopo almeno 6 mesi dopo il trattamento. Se una donna in gravidanza nonostante tutti i controlli fatti si trova ad avere assunto una dose terapeutica di Iodio131 bisogna rivolgersi al fisico autorizzato, che deve calcolare la dosimetria e quindi la quantità di Iodio131 che il feto ha ricevuto in base alla dose somministrata alla madre. Se questa dose ricevuta dal feto è minore di 100 mSv l’aborto non si prende in considerazione. La fertilità femminile non è compromessa mentre c’è una riduzione della funzione testicolare in >10% dei pazienti. Follow-up: questo paziente che ha ricevuto una dose terapeutica di Iodio131 per ablazione del residuo deve comunque tornare a controllo per vari motivi. Uno di questi, sicuramente importante, è l’identificazione precoce di recidive loco-regionali e metastasi a distanza. Si identificano attraverso scintigrafia total body con Iodio131 in condizioni di TSH stimolato; il paziente quindi che assumeva ormoni tiroidei per terapia sostitutiva li deve sospendere, in modo tale da far salire il TSH fino a oltre le 30 mU. Poi ecografia del collo e dosaggio della tireoglobulina sierica e degli anticorpi anti-tireoglobulina. Se la tireoglobulina è indosabile il paziente è in remissione; se invece è dosabile e addirittura aumenta nel tempo il paziente non è guarito e quindi si innesca tutto un iter diagnostico completo per andare alla ricerca delle recidive o delle metastasi. Non sempre si riesce ad identificare queste metastasi: uno dei problemi clinici più frequenti è che questi pazienti per anni hanno la tireoglobulina elevata, e nonostante si mettano in campo total body con iodio diagnostico, PET-TAC, risonanza e quant’ altro, non si riesce ad identificare il punto in cui la tireoglobulina viene prodotta. In questo caso il medico nucleare insieme all’ endocrinologo decide di trattare il paziente con Iodio131 sulla sola base della tireoglobulina aumentata complessivamente nel tempo, anche se il total body è negativo. Qual è la terapia delle recidive loco-regionali? Se c’è una recidiva loco-regionale il primo tentativo da fare è quello di toglierla chirurgicamente, dopo di che si fa di nuovo il trattamento con Iodio131 alle dosi indicate. Se invece nel corso del follow-up si identificano metastasi a distanza (polmoni, ossa, scheletro in genere), anche qui la presenza di metastasi induce ad un secondo trattamento, stavolta con dosi molto più elevate: possono arrivare ai 300 mCi (per l’ablazione del residuo si arrivava a 100 mCi). Il paziente nonostante metastatico risponde alla terapia finchè non si sdifferenzia, cioè la cellula tiroidea perde il simporto dello iodio e non riesce più a captare. Quindi le indicazioni al trattamento con Iodio131 in caso di carcinoma differenziato della tiroide sono: - Ablazione del residuo - Terapia delle recidive loco-regionali - Terapia delle metastasi - Situazioni cliniche particolari ma non infrequenti, in cui la tireoglobulina cresce ma il total body è negativo Patologie benigne iperfunzionanti della tiroide Altra situazione clinica in cui si utilizza lo Iodio131: patologie benigne iperfunzionanti della tiroide. Lo scopo del trattamento è quello di uccidere le cellule tiroidee per evitare che si formino noduli, quindi condurre il paziente in remissione rispetto all’ ipertiroidismo e ridurre il volume della ghiandola tiroidea. Le indicazioni alla terapia con radioiodio nelle patologie iperfunzionanti della tiroide sono: - Morbo di Basedow - Gozzo tossico multinodulare - Adenoma tossico - Gozzo non tossico multinodulare (che però ha bisogno di stimolazione con TSH ricombinante per poter essere trattato) In ogni caso, nell’ 80-90% dei pazienti trattati con iodio si ha una buona risposta con l’instaurarsi di un eutiroidismo (o ipotiroidismo addirittura) dopo una singola dose di iodio. La terapia con Iodio131 può essere benefica anche per l’oftalmopatia basedowiana, ma ci può essere una fase precoce di recrudescenza dell’ oftalmopatia. Anche qui il paziente viene preparato così come per l’ ablazione del residuo (dieta priva di iodio, test di captazione dello iodio, ioduria ecc), la differenza è che questo trattamento, utilizzando delle dosi molto più basse, può essere eseguito in regime ambulatoriale, cioè il paziente arriva in reparto, assume una dose che non è mai superiore ai 600 MBq di Iodio131 e poi torna a casa con una serie di istruzioni che deve rispettare: per 15 giorni non può frequentare luoghi pubblici essendo radioattivo, tutta la sua biancheria deve essere trattata separatamente rispetto a quella della famiglia, deve usare un bagno personale, deve bere a sufficienza per eliminare il più possibile lo iodio da vescica e dal circolo, spesso gli viene consigliato di mangiare caramelle per aumentare la salivazione e ridurre la scialoadenite. Effetti indesiderati: lieve e transitoria tumefazione del collo, scialoadenite, ipotiroidismo. L’ ipotiroidismo si instaura soprattutto quando la causa principale dell’ ipertiroidismo è una patologia diffusa della tiroide come il Basedow; non si ha con il nodulo autonomo perché quando somministriamo lo Iodio131 nel nodulo autonomo questo va solo nel nodulo, perché il parenchima circostante è soppresso e viene in qualche modo preservato. C’è una piccola percentuale di pazienti che non risponde anche dopo mesi, e questi pazienti che non rispondono a un anno/un anno e mezzo possono essere valutati per ricevere una seconda dose di Iodio131. Anche questi pazienti devono essere seguiti nel tempo soprattutto perché bisogna controllare che non vadano in ipotiroidismo, e bisogna controllare il profilo ematico perché ci potrebbe essere un calo della crasi ematica. TERAPIA RADIO-METABOLICA DEI FEOCROMOCITOMI MALIGNI I feocromocitomi sono fortunatamente molto rari tuttavia non è possibile discriminare tra cellule maligne e benigne in base all’istologia, l’unico modo per differenziare la patologia benigna da quella maligna è l’osservazione di metastasi extrasurrenaliche. Al pari dello Iodio-131 per i tumori tiroidei, la MetaIodoBenzilGuanetidina (MIBG) può veicolare il tracciante nei confronti delle cellule tumorali cromaffini, può avere un effetto di distruzione cellulare sfruttando la radiazione β- dello iodio, dal momento la MIBG viene resa radioattiva grazie al legame con lo iodio131. Del resto mentre per la tiroide utilizziamo lo iodio radioattivo come tale, per i feocromocitomi si utilizza lo stesso tracciante sfruttato a scopo diagnostico anche per la terapia radio-metabolica, ma a dosi molto più elevate (naturalmente è fondamentale che ci sia una positività all’esame diagnostic preliminare). Per quanto riguarda la diagnostica del feocromocitoma maligno c’è la possibilità di effettuare una scintigrafia con MIBG con scansione total-body, che consente di valutare se vi è un interessamento tumorale extrassurenalico, in particolar modo a livello delle principali sedi metastatiche (fegato, polmoni, ossa o linfonodi). Naturalmente la presenza di multipli foci di captazione è indice di malignità, in particolar modo se vi è captazione in queste sedi anatomiche (fegato, polmone, ossa o linfonodi). Esistono però anche dei paragangliomi multipli e, in questo caso, la presenza di focolai multipli di captazione, non indica una condizione di malignità ma di benignità, dal momento che sono varie stazioni del sistema simpatico ad essere interessate. I chemodectomi sono localizzati a livello del collo, mentre i paragangliomi sono localizzati lungo la colonna vertebrale. Inoltre consente di effettuare un follow-up post-chirurgico; monitorare gli effetti della chemioterapia. Benigno Terapia Chirurgia Chemioterapia Radioterapia metabolica Maligno In condizioni normali di distribuzione della MIBG c’è una concentrazione nelle ghiandole salivari, minimamente a livello cardiaco (perché il tessuto cardiaco ha una rilevazione da parte del sistema nervoso simpatico), a livello epatico (c’è un’eliminazione attraverso le vie biliari), a livello di tutte le anse intestinali ed infine a livello urinario. In uno studio con confronto fra un gruppo di feocromocitomi benigni ed un gruppo di feocromocitomi maligni, il risultato interessante è l’intensa captazione da parte delle lesioni maligne (maggiore rispetto a quelle benigne). In questo caso sembrerebbe quasi che non ci sia captazione nella lesione benigna, in realtà c’è una captazione molto leggera. Non succede sempre così, dal momento che ci sono dei casi in cui anche le lesioni benigne concentrano, però ci può una tendenza da parte delle lesioni maligne a concentrare di più. Nel followup post-chirurgico l’integrazione con la TAC mostra nella loggia surrenalica sinistra una serie di artefatti da clips chirurgiche che determinano una difficoltà nella valutazione del distretto. Terapia con iodio-131 MIBG nel Feocromocitoma maligno Il primo composto utilizzato per la radioterapia metabolica del feocromocitoma maligno metastatico è la terapia metabolica con Iodio131 MIBG. Questo tracciante si concentra particolarmente all’interno dei granuli neurosecretori delle cellule del sistema simpaticoadrenergico (tessuto cromaffine) sia che siano confinate in sede midollare surrenalica sia che si trovino in sede metastatica (quindi anche in caso di tumori non trattabili con altre possibilità mediche, sia chirurgiche che chemioterapiche). L’emivita dello I131è di circa 8 giorni, un vantaggio qualora lo I131 sia utilizzato a scopo terapeutico, perché si ha una persistenza della radioattività nelle sedi tumorali, mentre è inutile quando il tracciante è utilizzato a scopo diagnostico. Quindi l’effetto terapeutico dello I 131 è legato alle emissioni β- e si può avere un meccanismo d’azione diretto per danno a livello del DNA, oppure un meccanismo d’azione indiretto Feocromocitoma metastatico per diffusione dell’energia radiante alle cellule adiacenti o per produzione di metaboliti tossici. Il protocollo standard con dosi multiple è indicato come trattamento di prima linea nei pazienti con progressione di malattia da lenta a moderata, o come trattamento di seconda linea in pazienti in rapida progressione nonostante la chemioterapia. Il protocollo con dose elevata singola è indicato come trattamento di prima linea nei pazienti con progressione di malattia da lenta a moderata con evidenza di lesioni ossee e dei tessuti molli, o come trattamento di seconda linea nei pazienti in rapida progressione nonostante la chemioterapia e con evidenza di lesioni ossee e dei tessuti molli. E’ importante che siano sospesi tutti i farmaci che possano interferire con la capatazione della MIBG, come il labetalolo, la reserpina, ecc. Inoltre è indicato il pre-trattamento con soluzione soprasatura di ioduro di potassio, per bloccare la captazione dello iodio libero da parte della tiroide che deve essere sempre preservata (dal moento che dando dosi elevate vi può essere una captazione e quindi un danno a livello tiroideo). Per quanto riguarda la risposta tumorale, si può avere un’eterogeneità di risposta: alcune lesioni rispondono e quindi si riducono di dimensioni, mentre altre non si riducono. Ciò dipende dalla quantità di composto radioattivo sufficiente che raggiunge la lesione e dalla presenza di condizioni vascolari favorevoli che consentano una corretta captazione del tracciante da parte della lesione. Risultati della risposta alla terapia con Iodio-131 MIBG Ormonale Tumorale RC 13% 4% RP>50% 32% 26% MS 40% 57% P 15% 13% Prima e dopo la terapia con I-131 È chiaro che in fase terapeutica, in una fase terminale dove il paziente non è più fortemente radioattivo, ma è ancora sufficiente per una stadiazione, potete sfruttare anche tutta la radioattività a scopo diagnostico. Rispetto alla valutazione ormonale, in termini di risposta, la risposta tumorale dà qualche informazione in più, perché c’è una correlazione maggiore tra la risposta tumorale (ovvero la valutazione delle dimensioni delle lesioni) e la reale presenza di malattia, rispetto alla correlazione tra risposta ormonale (cioè il livelli di catecolamineI e la malattia) e malattia. Le precauzioni da prendere quando si decide di effettuare un trattamento con MIBG sono la valutazione della funzione epatica e renale; c’è infatti una concentrazione fisiologica del tracciante in questi organi, quindi più funzionano e meglio è. Le controindicazioni assolute sono ovviamente la gravidanza e l’allattamento (perdita di questa sostanza attraverso la secrezione mammaria), l’incontinenza urinaria (per i rischi di contaminazione) o eventuali incompatibilità da parte del paziente con le norme di radioprotezione. Altre indicazioni della terapia con Iodio131 MBG - - - Pazienti con malattia avanzata a livello surrenalico a scopo citoriduttivo, nei casi in cui il trattamento chirurgico non può essere proposto Sterilizzazione della loggia surrenalica per l’ablazione di eventuali residui tumorali (utilizza lo stesso principio dei tumori tiroidei) Associazione alla chemioterapia nei pz con malattia avanzata Effetti collaterali - Nausea Vomito - Depressione emolinfopoietica Analoghi della somatostatina Nei paziente che non hanno captazione della MIBG (casi molto rari) è possibile considerare la terapia alternativa con gli analoghi della somatostatina, il principio è sempre lo stesso, utilizziamo un composto diverso purché ci sia l’espressione dei recettori da parte del tumore, evidenziati all’Octreoscan. Tutto dipende dall’espressione recettoriale, abbiamo un quadro normale di distribuzione di questo composto, che mette in evidenza meglio il distretto epato-splenico e renale. Radionuclidi utilizzati con gli analoghi della somatostatina Indio-111, nella maggioranza Ittrio-90, un β- emittente puro, quindi ideale per il trattamento radiometabolico Lutezio-177, in parte β- Terapia con Octreotide