caricato da
ferrari.andrea83
Proprietà dei Materiali: Microstruttura e Classificazione

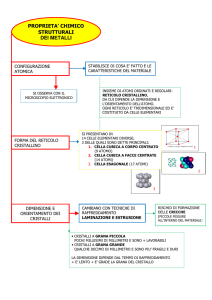
LE PROPRIETA’ DEI MATERIALI PARTE 1 : CLASSIFICAZIONE PARTE 2: Microstruttura dei materiali metallici CLASSIFICAZIONE METALLI • Metalli puri : (Ferro,rame,oro,argento,….) • Leghe metalliche (Acciaio, Bronzo, ghisa, ottone,….) • Schiume metalliche ( CERAMICI • Ottimi isolanti termici ed elettrici, sono materiali refrattari, elevata durezza, bassa densità, fragili. • Es. Utilizzo (protezioni termiche ad alte temperature) COMPOSITI Fibre di carbonio, Fibre di vetro, kevlar, ….. POLIMERI (Materie Plastiche) Es. Poliammidi , policarbonati, …… Materiali metallici – il legame metallico • LEGAME METALLICO: è il particolare legame che si instaura tra gli atomi del metallo stesso, da esso derivano le proprietà del metallo allo stato solido. • Gli atomi che costituiscono il metallo cedono elettroni di valenza, diventando ioni positivi, gli elettroni di valenza ceduti formano una nube che avvolge gli ioni stessi. • In virtù di tale legame tra gli atomi metallici si ottiene: • Elevata densità • Lucentezza • Compattezza • Elevata conducibilità termica ed elettrica • Le forze di legame, di natura elettrostatica, non impediscono al metallo di deformarsi sotto l’azione di forze esterne, ne deriva quindi: • Mallebilità (possibilità di essere ridotto in lamine) • Duttilità (possibilità di essere ridotto in fili) Microstruttura dei metalli • Allo stato liquido gli atomi del metallo possiedono elevato contenuto energetico, tanto più elevato quanto maggiore è la temperatura. Gli atomi del metallo sono quindi in movimento ed il moto è tanto più caotico tanto più è elevata la tamperatura. • Raggiunta la temperatura di solidificazione il metallo inizia la trasformazione dallo stato liquido a quello solido. • Il processo di solidificazione è caratterizzato da due fasi distinte: nucleazione e crescita. • NUCLEAZIONE: al diminuire della temperatura l’agitazione molecolare degli atomi diminuisce, essi si aggregano in tanti piccoli nuclei, nascono i primi germi di solidificazione all’interno del metallo liquido. • CRESCITA: i nuclei precedentemente solidificati attraggono ulteriori atomi aumentando il proprio volume. A solidificazione terminata la struttura ottenuta prende il nome di grano cristallino. Microstruttura dei metalli • La velocità di raffreddamento è di fondamentale importanza infatti: • Un lento raffreddamento porta alla formazione di pochi germi di cristallizzazione e quindi si formano grani cristallini grossolani. • Un rapido raffreddamento porta alla formazione di molti germi di cristallizzazione e quindi si ottiene un grano cristallino più fine, a cui corrisponde un metallo più resistente. • Se la velocità di raffreddamento è troppo elevata, gli atomi del metallo non dispongono del tempo necessario per disporsi secondo il reticolo cristallino. Inoltre un brusco raffreddamento comporta una temperatura di solidificazione inferiore a quella di standard di riferimento per quel determinato metallo. Microstruttura dei metalli • In corrispondenza del punto in cui avviene la solidificazione vi è un rilascio di energia sotto forma di calore che impedisce, in quei punti, ulteriore cristallizzione. La solidificazione continua invece altrove. • i germi iniziali accrescono allora secondo strutture ramificate dette dendriti. • Proseguendo nel processo di solidificazione si osserva la crescita in volume dei germi iniziali. • I bordi di grano rivestono un ruolo fondamentale in quanto è in corrispondenza di questi che si trovano impurità e si ha l’inizio di fenomeni di corrosione. RETICOLO CRISTALLINO • Allo stato solido gli atomi metallici tendono ad assumere una disposizione regolare e compatta detta reticolo cristallino. • È possibile immaginare il reticolo cristallino come formato da tante celle dette elementari. • Principalmente risultano di interesse le seguenti celle elementari: • Cubica corpo centrato (c.c.c.) • Cubica a facce centrate (c.f.c.) • Esagonale compatta (e.c.) Cella Cubica corpo centrato c.c.c. • Tipica di elementi come: • Molibdeno (Mo) • Vanadio V • Tungsteno W • Cromo Cr • Ferro 𝛼 (Fe stabile per T< 912 °C) • Ferro 𝛿 (Fe stabile 1394 < T< 1538 °C ) • Statisticamente appartengono alla cella soltanto 2 atomi: quello centrale e gli otto atomi al vertice per la misura di un ottavo ciascuno in quanto condivisi con le celle adiacenti 1+8⋅ 1 =2 8 I metalli con struttura c.c.c presenatano: • Elevato punto di fusione • Poca plasticità • Poca malleabilità • Media duttilità E’ possibile immaginare una cella elementare di forma cubica caratterizzata dalla presenza di un atomo in ogni vertice ed uno posto al centro della cella. Cella Cubica facce centrate c.f.c. • Tipica di elementi come: • Alluminio Al • Nichel Ni • Rame Cu • Ferro 𝛾 (Fe stabile 1394 < T< 912 °C) • Statisticamente appartengono alla cella soltanto 4 atomi: quello centrale ad ogni faccia per la misura di un mezzo in quanto condiviso con la cella adiacente e gli otto atomi al vertice per la misura di un ottavo ciascuno in quanto condivisi con le celle adiacenti 1 1 6⋅ +8⋅ =4 2 8 I metalli con struttura c.f.c presenatano: • Elevato punto di fusione • elevata plasticità, malleabilità e duttilità • Buona conducibilità termica ed elettrica E’ possibile immaginare una cella elementare di forma cubica caratterizzata dalla presenza di un atomo al centro di ogni faccia ed uno in ogni vertice. Cella Esagonale Compatta (e.c.) • Tipica di elementi come: • Titanio Ti • Zinco Zn • Cadmio Cd • Cobalto 𝛼 (per 20 <T< 467 °C) • Magnesio Mg • Statisticamente appartengono alla cella soltanto 6 atomi: i tre centrali alla stessa, quello centrale alle due base per la misura di un mezzo in quanto condiviso con la cella adiacente ei dodici atomi al vertice per la misura di un sesto ciascuno in quanto condivisi con le celle adiacenti 1 1 12 ⋅ + 2 ⋅ + 3 = 6 6 2 La struttura e.c. È stabile, compatta e facilmente deformabile meccanicamente. Compattezza e deformabilità risultano intermedie tra ccc e cfc. E’ possibile immaginare una cella elementare avente forma di un prisma esagonale caratterizzato dalla presenza di un atomo al centro delle due basi, uno in ogni vertice e tre atomi centrali alla cella DIFETTI RETICOLARI • I difetti del reticolo cristallino sono anche detti difetti reticolari. Per difetto reticolare si intende una alterazione della distribuzione degli atomi che costituiscono il reticolo cristallino del metallo. • Si possono distinguere differenti tipologie di difetto nel reticolo cristallino di una massa metallica: 1. Vacanze reticolari( mancanza di un atomo) 2. Uno o più atomi in posizione interstiziale 3. Una vacanza e un atomo in posizione interstiziale 4. Presenza di un atomo non metallico. 5. Dislocazioni • I primi due dipendono dalla temperatura, maggiore è quest’ultima e maggiore è il numero di difetti presenti. La presenza di un atomo non metallico è evitabile solamente riportando il metallo allo stato liquido. Difetti del reticolo cristallino DIFETTO DI VACANZA • VACANZE RETICOLARI: atomi localmente assenti nel reticolo cristallino. La presenza di vacanze determina, specialmente alle alte temperature, fenomeni di diffusione atomica. • può accadere infatti che qualche atomo, in presenza di una vacanza, si sposti dalla sua posizione andando ad occupare il posto vacante. Può anche accadere che un atomo interstiziale causi lo spostamento di un atomo dalla sua posizione regolare, occupandola, facendolo diventare a sua volta un atomo interstiziale. • Contrazione del reticolo cristallino (nascono tensioni interne), la presenza di tensioni interne rende Il metallo meno deformabile . Difetti del reticolo cristallino IMPURITA’ • IMPURITA’ (DIFETTO DI PUNTO) • Si ha una impurità interstiziale quando si presenta l’inserimento di un atomo estraneo in un posizione non prevista dalla struttura del reticolo cristallino ideale. Crea distorsione del reticolo e presenza di tensioni interne. • Si ha impurità sostituzionale quando un atomo estraneo occupa una posizione al posto dell’atomo previsto dalla struttura reticolare ideale. La presenza di un atomo differente comporta l’alterazione di alcune proprietà come per esempio la conducibilità elettrica. Difetti del reticolo cristallino • DISLOCAZIONI (DIFETTI DI LINEA) Sono difetti estesi e non localizzati in un unico DISLOCAZIONE A SPIGOLO punto del reticolo. Interessano l’intero «edificio cristallino». Si distinguono in: • DISLOCAZIONI A SPIGOLO • DISLOCAZIONI A VITE • Durante il processo di solidificazione si ha una disposizione dei piani cristallini che risulta quindi «distorta» rispetto alla configurazione ideale. • Immaginiamo di sottoporre a sforzi tangenziali una maglia quadrata di atomi, se quest’ultima risulta ordinata sarà richiesto un notevole sforzo di taglio per determinarne la deformazione. • Se invece la condizione di partenza presenza dislocazioni allora per creare una deformazione del reticolo stesso sarà richiesto un minor sforzo di taglio. DISLOCAZIONE A VITE LEGHE METALLICHE • Una lega metallica è un’unione, stabile a temperatura ambiente, di un metallo con altri elementi chimici. • Il componente più abbondante è detto solvente, il componente meno abbondante è detto soluto. • La solidificazione della lega metallica avviene per nucleazione e crescita. • Si osservano cinque differenti tipi di reticoli cristallini: • Soluzione solida di sostituzione disordinata • Soluzione solida di sostituzione ordinata • Soluzione solida di inserimento interstiziale • Composti intermetallici • Cristalli eutettici • Si ha miscibilità nulla allo stato solido, quando durante raffreddando della lega il soluto si separa dal solvente. Allo stato solido, il soluto ed il solvente, danno origine a strutture cristalline differenti e separate tra loro LEGHE METALLICHE • Soluzione solida di sostituzione disordinata : gli atomi del soluto si sostituiscono agli atomi del solvente in modo casuale. Gli atomi del soluto e quello del solvente sono di dimensioni circa uguali, si ha completa miscibilità allo stato solido. • Soluzione solida di sostituzione ordinata : gli atomi del soluto si dispongono ordinatamente nel reticolo del solvente. Si ottengono due strutture reticolari l’una nell’altra. • Soluzione solida di inserimento interstiziale: gli atomi del soluto si inseriscono negli spazi vuoti del reticolo del solvente. LEGHE METALLICHE • Composto intermetallico: gli atomi degli elementi di lega si dispongono in modo ordinato o disordinato all’interno del reticolo, ma sono sempre presenti in percentuali ben determinate. • Cristalli Eutettici: Durante la solidificazione si forma una struttura alternata globulare e lamellare. Allotropia del ferro puro • (Fe 𝜶) Il ferro puro si presenta alla temperatura ambiente con struttura c.c.c. stabile fino alla temperatura di 912 °C. • (Fe 𝜸) è stabile tra i 912°C ed i 1394 °C e presenta una struttura c.f.c. • (Fe 𝜹) è stabile dalla temperatura di 1394°C fino alla temperatura di fusione (1538°C). Si presenta con reticolo c.c.c. • Il ferro puro è magnetico fino alla temperatura di 770 °C, poi è amagnetico. • (Fe 𝜷) si ha per temperature comprese tra 770°C e 912°C